2016届广东省惠州市高三上学期第二次调研测试化学试卷
广东
高三
阶段练习
2017-07-27
404次
整体难度:
适中
考查范围:
有机化学基础、认识化学科学、物质结构与性质、化学实验基础、常见无机物及其应用、化学反应原理
2016届广东省惠州市高三上学期第二次调研测试化学试卷
广东
高三
阶段练习
2017-07-27
404次
整体难度:
适中
考查范围:
有机化学基础、认识化学科学、物质结构与性质、化学实验基础、常见无机物及其应用、化学反应原理
一、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
1. 2015年诺贝尔生理学或医学奖授予我国女药学家屠呦呦,她从中药中分离出青蒿素应用于疟疾治疗.青蒿素的键线结构简式如图.下列关于青蒿素的说法不正确的是


| A.分子式为C15H22O5 |
| B.属于芳香族化合物 |
| C.可发生水解反应 |
| D.含有过氧键(-O-O-)有强氧化性 |
【知识点】 有机官能团的性质及结构 酯的化学性质 多官能团有机物的结构与性质解读
您最近一年使用:0次
2016-12-09更新
|
185次组卷
|
3卷引用:2016届广东省惠州市高三上学期第二次调研测试化学试卷
单选题
|
较易(0.85)
2. 常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+═2Fe3++2H2O;2Fe3++H2O2═2Fe2++O2↑+2H+.下列说法中,不正确的是
| A.在H2O2分解过程中,Fe2+是反应的催化剂 |
| B.在H2O2生产过程中,要严格避免混入Fe2+ |
| C.H2O2的氧化性比Fe3+强,还原性比Fe2+强 |
| D.在H2O2分解过程中,溶液的pH逐渐下降 |
【知识点】 氧化还原反应基本概念
您最近一年使用:0次
2016-12-09更新
|
89次组卷
|
2卷引用:2016届辽宁省鞍山一中高三上学期12月模拟化学试卷
单选题
|
适中(0.64)
3. 设NA为阿伏加德罗常数的值.下列说法正确的是
| A.1mol乙烯分子中含有的共价键数目为4NA |
| B.2L 0.5mol•L﹣1(NH4) 2SO4溶液中NH4+离子总数为2NA |
| C.1mol FeBr2与足量氯气反应时,转移的电子数为3NA |
| D.1mol Na2O2固体中含离子总数为4NA |
【知识点】 化学计量
您最近一年使用:0次
单选题
|
适中(0.65)
名校
4. X、Y、M、N是短周期且原子序数依次增大的主族元素。已知X的最外层电子数是电子层数的3倍,X、M同主族,Y的原子在短周期主族元素中原子半径最大。下列有关说法正确的是
| A.M、N的简单离子半径: r(N-)>r(M2﹣) |
| B.气态氢化物的稳定性:M>X |
| C.X、Y形成的化合物中只有离子键 |
| D.X、Y、N所形成化合物的水溶液可能显中性或碱性 |
您最近一年使用:0次
2016-12-09更新
|
148次组卷
|
3卷引用:2016届广东省惠州市高三上学期第二次调研测试化学试卷
单选题
|
适中(0.64)
5. 为提纯下列物质(括号内为杂质)选用的试剂和分离方法都正确的是
| 物质 | 试剂 | 分离方法 | |
| ① | KNO3(NaCl) | 蒸馏水 | 降温结晶 |
| ② | CO2(HCl) | 饱和Na2CO3溶液 | 洗气 |
| ③ | 乙酸乙酯(乙酸) | NaOH溶液 | 分液 |
| ④ | Cl2(HCl) | 饱和NaCl溶液 | 洗气 |
| A.①③ | B.①④ | C.只有 ④ | D.③④ |
【知识点】 化学实验基础
您最近一年使用:0次
单选题
|
适中(0.65)
6. 下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
| 选项 | 实验 | 现象 | 结论 |
| A. | 向品红溶液中通入少量Cl2 | 品红溶液褪色 | Cl2具有漂白性 |
| B. | 将等质量的铜粉分别投入稀硝酸和浓硝酸中 | 分别产生为无色和红棕色气体 | 稀硝酸的氧化性比浓硝酸强 |
| C. | 将鸡蛋壳置于醋酸中浸泡一段时间 | 鸡蛋壳大部分溶解且有气泡冒出 | 醋酸的酸性强于碳酸 |
| D. | 向漂白粉中滴加少量浓盐酸 | 产生刺激性气味气体 | 漂白粉已经变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
二、多选题 添加题型下试题
多选题
|
较难(0.4)
7. 常温下,有下列四种溶液:
下列说法正确的是
① | ② | ③ | ④ |
| 0.1mol/LNaOH溶液 | pH = 11的NaOH溶液 | 0.1mol/L CH3COOH溶液 | pH = 3的CH3COOH溶液 |
| A.由水电离出H+的浓度c(H+) :①>③ |
| B.将④加蒸馏水稀释至原来的100倍时,所得溶液的pH=5 |
| C.①与③混合,若溶液pH = 7,则体积V(NaOH)>V(CH3COOH) |
| D.将②与④等体积混合,若溶液pH < 7,各离子浓度的关系为:c(CH3COO-) + c(OH-) = c(Na+) +c(H+) |
【知识点】 弱电解质的电离平衡
您最近一年使用:0次
2016-01-17更新
|
148次组卷
|
3卷引用:2016届广东省惠州市高三上学期第二次调研测试化学试卷
三、解答题 添加题型下试题
解答题-实验探究题
|
较难(0.4)
8. 乳酸亚铁{[CH3CH(OH)COO]2Fe}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得。
I.制备碳酸亚铁:装置如图所示。

(1)装置B发生反应的离子方程式为_______________________ ;B中可观察到的现象是铁粉逐渐溶解,_________________________ 。
(2)将B中生成的FeCl2溶液压入装置C的操作是______________________ 。
Ⅱ.制备乳酸亚铁:
将制得的FeCO3加入乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应,然后再加入适量乳酸。
(3)FeCO3与乳酸[CH3CH(OH)COOH]反应的离子方程式为_________________________ 。
(4)反应后加入适量乳酸的作用是________________ 。
(5)从所得溶液中获得乳酸亚铁晶体所需的实验操作是_________ 、过滤、洗涤、干燥。
(6)设计实验证明乳酸亚铁中含Fe2+___________________________________ 。
I.制备碳酸亚铁:装置如图所示。

(1)装置B发生反应的离子方程式为
(2)将B中生成的FeCl2溶液压入装置C的操作是
Ⅱ.制备乳酸亚铁:
将制得的FeCO3加入乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应,然后再加入适量乳酸。
(3)FeCO3与乳酸[CH3CH(OH)COOH]反应的离子方程式为
(4)反应后加入适量乳酸的作用是
(5)从所得溶液中获得乳酸亚铁晶体所需的实验操作是
(6)设计实验证明乳酸亚铁中含Fe2+
【知识点】 化学实验基础
您最近一年使用:0次
解答题-实验探究题
|
困难(0.15)
9. 常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源

(1)操作A的名称为____________ 。
(2)铜帽溶解时加入H2O2的目的是____________________ (用化学方程式表示)。铜帽溶解完全后,可采用___________ 方法除去溶液中过量的H2O2。
(3)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为__________________________ 。
(4)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2↑+6H2O。
① 当1 mol MnO2参加反应时,共有_____ mol电子发生转移。
② MnO (OH)与浓盐酸在加热条件下也可发生反应,试写出该反应的化学方程式:___________________ 。
(5)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:

根据上图可知:
① pH对Hg吸收率的影响规律是随pH升高,汞的吸收率_____________________ 。
② 在强酸性环境下Hg的吸收率高的原因可能是KMnO4在酸性条件下_________ 强。

(1)操作A的名称为
(2)铜帽溶解时加入H2O2的目的是
(3)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为
(4)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2↑+6H2O。
① 当1 mol MnO2参加反应时,共有
② MnO (OH)与浓盐酸在加热条件下也可发生反应,试写出该反应的化学方程式:
(5)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:

根据上图可知:
① pH对Hg吸收率的影响规律是随pH升高,汞的吸收率
② 在强酸性环境下Hg的吸收率高的原因可能是KMnO4在酸性条件下
【知识点】 化学实验基础
您最近一年使用:0次
四、填空题 添加题型下试题
填空题
|
较难(0.4)
10. 甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料。
(1)以下是工业上合成甲醇的两个反应:
反应I: CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II:CO2(g)+3H2(g) CH3OH(g)+ H2O(g) ΔH2
CH3OH(g)+ H2O(g) ΔH2
① 上述反应符合“原子经济”原则的是______ (填“I”或“II”)。
② 下表所列数据是反应I在不同温度下的化学平衡常数(K)。
由表中数据判断反应I为______ 热反应(填“吸”或“放”)。
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为_________________ ,此时的温度为______________ (从表中选择)。
(2) 已知在常温常压下:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1 kJ/mol
② 2CO(g)+ O2(g)= 2CO2(g) ΔH2 kJ/mol
③ H2O(g)= H2O(l) ΔH3 kJ/mol
则反应CH3OH(l)+ O2(g)= CO(g)+ 2H2O(l) ΔH=__________ kJ/mol
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O2‾7)时,实验室利用下图装置模拟该法:

① N电极的电极反应式为________________________ 。
② 请完成电解池中Cr2O2‾7转化为Cr3+的离子反应方程式:
Cr2O7 2‾+_____ Fe2+ +___ ═= ______ Cr3++____ Fe3++_____ H2O
(4) 处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10‾5 mol•L﹣1时,Cr3+沉淀完全,此时溶液的pH=________ 。(已知, Ksp[Cr(OH)3]=6.4×10‾31,lg2=0.3)
(1)以下是工业上合成甲醇的两个反应:
反应I: CO(g)+2H2(g)
 CH3OH(g) ΔH1
CH3OH(g) ΔH1反应II:CO2(g)+3H2(g)
 CH3OH(g)+ H2O(g) ΔH2
CH3OH(g)+ H2O(g) ΔH2① 上述反应符合“原子经济”原则的是
② 下表所列数据是反应I在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
③ 某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为
(2) 已知在常温常压下:
① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1 kJ/mol
② 2CO(g)+ O2(g)= 2CO2(g) ΔH2 kJ/mol
③ H2O(g)= H2O(l) ΔH3 kJ/mol
则反应CH3OH(l)+ O2(g)= CO(g)+ 2H2O(l) ΔH=
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O2‾7)时,实验室利用下图装置模拟该法:

① N电极的电极反应式为
② 请完成电解池中Cr2O2‾7转化为Cr3+的离子反应方程式:
Cr2O7 2‾+
(4) 处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10‾5 mol•L﹣1时,Cr3+沉淀完全,此时溶液的pH=
您最近一年使用:0次
五、解答题 添加题型下试题
解答题-有机推断题
|
较难(0.4)
11. 聚合物F的合成路线图如下:
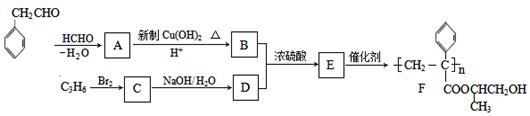
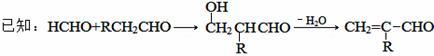
请据此回答:
(1) A中含氧官能团名称是_______ ,C的系统命名为_________ 。
(2) 检验B中所含官能团所用的试剂有______ ;E→F的反应类型是___________ 。
(3) G物质的相对分子质量比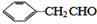 的相对分子质量大2,则符合下列条件的G的同分异构体有
的相对分子质量大2,则符合下列条件的G的同分异构体有_____ 种。
① 分子中含有苯环,且苯环上有两个取代基 ② 遇氯化铁溶液变紫色
(4) C生成D的反应化学方程式为_____________________________ ,如果C与NaOH的醇溶液反应,则生成的有机物的结构简式为_______________ 。
(5) 参照上述合成路线,设计一条由甲醛、乙醛和甲醇为主要原料制备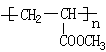 的合成路线
的合成路线_____________________________ 。

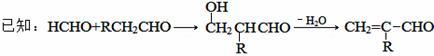
请据此回答:
(1) A中含氧官能团名称是
(2) 检验B中所含官能团所用的试剂有
(3) G物质的相对分子质量比
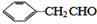 的相对分子质量大2,则符合下列条件的G的同分异构体有
的相对分子质量大2,则符合下列条件的G的同分异构体有① 分子中含有苯环,且苯环上有两个取代基 ② 遇氯化铁溶液变紫色
(4) C生成D的反应化学方程式为
(5) 参照上述合成路线,设计一条由甲醛、乙醛和甲醇为主要原料制备
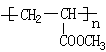 的合成路线
的合成路线
您最近一年使用:0次
解答题-实验探究题
|
较难(0.4)
12. 高锰酸钾在实验室和工农业生产中有广泛的用途,实验室以二氧化锰为主要原料制备高锰酸钾,其部分流程如下:

(已知锰酸钾为墨绿色固体、高锰酸钾为紫黑色固体)
(1)在操作①和②中,MnO2是该反应的_______________ (“氧化剂”或“还原剂”);第①步加热熔融时应选用的仪器是________________ :A. 铁坩埚 B. 瓷坩埚 C. 石英坩埚
(2)为提高第③步的浸出速率,可采取的措施有__________ 、___________ (写出两项即可)。
(3)第④步通入适量CO2,发生反应生成MnO4-和MnO2和碳酸盐,则发生反应的离子方程式为______________________________________ 。
(4)第⑥步加热浓缩至液面有细小晶体析出时,停止加热,冷却结晶、过滤、洗涤、干燥。干燥过程中,温度不宜过高,其原因是______________________ (用化学方程式表示);所得晶体中可能含有的可溶性杂质的化学式为_______________ 。
(5)H2O2和KMnO4都是常用的强氧化剂,若向H2O2溶液中滴加酸性高锰酸钾溶液,则酸性高锰酸钾溶液会褪色,写出该反应的离子方程式:___________________________ 。

(已知锰酸钾为墨绿色固体、高锰酸钾为紫黑色固体)
(1)在操作①和②中,MnO2是该反应的
(2)为提高第③步的浸出速率,可采取的措施有
(3)第④步通入适量CO2,发生反应生成MnO4-和MnO2和碳酸盐,则发生反应的离子方程式为
(4)第⑥步加热浓缩至液面有细小晶体析出时,停止加热,冷却结晶、过滤、洗涤、干燥。干燥过程中,温度不宜过高,其原因是
(5)H2O2和KMnO4都是常用的强氧化剂,若向H2O2溶液中滴加酸性高锰酸钾溶液,则酸性高锰酸钾溶液会褪色,写出该反应的离子方程式:
【知识点】 化学实验基础
您最近一年使用:0次
解答题-结构与性质
|
适中(0.65)
解题方法
13. 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍。E有“生物金属”之称,E4+和氩原子的核外电子排布相同。
请回答下列问题:
(1)B、C、D三种元素的电负性由小到大的顺序为____________ ,E的基态原子的电子排布式为_____________ 。
(2)由B、D形成的BD32-离子中,其VSEPR模型名称是____________ ,离子的中心原子采用______________ 杂化。
(3)已知由A、C、D三种元素按照4:2:3的原子个数比可形成某离子化合物,常温下测得该离子化合物的水溶液pH=5,则该溶液中水电离出的氢离子浓度为_______________ 。
(4)D、E和钡三种元素构成的某化合物的晶胞结构如右图所示,该化合物的化学式为_____________ 。

(5)纳米级的EO2是一种广泛使用的催化剂,实验室往往通过ECl4在大量水中加热水解制得EO2·xH2O,该反应的化学方程式为_________________ 。
请回答下列问题:
(1)B、C、D三种元素的电负性由小到大的顺序为
(2)由B、D形成的BD32-离子中,其VSEPR模型名称是
(3)已知由A、C、D三种元素按照4:2:3的原子个数比可形成某离子化合物,常温下测得该离子化合物的水溶液pH=5,则该溶液中水电离出的氢离子浓度为
(4)D、E和钡三种元素构成的某化合物的晶胞结构如右图所示,该化合物的化学式为

(5)纳米级的EO2是一种广泛使用的催化剂,实验室往往通过ECl4在大量水中加热水解制得EO2·xH2O,该反应的化学方程式为
【知识点】 物质结构与性质综合考查解读
您最近一年使用:0次
2019-01-30更新
|
318次组卷
|
4卷引用:2015届四川省眉山市高三第一次诊断性考试理综化学试卷
试卷分析
整体难度:适中
考查范围:有机化学基础、认识化学科学、物质结构与性质、化学实验基础、常见无机物及其应用、化学反应原理
试卷题型(共 13题)
题型
数量
单选题
6
多选题
1
解答题
5
填空题
1
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 有机官能团的性质及结构 酯的化学性质 多官能团有机物的结构与性质 | |
| 2 | 0.85 | 氧化还原反应基本概念 | |
| 3 | 0.64 | 化学计量 | |
| 4 | 0.65 | 由元素性质的递变规律进行相关推断 根据原子结构进行元素种类推断 “位构性”关系理解及应用 | |
| 5 | 0.64 | 化学实验基础 | |
| 6 | 0.65 | 次氯酸及其性质 漂白粉和漂粉精 硝酸的强氧化性 乙酸与常见几种酸的酸性比较 | |
| 二、多选题 | |||
| 7 | 0.4 | 弱电解质的电离平衡 | |
| 三、解答题 | |||
| 8 | 0.4 | 化学实验基础 | 实验探究题 |
| 9 | 0.15 | 化学实验基础 | 实验探究题 |
| 11 | 0.4 | 常见官能团名称、组成及结构 同分异构体的数目的确定 逆合成分析法 有机推断综合考查 | 有机推断题 |
| 12 | 0.4 | 化学实验基础 | 实验探究题 |
| 13 | 0.65 | 物质结构与性质综合考查 | 结构与性质 |
| 四、填空题 | |||
| 10 | 0.4 | 化学反应热的计算 化学平衡 电解池 | |



