2016届广东省潮州市朝安区凤凰中学高三上学期期中化学试卷
广东
高三
期中
2017-07-27
271次
整体难度:
适中
考查范围:
常见无机物及其应用、有机化学基础、认识化学科学、物质结构与性质、化学反应原理、化学实验基础
2016届广东省潮州市朝安区凤凰中学高三上学期期中化学试卷
广东
高三
期中
2017-07-27
271次
整体难度:
适中
考查范围:
常见无机物及其应用、有机化学基础、认识化学科学、物质结构与性质、化学反应原理、化学实验基础
一、单选题 添加题型下试题
单选题
|
适中(0.64)
1. 化学无处不在,下列与化学有关的说法正确的是
| A.Si有良好的半导体性能,可直接用于制备光导纤维 |
| B.淀粉、纤维素、蛋白质、油脂都是天然高分子化合物 |
| C.用食醋可除去热水壶内壁的水垢 |
| D.Cu的金属活泼性比Fe弱,故水库铁闸门上接装铜块可减缓铁腐蚀 |
【知识点】 碳族元素及其化合物
您最近一年使用:0次
2016-12-09更新
|
162次组卷
|
2卷引用:2016届广东省粤西“四校”高三上学期第一次联考化学试卷
单选题
|
适中(0.65)
名校
2. 2015年诺贝尔生理学或医学奖授予我国女药学家屠呦呦,她从中药中分离出青蒿素应用于疟疾治疗.青蒿素的键线结构简式如图.下列关于青蒿素的说法不正确的是


| A.分子式为C15H22O5 |
| B.属于芳香族化合物 |
| C.可发生水解反应 |
| D.含有过氧键(-O-O-)有强氧化性 |
【知识点】 有机官能团的性质及结构 酯的化学性质 多官能团有机物的结构与性质解读
您最近一年使用:0次
2016-12-09更新
|
185次组卷
|
3卷引用:2016届广东省惠州市高三上学期第二次调研测试化学试卷
单选题
|
适中(0.64)
3. 在下列给定条件的溶液中,一定能大量共存的离子组是
| A.无色溶液中:K+、Cu2+、OH-、NO3- |
| B.含有大量Fe3+的溶液:Na+、Mg2+、I-、SCN- |
| C.pH=12的溶液中:K+、NH4+、SO42-、NO3- |
| D.水电离产生的c(OH-)=1×10-12mol·L-1的溶液中:K+、Na+、Cl-、NO3- |
【知识点】 离子共存
您最近一年使用:0次
2019-01-30更新
|
103次组卷
|
2卷引用:2016届广东省粤西“四校”高三上学期第一次联考化学试卷
单选题
|
适中(0.65)
解题方法
4. NA表示阿伏加德罗常数,下列叙述正确的是
| A.常温下,9g H2O中含NA个O﹣H键 |
| B.1 molFe2+与足量稀硝酸反应,转移3 NA个电子 |
| C.常温常压下,22.4L SO2和O2的混合气体中含2NA个氧原子 |
| D.1 L 0.1 mol•L﹣1,KAl(SO4)2溶液含0.1NA个Al3+ |
您最近一年使用:0次
单选题
|
适中(0.65)
5. 四种短周期元素在周期表中的位置如图,其中只有M元素原子最外层电子数与电子层数相等,下列说法不正确的是


| A.原子半径Z<M |
| B.非金属性:X<Z |
| C.M元素最高价氧化物对应水化物具有两性 |
| D.Y的最高价氧化物对应水化物的酸性比X的弱 |
您最近一年使用:0次
2018-12-06更新
|
136次组卷
|
9卷引用:2014届广东省韶关市高三调研测试理综化学试卷
单选题
|
较难(0.4)
名校
6. 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构中如右图所示:.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,化学方程式为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl.下列说法中错误的是
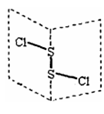

| A.S2Cl2的结构式为Cl-S-S-Cl |
| B.S2Cl2分子中既有有极性键又有非极性键 |
| C.反应中SO2是还原产物,S是氧化产物 |
| D.反应中,生成 1molSO2,转移电子为3mol |
【知识点】 氧化还原反应方程式的配平解读 极性分子和非极性分子解读
您最近一年使用:0次
2016-04-20更新
|
916次组卷
|
11卷引用:2013届安徽省马鞍山市高中毕业班第一次教学质量检测理综化学试卷
(已下线)2013届安徽省马鞍山市高中毕业班第一次教学质量检测理综化学试卷2016届湖南省衡阳市第八中学高三上学期第一次月考化学试卷2016届江西省吉安一中高三上学期期中测试化学试卷2016届广东省潮州市朝安区凤凰中学高三上学期期中化学试卷2015-2016学年湖北省宜昌一中高二下3月月考化学试卷2015-2016学年甘肃天水一中高一下第一次月考化学试卷2017届湖南省衡阳八中高三上学期9月月考化学试卷湖南省邵东县第一中学2017届高三上学期第三次月考化学试题福建省龙岩市武平县第一中学2021届高三上学期10月月考化学试题(已下线)练习15分子的结构与物质的性质-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)广东省梅州市虎山中学、蕉岭中学、平远中学、宪梓中学四校2021-2022学年高二下学期5月联考化学试题
单选题
|
适中(0.64)
7. 铜锌原电池(如图)工作时,下列叙述正确的是


| A.一段时间后,铜棒上有红色物质析出 |
| B.正极反应为:Zn﹣2e﹣=Zn2+ |
| C.在外电路中,电流从锌棒流向铜棒 |
| D.盐桥中的K+移向ZnSO4溶液 |
【知识点】 原电池
您最近一年使用:0次
二、解答题 添加题型下试题
解答题-工业流程题
|
较难(0.4)
解题方法
8. 硼镁泥是一种工业废料,主要成分是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如下:
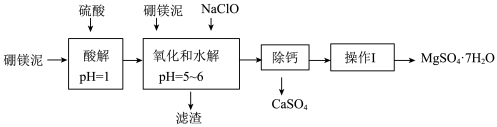
已知:某些氢氧化物沉淀的pH如下表所示:
根据题意回答第(1)~(6)题:
(1)在酸解过程中,欲加快酸解时的化学反应速率,请提出两种可行的措施:________________ .
(2)加入的NaClO可与Mn2+反应:Mn2++ClO﹣+H2O═MnO2↓+2H++Cl﹣,还有一种离子也会被NaClO氧化,并发生水解,该反应的离子方程式为_________________ .
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3、MnO2外,还有______________________ .
(4)已知MgSO4、CaSO4的溶解度如下表:
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤是蒸发浓缩,____________ .“操作I”是将滤液继续蒸发浓缩,冷却结晶,__________ ,便得到了MgSO4•7H2O.
(5)实验中提供的硼镁泥共100g,得到的MgSO4•7H2O为172.2g,计算MgSO4•7H2O的产率为_______ .(保留两位有效数字)
(6)金属镁可用于自然水体中铁件的电化学防腐,完成如图防腐示意图,并作相应标注___________ .


已知:某些氢氧化物沉淀的pH如下表所示:
| 氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
 | 9.3 | 10.8 |
 | 7.6 | 9.6 |
 | 2.7 | 3.7 |
 | 3.7 | 4.7 |
根据题意回答第(1)~(6)题:
(1)在酸解过程中,欲加快酸解时的化学反应速率,请提出两种可行的措施:
(2)加入的NaClO可与Mn2+反应:Mn2++ClO﹣+H2O═MnO2↓+2H++Cl﹣,还有一种离子也会被NaClO氧化,并发生水解,该反应的离子方程式为
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3、MnO2外,还有
(4)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
 | 30.9 | 33.4 | 35.6 | 36.9 |
 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤是蒸发浓缩,
(5)实验中提供的硼镁泥共100g,得到的MgSO4•7H2O为172.2g,计算MgSO4•7H2O的产率为
(6)金属镁可用于自然水体中铁件的电化学防腐,完成如图防腐示意图,并作相应标注

您最近一年使用:0次
三、填空题 添加题型下试题
填空题
|
较难(0.4)
9. 甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料.
(1)以下是工业上合成甲醇的两个反应:
反应Ⅰ:CO(g)+2H2(g)═CH3OH(g)
反应Ⅱ:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)
上述反应符合“原子经济”原则的是______________ (填“I”或“II”).
(2)已知在常温常压下:
甲醇脱水反应2CH3OH(g)═CH3OCH3(g)+H2O(g)△H1=﹣23.9kJ•mol﹣1
甲醇制烯烃反应2CH3OH(g)═C2H4(g)+2H2O(g)△H2=﹣29.1kJ•mol﹣1
乙醇异构化反应C2H5OH(g)═CH3OCH3(g))△H3=+50.7kJ•mol﹣1
则乙烯气相直接水合反应C2H4(g)+H2O(g)═C2H5OH(g)的△H=_______________ kJ•mol﹣1.
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O2‾7)时,实验室利用下图装置模拟该法:
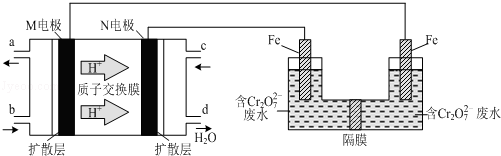
①N电极为燃料电池的____________ 极,分别写出M、N两电极的电极反应式为_________ 、________ .
②请完成电解池中Cr2O2‾7转化为Cr3+的离子反应方程式:
Cr2O2‾7+________ Fe2++________ ═________ Cr3++________ Fe3++_________ H2O
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10‾5mol•L﹣1时,Cr3+沉淀完全,此时溶液的pH=_________________ .(已知:Ksp=6.4×10‾31,lg2=0.3)
(1)以下是工业上合成甲醇的两个反应:
反应Ⅰ:CO(g)+2H2(g)═CH3OH(g)
反应Ⅱ:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)
上述反应符合“原子经济”原则的是
(2)已知在常温常压下:
甲醇脱水反应2CH3OH(g)═CH3OCH3(g)+H2O(g)△H1=﹣23.9kJ•mol﹣1
甲醇制烯烃反应2CH3OH(g)═C2H4(g)+2H2O(g)△H2=﹣29.1kJ•mol﹣1
乙醇异构化反应C2H5OH(g)═CH3OCH3(g))△H3=+50.7kJ•mol﹣1
则乙烯气相直接水合反应C2H4(g)+H2O(g)═C2H5OH(g)的△H=
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O2‾7)时,实验室利用下图装置模拟该法:

①N电极为燃料电池的
②请完成电解池中Cr2O2‾7转化为Cr3+的离子反应方程式:
Cr2O2‾7+
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10‾5mol•L﹣1时,Cr3+沉淀完全,此时溶液的pH=
您最近一年使用:0次
四、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.64)
10. 硼及其化合物在工业上有许多用途.以铁硼矿(主要成分为Mg2B2O5•H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:

回答下列问题:
(1)写出Mg2B2O5•H2O与硫酸反应的化学方程式__________________ .
(2)利用______ 的磁性,可将其从“浸渣1”中分离.“浸渣1”中还剩余的物质是_______ (写化学式).
(3)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为___________ .
(4)“净化除杂”需先加H2O2溶液,作用是________ .然后再调节溶液的pH约为5,目的是________ .
(5)“粗硼酸”中的主要杂质是_______________ (填名称).

回答下列问题:
(1)写出Mg2B2O5•H2O与硫酸反应的化学方程式
(2)利用
(3)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为
(4)“净化除杂”需先加H2O2溶液,作用是
(5)“粗硼酸”中的主要杂质是
【知识点】 化学实验基础
您最近一年使用:0次
五、填空题 添加题型下试题
11. 次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式_______________________ .
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银.
①(H3PO2)中,P元素的化合价为_____________________ .
②利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为:____________ (填化学式).
③NaH2PO2为_____________ (填“正盐”或“酸式盐”),其溶液显___________ (填“弱酸性”、“中性”或“弱碱性”).
(3)(H3PO2)的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应.写出白磷与Ba(OH)2溶液反应的化学方程式________________ .
(4)H3PO2也可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):

①写出阳极的电极反应式____________________ .
②分析产品室可得到H3PO2的原因_______________________ .
③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是产品中混有__________ 杂质.
(1)H3PO2是一元中强酸,写出其电离方程式
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银.
①(H3PO2)中,P元素的化合价为
②利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为:
③NaH2PO2为
(3)(H3PO2)的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应.写出白磷与Ba(OH)2溶液反应的化学方程式
(4)H3PO2也可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):

①写出阳极的电极反应式
②分析产品室可得到H3PO2的原因
③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是产品中混有
您最近一年使用:0次
2016-12-09更新
|
237次组卷
|
2卷引用:2016届广东省潮州市朝安区凤凰中学高三上学期期中化学试卷
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、有机化学基础、认识化学科学、物质结构与性质、化学反应原理、化学实验基础
试卷题型(共 11题)
题型
数量
单选题
7
解答题
2
填空题
2
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.64 | 碳族元素及其化合物 | |
| 2 | 0.65 | 有机官能团的性质及结构 酯的化学性质 多官能团有机物的结构与性质 | |
| 3 | 0.64 | 离子共存 | |
| 4 | 0.65 | 阿伏加德罗常数的应用 结合气体物质与NA相关推算 结合氧化还原反应知识与NA相关推算 结合物质结构基础知识与NA相关推算 | |
| 5 | 0.65 | 元素周期律、元素周期表的推断 根据原子结构进行元素种类推断 “位构性”关系理解及应用 | |
| 6 | 0.4 | 氧化还原反应方程式的配平 极性分子和非极性分子 | |
| 7 | 0.64 | 原电池 | |
| 二、解答题 | |||
| 8 | 0.4 | 含氧化铝的混合物的提纯 溶度积常数相关计算 金属的化学腐蚀与电化学腐蚀 物质分离、提纯综合应用 | 工业流程题 |
| 10 | 0.64 | 化学实验基础 | 实验探究题 |
| 三、填空题 | |||
| 9 | 0.4 | 化学反应热的计算 电解池 | |
| 11 | 0.4 | 电离方程式 氧化还原反应的规律 盐溶液的酸碱性判断 电解原理的理解及判断 | |



