2016届湖北省宜昌市高三上学期1月调研考试理综化学试卷
湖北
高三
阶段练习
2017-07-27
622次
整体难度:
容易
考查范围:
认识化学科学、化学反应原理、物质结构与性质、有机化学基础、化学实验基础
2016届湖北省宜昌市高三上学期1月调研考试理综化学试卷
湖北
高三
阶段练习
2017-07-27
622次
整体难度:
容易
考查范围:
认识化学科学、化学反应原理、物质结构与性质、有机化学基础、化学实验基础
一、单选题 添加题型下试题
单选题
|
容易(0.94)
1. 下列关于安全问题的说法,不正确的是
| A.危险化学品包括易燃易爆物质、强氧化性物质等 |
| B.处置实验过程产生的剧毒药品废液,稀释后用水冲走 |
| C.金属钠着火不能用水浇灭,应使用干砂灭火 |
| D.少量白磷通常保存在冷水中,防止白磷被氧化。 |
【知识点】 氧化还原反应
您最近一年使用:0次
单选题
|
适中(0.65)
真题
名校
2. 一般情况下,前者无法决定后者的是
| A.原子核外电子排布——元素在周期表中的位置 |
| B.弱电解质的相对强弱——电离常数的大小 |
| C.分子间作用力的大小——分子稳定性的高低 |
| D.物质内部储存的能量——化学反应的热效应 |
您最近一年使用:0次
2019-01-30更新
|
1261次组卷
|
11卷引用:2015年全国普通高等学校招生统一考试化学(上海卷)
2015年全国普通高等学校招生统一考试化学(上海卷)2016届河北省衡水市冀州中学高三复习班上月考化学试卷2016届福建省厦门市第六中学高三上学期期中测试化学试卷2016届江西省上饶县中学高三上学期第三次月考化学试卷2016届山西省山西大学附属中学高三上12月月考化学试卷2016届湖北省宜昌市高三上学期1月调研考试理综化学试卷【全国百强校】甘肃省兰州市第一中学2018届高三考前最后冲刺模拟化学试题上海市华东师范大学附属天山学校2018-2019学年第二学期高三模拟考试化学试题上海市华东师大二附中2016-2017学年高二(上)月考化学试卷(12月份)(已下线)专题八 物质结构与元素周期律(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训四川省武胜烈面中学校2019-2020学年高二下学期期中考试化学试题
单选题
|
较易(0.85)
3. 设NA表示阿伏加德罗常数的值,下列说法正确的是
| A.常温下,1.0L1.0mol·L-1KAlO2溶液中含有的氧原子数为2NA |
| B.7.8gNa2O2固体中含有的阴离子数为0.2NA |
| C.标准状况下,体积为2.24L的CO2和SO2的混合气体中含有的氧原子数为0.2NA |
| D.0.1molCl2参加氧化还原反应,转移的电子数目一定是0.2NA |
【知识点】 阿伏加德罗常数
您最近一年使用:0次
2016-12-09更新
|
140次组卷
|
3卷引用:2016届湖北省宜昌市高三上学期1月调研考试理综化学试卷
单选题
|
容易(0.94)
4. 在一定条件下,0.2 mol下列气体分别与1 L 0.2 mol.L一1的NaOH溶液反应,形成的溶液pH最小的是
| A.SO3 | B.SO2 | C.NO2 | D.CO2 |
【知识点】 水的电离及溶液的酸碱性
您最近一年使用:0次
单选题
|
适中(0.65)
名校
5. 短周期元素W、X、Y、Z的原子序数依次增大,W与Y最外层电子数之和为X的最外层电子数的2倍,Z最外层电子数等于最内层电子数,X、Y、Z的简单离子的电子层结构相同,W的单质是空气中体积分数最大的气体。下列说法正确的是( )
| A.Y的最高价氧化物对应水化物的酸性比W的强 |
| B.W的简单气态氢化物比X的稳定 |
| C.离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z) |
| D.XY2与ZY2中的化学键类型相同 |
您最近一年使用:0次
2020-06-23更新
|
182次组卷
|
12卷引用:2016届江苏省南京市六校高三上学期12月联考化学试卷
2016届江苏省南京市六校高三上学期12月联考化学试卷2016届湖北省宜昌市高三上学期1月调研考试理综化学试卷2016届江苏省清江中学高三考前周练模拟化学试卷2017届湖北省荆门市部分高中高三上九月联考化学试卷河南省中原名校(豫南九校)2018届高三上学期第四次质量考评(期中)化学试题江西省莲塘一中、临川二中2018届高三上学期第一次联考化学试题安徽省滁州市民办高中2017-2018学年高一下学期第二次月考化学试题河南省南阳市2020届高三上学期期中质量评估化学试题四川省雅安中学2019-2020学年高一6月月考(期中)理综化学试题贵州省遵义市南白中学2020届高三第六次联考化学试题四川省眉山市洪雅中学2021届高三12月月考理综化学试题江西省贵溪市实验中学2023-2024学年高三下学期4月第二次月考化学试卷
单选题
|
适中(0.64)
名校
6. 某有机物的结构简式如图所示,下列有关该有机物的说法正确的是( )


| A.分子中含有2种官能团 |
| B.可与乙醇、乙酸反应,且反应类型相同 |
| C.与钠和氢氧化钠溶液都能发生反应,且得到的产物相同 |
| D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
【知识点】 有机物的结构特点
您最近一年使用:0次
2016-12-09更新
|
118次组卷
|
2卷引用:2016届湖北省宜昌市高三上学期1月调研考试理综化学试卷
单选题
|
较易(0.85)
7. 下列实验装置不能达到实验目的的是


| A.比较非金属性强弱: Si弱于C,C弱于S |
| B.用四氯化碳提取碘水中的碘单质 |
| C.观察烧碱的焰色反应 |
| D.比较NaHCO3和Na2CO3的热稳定性 |
【知识点】 化学实验基础
您最近一年使用:0次
二、解答题 添加题型下试题
解答题-实验探究题
|
较易(0.85)
解题方法
8. 无水氯化铜是铜(II)的氯化物,化学式为CuCl2,棕黄色固体,吸收水分后变为蓝绿色的二水合物,实验室用如下装置制备少量无水氯化铜。完成下列填空:

(1)写出烧瓶中(B处)发生反应的化学方程式:____ 。
(2)c中盛有的试剂为__________ ,进行实验时应先点燃__ (选填“B”或“D”)处酒精灯。
(3)F中盛有碱石灰,其目的是____ (选填序号)。
a.吸收HCl b.吸收Cl2c.吸收CO2d.吸收H2SO4
(4)将D中固体改为市售氯化铜(CuCl2.2H2O,Mr=171),也能进行无水氯化铜的制备,此时向D中通入HCl气体,目的是___ 。若实验条件控制不当,最终得到的物质是碱式氯化铜[化学式为Cu4(OH)nCl(8-n)],且质量是原市售氯化铜的62.7%,则可推算n的值为___ (整数值)。
(5)有同学提出将上述装置F(干燥管)改为碱液来处理尾气,请在方框内画出尾气处理装置图__________ 。

(1)写出烧瓶中(B处)发生反应的化学方程式:
(2)c中盛有的试剂为
(3)F中盛有碱石灰,其目的是
a.吸收HCl b.吸收Cl2c.吸收CO2d.吸收H2SO4
(4)将D中固体改为市售氯化铜(CuCl2.2H2O,Mr=171),也能进行无水氯化铜的制备,此时向D中通入HCl气体,目的是
(5)有同学提出将上述装置F(干燥管)改为碱液来处理尾气,请在方框内画出尾气处理装置图

您最近一年使用:0次
2016-12-09更新
|
203次组卷
|
2卷引用:2016届湖北省宜昌市高三上学期1月调研考试理综化学试卷
三、填空题 添加题型下试题
填空题
|
较易(0.85)
9. 氮及其化合物在工农业生产、生活中有着重要作用。
(1)下图1是1molNO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式________________
(2)在固定容积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ·mol-1 用一定物质的量的N2和H2合成NH3,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其它条件相同的情况下,实验测得反应均进行到t min时NH3的质量分数如右图所示
2NH3(g) △H=-92.4kJ·mol-1 用一定物质的量的N2和H2合成NH3,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其它条件相同的情况下,实验测得反应均进行到t min时NH3的质量分数如右图所示

此时甲、乙、丙三个容器中一定达到化学平衡状态的是____________ ,都达到平衡状态时,NH3的质量分数最高的是____________ 。
下图2是实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)="0.10" mol/L,c(H2) =" 0.26" mol/L进行反应时,N2的浓度随时间的变化如下图①、②、③曲线所示。

I.该反应实验②平衡时H2的转化率为______________ 。
II.据图2所示,②装置中有一个条件与①不同。请指出②相对①改变的条件_____________ 。
III.计算实验③的平衡常数为___________________ 。
(3)最近美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入碱性电解质溶液中,一个电极通入空气,另一电极通入NH3.其电池反应生成一种单质和一种化合物,写出负极的电极反应式____________ 。
(4)铜与一定浓度硝酸反应时方程式可表示为:Cu+HNO3一Cu(NO3)2+NO +NO2 +H2O(方程式未配平)。3.2 g Cu被硝酸完全溶解后,如果得到的NO和NO2物质的量相同,则得到标准状况下NO体积为__________ L。
(1)下图1是1molNO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式
(2)在固定容积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)
 2NH3(g) △H=-92.4kJ·mol-1 用一定物质的量的N2和H2合成NH3,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其它条件相同的情况下,实验测得反应均进行到t min时NH3的质量分数如右图所示
2NH3(g) △H=-92.4kJ·mol-1 用一定物质的量的N2和H2合成NH3,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其它条件相同的情况下,实验测得反应均进行到t min时NH3的质量分数如右图所示
此时甲、乙、丙三个容器中一定达到化学平衡状态的是
下图2是实验室在三个不同条件的密闭容器中,分别加入浓度均为c(N2)="0.10" mol/L,c(H2) =" 0.26" mol/L进行反应时,N2的浓度随时间的变化如下图①、②、③曲线所示。

I.该反应实验②平衡时H2的转化率为
II.据图2所示,②装置中有一个条件与①不同。请指出②相对①改变的条件
III.计算实验③的平衡常数为
(3)最近美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入碱性电解质溶液中,一个电极通入空气,另一电极通入NH3.其电池反应生成一种单质和一种化合物,写出负极的电极反应式
(4)铜与一定浓度硝酸反应时方程式可表示为:Cu+HNO3一Cu(NO3)2+NO +NO2 +H2O(方程式未配平)。3.2 g Cu被硝酸完全溶解后,如果得到的NO和NO2物质的量相同,则得到标准状况下NO体积为
【知识点】 反应热
您最近一年使用:0次
填空题
|
适中(0.64)
10. 草酸钴用途广泛,可用于指示剂和催化剂的制备。一种利用水钻矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4.2H2O工艺流程如下:

已知:,①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的目的是。
(2)将氯气通入到热的浓氢氧化钠溶液可以来制取NaClO3,请写出该反应的离子方程式为______________;实验需要制取10.65克NaClO3,需要的氯气由电解食盐水生成,若不考虑反应过程中的损失,则同时生成的氢气的体积为____.(标准状况下)。
(3)萃取剂对金属离子的萃取率与pH的关系 ,如图所示。滤液II中加入萃取剂的作用是;使用萃取剂最适宜的pH是(填选项序号)。

A.接近2.0
B.接近3.0
C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.05×10-1。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=________
(5)为测定制得的无水草酸钴样品的纯度,现称取样品mg,先用适当试剂将其转化,得到纯净的草酸铵溶液,再用过量的稀硫酸酸化,用c mol/L高锰酸钾溶液去滴定,当溶液由时(填颜色变化),共用去高锰酸钾溶液V mL,计算草酸钴样品的纯度为。
(6)浓度均为0.l mol/L的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为
已知:H2SO3Ka1=1.54×10-2Ka2=1.02×10-7
H2CO3Ka1=4.3×10-7Ka2=5.6×10-11

已知:,①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)将氯气通入到热的浓氢氧化钠溶液可以来制取NaClO3,请写出该反应的离子方程式为______________;实验需要制取10.65克NaClO3,需要的氯气由电解食盐水生成,若不考虑反应过程中的损失,则同时生成的氢气的体积为____.(标准状况下)。
(3)萃取剂对金属离子的萃取率与pH的关系 ,如图所示。滤液II中加入萃取剂的作用是;使用萃取剂最适宜的pH是(填选项序号)。

A.接近2.0
B.接近3.0
C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.05×10-1。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=________
(5)为测定制得的无水草酸钴样品的纯度,现称取样品mg,先用适当试剂将其转化,得到纯净的草酸铵溶液,再用过量的稀硫酸酸化,用c mol/L高锰酸钾溶液去滴定,当溶液由时(填颜色变化),共用去高锰酸钾溶液V mL,计算草酸钴样品的纯度为。
(6)浓度均为0.l mol/L的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为
已知:H2SO3Ka1=1.54×10-2Ka2=1.02×10-7
H2CO3Ka1=4.3×10-7Ka2=5.6×10-11
【知识点】 水的电离及溶液的酸碱性
您最近一年使用:0次
填空题
|
适中(0.64)
11. 工业上制取硝酸铵的流程图如下,请回答下列问题。
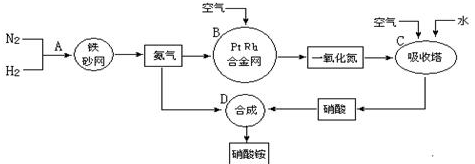
(1)合成氨的工业设备名称是_________ ,设备中设置热交换器的目的是________ ;此生产过程中,N2与H2合成NH3所用的催化剂是___________ ;生产中原料气必须进行脱硫,目的是_______________ 。
(2)吸收塔中反应为_____________ ,从生产流程看,吸收塔中需要补充空气,其原因是___________ 。
(3)生产硝酸的过程中常会发生一些氮的氧化物,可用如下三种方法处理:
方法一:碱吸收法:NO+NO2+2NaOH=2NaNO2+NaNO3+CO2
方法二:氨还原法:8NH3+6NO2 7N2+12H2O(该反应放热,NO也有类似的反应)
7N2+12H2O(该反应放热,NO也有类似的反应)
方法三:甲烷吸收法:CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g) △H=+867kJ/mol(NO也有类似反应)
上述三种方法中,方法一最大的缺点是______________ ;方法二和方法三相比,优点是__________ ,缺点是__________________ 。
(4)某化肥厂用NH3制备NH4NO3,已知:由NH3制NO的产率是94%,NO制HNO3的产率是89%,则制HNO3所用NH3的质量占总消耗NH3质量(不考虑其它损耗)的__________ %(保留三位有效数字)。

(1)合成氨的工业设备名称是
(2)吸收塔中反应为
(3)生产硝酸的过程中常会发生一些氮的氧化物,可用如下三种方法处理:
方法一:碱吸收法:NO+NO2+2NaOH=2NaNO2+NaNO3+CO2
方法二:氨还原法:8NH3+6NO2
 7N2+12H2O(该反应放热,NO也有类似的反应)
7N2+12H2O(该反应放热,NO也有类似的反应)方法三:甲烷吸收法:CH4(g)+2NO2(g)=CO2(g)+N2(g)+2H2O(g) △H=+867kJ/mol(NO也有类似反应)
上述三种方法中,方法一最大的缺点是
(4)某化肥厂用NH3制备NH4NO3,已知:由NH3制NO的产率是94%,NO制HNO3的产率是89%,则制HNO3所用NH3的质量占总消耗NH3质量(不考虑其它损耗)的
【知识点】 反应热
您最近一年使用:0次
2016-12-09更新
|
204次组卷
|
3卷引用:2016届湖北省宜昌市高三上学期1月调研考试理综化学试卷
四、解答题 添加题型下试题
解答题-结构与性质
|
适中(0.65)
解题方法
12. 前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2。
(1)六种元素中第一电离能最小的是_____________ (填元素符号,下同)
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。请写出黄血盐的化学式_____________ ,1molAB一中含有π键的数目为_________ (阿伏加德罗常数的值为NA),黄血盐晶体中各种微粒间的作用力不涉及____ (填序号)。
a .金属键. b.共价键 c.配位键 d.离子键 e.氢键 f.分子间的作用力
(3)E2+的价层电子排布图为______ ,很多不饱和有机物在E催化下可与H2发生加成反应:如① ②
② ③
③ ④
④ 其中碳原子采取sp2杂化的分子有
其中碳原子采取sp2杂化的分子有__ (填物质序号),HCHO分子的立体结构为____ ,它加成后产物甲醇的熔、沸点比CH4的熔、沸点高,其主要原因是 ___ 。
(4)金属C、F晶体的晶胞结构如图(请先判断对应的图),C、F两种晶体晶胞中金属原子的配位数之比为________ 。金属C的晶胞中,若设该晶胞的密度为ag/cm3,阿伏加德罗常数的值为NA,C原子的摩尔质量为M g/mol,则表示C原子半径的计算式为___ cm(不必化简)。

(1)六种元素中第一电离能最小的是
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。请写出黄血盐的化学式
a .金属键. b.共价键 c.配位键 d.离子键 e.氢键 f.分子间的作用力
(3)E2+的价层电子排布图为
 ②
② ③
③ ④
④ 其中碳原子采取sp2杂化的分子有
其中碳原子采取sp2杂化的分子有(4)金属C、F晶体的晶胞结构如图(请先判断对应的图),C、F两种晶体晶胞中金属原子的配位数之比为

【知识点】 核外电子排布的表示形式 电离能 杂化轨道理论 晶胞的有关计算解读
您最近一年使用:0次
解答题-有机推断题
|
较难(0.4)
名校
解题方法
13. 我国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖。青蒿素的一种化学合成方法的部分工艺流程如图所示:



已知:①C6H5-表示苯基;②
(1)化合物E中含有的含氧官能团有_____________ 、________________ 和羰基(写名称)。
(2)1 mol化合物B最多可与_____________ molH2发生加成反应。
(3)合成路线中设计E—→F、G-→H的目的是_________
(4)反应B→C,实际上可看作两步进行,依次发生的反应类型是_________ 、____________ 。
(5)A在Sn-p沸石作用下,可生成同分异构体异蒲勒醇,已知异蒲勒醇分子中有3个手性碳原子(连有四个不同基团的碳原子称为手性碳原子),异蒲勒醇分子内脱水后再与1分子H2发生1,4-加成可生成 则异蒲勒醇的结构简式为:
则异蒲勒醇的结构简式为:_________
(6)下图以乙烯为原料制备苄基乙醛 的合成路线流程图。
的合成路线流程图。

请填写下列空白(有机物写结构简式):
物质1为________ ;物质2为___________ ;试剂X为___________ .条件3为_____________ 。



已知:①C6H5-表示苯基;②

(1)化合物E中含有的含氧官能团有
(2)1 mol化合物B最多可与
(3)合成路线中设计E—→F、G-→H的目的是
(4)反应B→C,实际上可看作两步进行,依次发生的反应类型是
(5)A在Sn-p沸石作用下,可生成同分异构体异蒲勒醇,已知异蒲勒醇分子中有3个手性碳原子(连有四个不同基团的碳原子称为手性碳原子),异蒲勒醇分子内脱水后再与1分子H2发生1,4-加成可生成
 则异蒲勒醇的结构简式为:
则异蒲勒醇的结构简式为:(6)下图以乙烯为原料制备苄基乙醛
 的合成路线流程图。
的合成路线流程图。
请填写下列空白(有机物写结构简式):
物质1为
【知识点】 有机物的推断
您最近一年使用:0次
2016-12-09更新
|
398次组卷
|
2卷引用:2016届湖北省宜昌市高三上学期1月调研考试理综化学试卷
试卷分析
整体难度:适中
考查范围:认识化学科学、化学反应原理、物质结构与性质、有机化学基础、化学实验基础
试卷题型(共 13题)
题型
数量
单选题
7
解答题
3
填空题
3
试卷难度
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.94 | 氧化还原反应 | |
| 2 | 0.65 | 能量的相互转化 弱电解质的电离平衡 元素周期表结构 分子间作用力 氢键 | |
| 3 | 0.85 | 阿伏加德罗常数 | |
| 4 | 0.94 | 水的电离及溶液的酸碱性 | |
| 5 | 0.65 | 元素周期律、元素周期表的推断 根据原子结构进行元素种类推断 | |
| 6 | 0.64 | 有机物的结构特点 | |
| 7 | 0.85 | 化学实验基础 | |
| 二、解答题 | |||
| 8 | 0.85 | 化学实验探究 物质性质的探究 | 实验探究题 |
| 12 | 0.65 | 核外电子排布的表示形式 电离能 杂化轨道理论 晶胞的有关计算 | 结构与性质 |
| 13 | 0.4 | 有机物的推断 | 有机推断题 |
| 三、填空题 | |||
| 9 | 0.85 | 反应热 | |
| 10 | 0.64 | 水的电离及溶液的酸碱性 | |
| 11 | 0.64 | 反应热 | |



