氢气是一种清洁能源。在冶金、电力、材料等领域应用广泛。请回答下列问题:
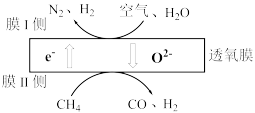
(1)某科研团队利用透氧膜获得N2、H2的工作原理如图所示(空气中N2和O2的物质的量之比为4:1)。上述过程中,膜I侧所得气体的物质的量之比为n(H2):n(N2)=3:1,则氧化作用的物质为_______________ ,膜Ⅱ侧发生的电极反应式为_________________
(2)用CO和H2合成甲醇的热化学方程式为CO(g)+2H2(g) ⇌CH3OH(g) △H1
已知CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g) △H2=-49.0kJ/mol
CO(g)+H2O(g) ⇌CO2(g)+H2(g) △H3=-41.1kJ/mol
则△H1=________________
(3)向体积可变的密闭容器中充入1molCO和2.2molH2,在恒温恒压条件下发生反应:CO(g)+2H2(g) ⇌CH3OH(g),平衡时,CO的转化率α(CO)随温度、压强的变化情况如图1所示。
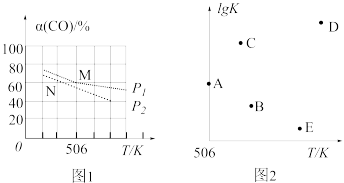
①压强p1_____ (填“>”、“<”或“=”)p2;M点时,该反应的平衡常数Kp=______ (用平衡分压表示,分压=总压×物质的量分数)
②不同温度下,该反应的平衡常数的对数值lgK如图2,其中A点为506K时平衡常数的对数值,则B、C、D、E四点中能正确表示该反应的lgK与温度(T)的关系的是_____________
(4)H2还原NO的反应为2NO(g)+2H2(g)⇌N2(g)+2H2O(l),实验测得反应速率的表达式为v=k·cm(NO)·cn(H2)(k是速率常数,只与温度有关)。
①某温度下,反应速率与反应物浓度的变化关系如下表所示。
由表中数据可知,m=_______ ,n=_______ 。
②上述反应分两步进行:ⅰ2NO(g)+2H2(g) ⇌N2(g)+H2O2(l)(慢反应)
ⅱH2O2(l)+H2(g) ⇌2H2O(l)(快反应)。下列说法正确的是_______
A. H2O2是该反应的催化剂 B. 总反应速率由反应ⅱ的速率决定
C. 反应ⅰ的活化能较高 D.反应ⅰ中NO和H2的碰撞仅部分有效
(1)某科研团队利用透氧膜获得N2、H2的工作原理如图所示(空气中N2和O2的物质的量之比为4:1)。上述过程中,膜I侧所得气体的物质的量之比为n(H2):n(N2)=3:1,则氧化作用的物质为

(2)用CO和H2合成甲醇的热化学方程式为CO(g)+2H2(g) ⇌CH3OH(g) △H1
已知CO2(g)+3H2(g) ⇌CH3OH(g)+H2O(g) △H2=-49.0kJ/mol
CO(g)+H2O(g) ⇌CO2(g)+H2(g) △H3=-41.1kJ/mol
则△H1=
(3)向体积可变的密闭容器中充入1molCO和2.2molH2,在恒温恒压条件下发生反应:CO(g)+2H2(g) ⇌CH3OH(g),平衡时,CO的转化率α(CO)随温度、压强的变化情况如图1所示。

①压强p1
②不同温度下,该反应的平衡常数的对数值lgK如图2,其中A点为506K时平衡常数的对数值,则B、C、D、E四点中能正确表示该反应的lgK与温度(T)的关系的是
(4)H2还原NO的反应为2NO(g)+2H2(g)⇌N2(g)+2H2O(l),实验测得反应速率的表达式为v=k·cm(NO)·cn(H2)(k是速率常数,只与温度有关)。
①某温度下,反应速率与反应物浓度的变化关系如下表所示。
| 编号 | c(H2)/(mol·L-1) | c(NO)/(mol·L-1) | v/(mol·L-1·min-1) |
| 1 | 0.10 | 0.10 | 0.414 |
| 2 | 0.10 | 0.20 | 1.656 |
| 3 | 0.50 | 0.10 | 2.070 |
由表中数据可知,m=
②上述反应分两步进行:ⅰ2NO(g)+2H2(g) ⇌N2(g)+H2O2(l)(慢反应)
ⅱH2O2(l)+H2(g) ⇌2H2O(l)(快反应)。下列说法正确的是
A. H2O2是该反应的催化剂 B. 总反应速率由反应ⅱ的速率决定
C. 反应ⅰ的活化能较高 D.反应ⅰ中NO和H2的碰撞仅部分有效
更新时间:2020-04-18 09:10:11
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】科学家积极探索新技术对CO2进行综合利用, CO2可用来合成低碳烃。
(1)已知:①4H2(g)+ 2O2(g)=4H2O(g) △H=-967.2kJ/mol。
②CH4(g)+ 2O2(g) =CO2(g) + 2H2O(g) ΔH=-802.0 kJ/mol。
则CO2(g) +4H2(g) CH4(g) + 2H2O(g) ΔH=
CH4(g) + 2H2O(g) ΔH=_______ kJ/mol
(2)在体积为1L的密闭刚性容器中,充入4mol H2和1mol CO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图1所示。
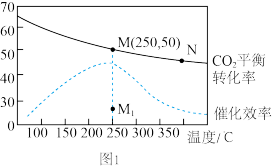
①已知M点总压为1MPa,该反应在此温度下的平衡常数Kp=_______ MPa-2.(Kp是用平衡分压代替平衡浓度表示的化学平衡常数,气体分压=气体总压×体积分数。)
②欲增加二氧化碳的平衡转化率,可采取的措施有_______ 。
A.通入惰性气体 B.提高温度 C.增加二氧化碳浓度 D.增加氢气浓度
③下列说法正确的是_______ 。
A.当压强或 不变时均可证明化学反应已达到平衡状态
不变时均可证明化学反应已达到平衡状态
B.其他条件不变,若不使用催化剂,则250℃ 时CO2的平衡转化率可能位于点M1
C.图1中M点时,甲烷的体积分数为12.5%
D.平衡常数大小:KN>KM
(3)新型高效的甲烷燃料电池工作时总反应式:CH4+2O2=CO2+2H2O。
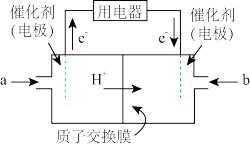
①该电池的负极是_______ (填a或b),
②负极电极反应式为_______ 。
(1)已知:①4H2(g)+ 2O2(g)=4H2O(g) △H=-967.2kJ/mol。
②CH4(g)+ 2O2(g) =CO2(g) + 2H2O(g) ΔH=-802.0 kJ/mol。
则CO2(g) +4H2(g)
 CH4(g) + 2H2O(g) ΔH=
CH4(g) + 2H2O(g) ΔH=(2)在体积为1L的密闭刚性容器中,充入4mol H2和1mol CO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图1所示。

①已知M点总压为1MPa,该反应在此温度下的平衡常数Kp=
②欲增加二氧化碳的平衡转化率,可采取的措施有
A.通入惰性气体 B.提高温度 C.增加二氧化碳浓度 D.增加氢气浓度
③下列说法正确的是
A.当压强或
 不变时均可证明化学反应已达到平衡状态
不变时均可证明化学反应已达到平衡状态B.其他条件不变,若不使用催化剂,则250℃ 时CO2的平衡转化率可能位于点M1
C.图1中M点时,甲烷的体积分数为12.5%
D.平衡常数大小:KN>KM
(3)新型高效的甲烷燃料电池工作时总反应式:CH4+2O2=CO2+2H2O。

①该电池的负极是
②负极电极反应式为
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
(1)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25℃时,相关物质的燃烧热数据如表:
则25℃时 和
和 (石墨,s)生成
(石墨,s)生成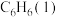 的热化学方程式为
的热化学方程式为_______ 。
(2)一氧化碳与氢气的反应历程如图,其中吸附在催化剂表面上的物种用*标注。
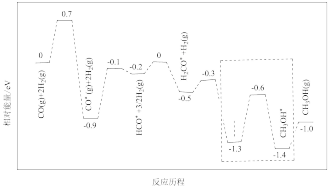
①该反应历程中控速步骤的能垒为_______ eV。
②写出虚线框内发生的化学反应方程式_______ 。
(3)105℃时,将足量的某碳酸氢盐(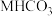 )固体置于真空恒容容器中,存在如下平衡:
)固体置于真空恒容容器中,存在如下平衡: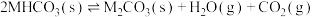 。上述反应达平衡时体系的总压为
。上述反应达平衡时体系的总压为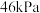 ,以分压表示的平衡常数
,以分压表示的平衡常数
_______  (注:分压=总压×物质的量分数);保持温度不变,开始时在体系中先通入一定量的
(注:分压=总压×物质的量分数);保持温度不变,开始时在体系中先通入一定量的 ,再加入足量
,再加入足量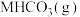 ,欲使平衡时体系中水蒸气的分压小于
,欲使平衡时体系中水蒸气的分压小于 ,
, 的初始压强应大于
的初始压强应大于_______  。
。
(4)我国科学家研究 电池,取得了重大科研成果,回答下列问题:
电池,取得了重大科研成果,回答下列问题:
 电池中,
电池中, 为单质锂片,则该电池中的
为单质锂片,则该电池中的 在
在_______ (填“正”或“负”)极发生电化学反应。研究表明,该电池总反应式为: ,且
,且 电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
Ⅰ. ;Ⅱ.
;Ⅱ.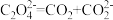 ;Ⅲ.
;Ⅲ._______ ;Ⅳ.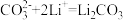
(1)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25℃时,相关物质的燃烧热数据如表:
| 物质 |  |  (石墨,s) (石墨,s) | 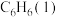 |
| 燃烧热△H(KJ/mol) | a | b | c |
 和
和 (石墨,s)生成
(石墨,s)生成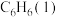 的热化学方程式为
的热化学方程式为(2)一氧化碳与氢气的反应历程如图,其中吸附在催化剂表面上的物种用*标注。

①该反应历程中控速步骤的能垒为
②写出虚线框内发生的化学反应方程式
(3)105℃时,将足量的某碳酸氢盐(
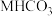 )固体置于真空恒容容器中,存在如下平衡:
)固体置于真空恒容容器中,存在如下平衡: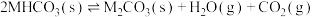 。上述反应达平衡时体系的总压为
。上述反应达平衡时体系的总压为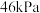 ,以分压表示的平衡常数
,以分压表示的平衡常数
 (注:分压=总压×物质的量分数);保持温度不变,开始时在体系中先通入一定量的
(注:分压=总压×物质的量分数);保持温度不变,开始时在体系中先通入一定量的 ,再加入足量
,再加入足量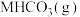 ,欲使平衡时体系中水蒸气的分压小于
,欲使平衡时体系中水蒸气的分压小于 ,
, 的初始压强应大于
的初始压强应大于 。
。(4)我国科学家研究
 电池,取得了重大科研成果,回答下列问题:
电池,取得了重大科研成果,回答下列问题: 电池中,
电池中, 为单质锂片,则该电池中的
为单质锂片,则该电池中的 在
在 ,且
,且 电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。Ⅰ.
 ;Ⅱ.
;Ⅱ.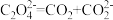 ;Ⅲ.
;Ⅲ.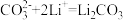
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】完成下列问题
(1)甲烷临氧耦合CO,重整反应有:
①2CH4(g)+O2(g) 2CO(g)+4H2(g)
2CO(g)+4H2(g)  =-71.4J·mol-1
=-71.4J·mol-1
②CH4(g)+CO2(g) 2CO+2H2(g)
2CO+2H2(g)  = +247.0kJ·mol-1
= +247.0kJ·mol-1
则CO的燃烧热△H=_______ 。
(2)在两个体积均为2L的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下进行反应:CH4(g)+CO2(g) 2CO+2H2(g),CO2的平衡转化率如表所示。
2CO+2H2(g),CO2的平衡转化率如表所示。
①下列条件能说明反应达到平衡状态的是_______ (填序号)。
A. v正(CH4) = 2v逆( CO)
B.容器内各物质的浓度满足16c( CH4)·c(CO2)=c2(CO)·c2(H2)
C.容器内混合气体的平均分子量不再变化
D.容器内混合气体密度不再变化
②达到平衡时,容器II内CO2的平衡转化率_______ 50% (填“>”“=”或“<”)。
(3)CO2也可通过催化加氢合成乙醇,其反应原理为2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g)
C2H5OH(g)+3H2O(g)  <0。设m为起始时的投料比,即m=
<0。设m为起始时的投料比,即m=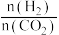 。通过实验得到图象:
。通过实验得到图象:
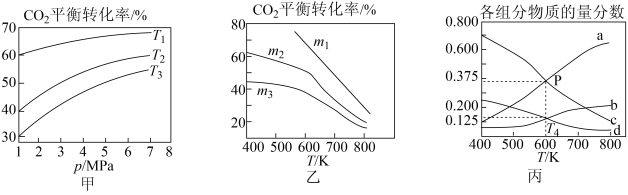
①图甲中投料比相同,温度从低到高的顺序为_______ 。
②图乙中m1、m2、m3从小到大的顺序为_______ 。
③图丙表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。T4温度时,该反应压强平衡常数Kp的计算式为_______ (用平衡分压代替平衡浓度计算,分压=总压x物质的量分数,代入数据,不用计算)。
(4)将标准状况下的CO2 4.48L通入0.3mo/L、1L NaOH溶液中恰好完全反应,所得溶液中的离子浓度大小关系为_______ 。
(1)甲烷临氧耦合CO,重整反应有:
①2CH4(g)+O2(g)
 2CO(g)+4H2(g)
2CO(g)+4H2(g)  =-71.4J·mol-1
=-71.4J·mol-1②CH4(g)+CO2(g)
 2CO+2H2(g)
2CO+2H2(g)  = +247.0kJ·mol-1
= +247.0kJ·mol-1则CO的燃烧热△H=
(2)在两个体积均为2L的恒容密闭容器中,起始时按表中相应的量加入物质,在相同温度下进行反应:CH4(g)+CO2(g)
 2CO+2H2(g),CO2的平衡转化率如表所示。
2CO+2H2(g),CO2的平衡转化率如表所示。| 容器 | 起始物质的量/mol | CO2的平衡转化率 | |||
| CH4 | CO2 | CO | H2 | ||
| Ⅰ | 4 | 4 | 0 | 0 | 50% |
| Ⅱ | 4 | 4 | 4 | 4 | |
A. v正(CH4) = 2v逆( CO)
B.容器内各物质的浓度满足16c( CH4)·c(CO2)=c2(CO)·c2(H2)
C.容器内混合气体的平均分子量不再变化
D.容器内混合气体密度不再变化
②达到平衡时,容器II内CO2的平衡转化率
(3)CO2也可通过催化加氢合成乙醇,其反应原理为2CO2(g)+6H2(g)
 C2H5OH(g)+3H2O(g)
C2H5OH(g)+3H2O(g)  <0。设m为起始时的投料比,即m=
<0。设m为起始时的投料比,即m=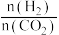 。通过实验得到图象:
。通过实验得到图象:
①图甲中投料比相同,温度从低到高的顺序为
②图乙中m1、m2、m3从小到大的顺序为
③图丙表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。T4温度时,该反应压强平衡常数Kp的计算式为
(4)将标准状况下的CO2 4.48L通入0.3mo/L、1L NaOH溶液中恰好完全反应,所得溶液中的离子浓度大小关系为
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】在食品行业中,N2O可用作发泡剂和密封剂。
(1)N2O是硝酸生产中氨催化氧化的副产物,NH3与O2在加热和催化剂的作用下生成N2O的化学方程式为___ 。
(2)N2O和NO是环境污染性气体。这两种气体会发生反应:N2O(g)+CO(g)=CO2(g)+N2(g),“Fe+”常用作该反应的催化剂。其总反应分两步进行:
第一步为Fe++N2O=FeO++N2;第二步为___ (写方程式),第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第二步反应的活化能___ (填“大于”“小于”或“等于”)第一步反应活化能。
(3)在四个恒容密闭容器中充入相应量的气体(图甲),发生反应2N2O(g)=2N2(g)+O2(g) △H,容器I、II、III中N2O的平衡转化率如图乙所示:

①该反应的△H___ (填“>”或“<”)0。
②容器Ⅳ与容器III的体积均为1L,容器Ⅳ中的物质在470℃下进行反应,起始反应速率:v正(N2O)___ v逆(N2O)(填“>”“<”或“=”)。
③已知容器I的体积为10L370℃时,该反应的平衡常数K=___ 。
(1)N2O是硝酸生产中氨催化氧化的副产物,NH3与O2在加热和催化剂的作用下生成N2O的化学方程式为
(2)N2O和NO是环境污染性气体。这两种气体会发生反应:N2O(g)+CO(g)=CO2(g)+N2(g),“Fe+”常用作该反应的催化剂。其总反应分两步进行:
第一步为Fe++N2O=FeO++N2;第二步为
(3)在四个恒容密闭容器中充入相应量的气体(图甲),发生反应2N2O(g)=2N2(g)+O2(g) △H,容器I、II、III中N2O的平衡转化率如图乙所示:

①该反应的△H
②容器Ⅳ与容器III的体积均为1L,容器Ⅳ中的物质在470℃下进行反应,起始反应速率:v正(N2O)
③已知容器I的体积为10L370℃时,该反应的平衡常数K=
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】合成氨工业为解决世界的粮食问题做出了重要贡献。工业合成氨的原理为:N2(g)+3H2(g) 2NH3(g) △H=-92kJ·mol-1
2NH3(g) △H=-92kJ·mol-1
(1)合成氨的反应过程与能量变化如图所示,未使用催化剂时,合成氨反应N2(g)+3H2(g) 2NH3(g)的正向反应的活化能为508kJ·mol-1,则该反应的逆向反应的活化能为
2NH3(g)的正向反应的活化能为508kJ·mol-1,则该反应的逆向反应的活化能为_______ kJ·mol-1。加入催化剂后,合成氨反应的速率由_______ 决定(填“第一步反应”或者“第二步反应”)。

(2)在一定温度下的恒容密闭容器中进行可逆反应:N2(g)+3H2(g) 2NH3(g),该反应达到平衡的标志
2NH3(g),该反应达到平衡的标志_______ 。(填标号)
A.v(H2)正=3v(N2)逆
B.容器内的气体总质量不再随时间而变化
C.气体的平均相对分子质量不再变化
D.混合气体的密度不再随时间变化
E.1molN≡N键断裂的同时,有6molN-H键生成
(3)向不同温度下的恒容容器中,均加入1molN2和3molH2组成的混合气体,经过相同时间测得NH3的体积分数φ(NH3)与温度关系如图所示。
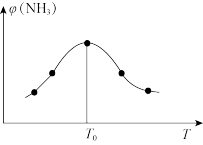
①随着温度升高,NH3的体积分数φ(NH3)先增大后减小的原因是_______ 。
②T0时,初始气体总压强为40MPa,10min时反应达到平衡状态,气体压强减小了2MPa,则从反应开始到10min时,以N2表示的平均反应速率=_______ (MPa·min-1),H2的转化率为_______ ,T0时平衡常数Kp=_______ MPa-2(列出计算式即可)(Kp为以分压表示的平衡常数)。
 2NH3(g) △H=-92kJ·mol-1
2NH3(g) △H=-92kJ·mol-1(1)合成氨的反应过程与能量变化如图所示,未使用催化剂时,合成氨反应N2(g)+3H2(g)
 2NH3(g)的正向反应的活化能为508kJ·mol-1,则该反应的逆向反应的活化能为
2NH3(g)的正向反应的活化能为508kJ·mol-1,则该反应的逆向反应的活化能为
(2)在一定温度下的恒容密闭容器中进行可逆反应:N2(g)+3H2(g)
 2NH3(g),该反应达到平衡的标志
2NH3(g),该反应达到平衡的标志A.v(H2)正=3v(N2)逆
B.容器内的气体总质量不再随时间而变化
C.气体的平均相对分子质量不再变化
D.混合气体的密度不再随时间变化
E.1molN≡N键断裂的同时,有6molN-H键生成
(3)向不同温度下的恒容容器中,均加入1molN2和3molH2组成的混合气体,经过相同时间测得NH3的体积分数φ(NH3)与温度关系如图所示。

①随着温度升高,NH3的体积分数φ(NH3)先增大后减小的原因是
②T0时,初始气体总压强为40MPa,10min时反应达到平衡状态,气体压强减小了2MPa,则从反应开始到10min时,以N2表示的平均反应速率=
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】低碳经济是指在可持续发展理念指导下,尽可能地减少煤炭、石油等高碳能源消耗,减少温室气体排放,达到经济社会发展与生态环境保护双赢的一种经济发展形态。下列是有关碳元素的相关转化,回答下列问题:
(1)已知甲醇是一种清洁燃料,制备甲醇是煤液化的重要方向。若已知H2(g)、CO(g)、CH3OH(l)的燃烧热分别为∆H=-285.8kJ/mol、△H=-283.0kJ/mol、△H=-726.5kJ/mol,CO(g)+2H2(g) CH3OH(l)△H=
CH3OH(l)△H=________ kJ/mol。
(2)一定温度下,一定可以提高甲醇合成速率的措施有( )
a.增大起始通入 值
值
b.恒温恒容,再通入氦气
c.使用新型的高效正催化剂
d.将产生的甲醇及时移走
e.压缩体积,增大压强
(3)在恒温恒容条件下,下列说法可以判定反应CO(g)+2H2(g) CH3OH(g)已经达到平衡状态的是
CH3OH(g)已经达到平衡状态的是( )
a.体系中碳氢单键数目不再改变
b.体系中n(CO):n(H2)不再改变
c.体系中压强或者平均摩尔质量不再改变
d.单位时间内消耗氢气和CH3OH的物质的量相等
(4)在恒压的容器中,曲线X、Y、Z分别表示在T1°C、T2°C和T3°C三种温度下合成甲醇气体的过程。控制不同的原料投料比,CO的平衡转化率如图所示:
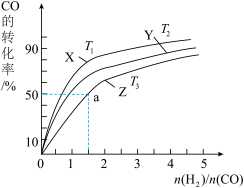
①温度T1°C、T2°C和T3°C由高到低的顺序为:_________________ ;
②若温度为T3°C时,体系压强保持50aMPa,起始反应物投料比n(H2)/n(CO)=1.5,则平衡时CO和CH3OH的分压之比为__________ ,该反应的压强平衡常数Kp的计算式为__________ 。(Kp生成物分压幂的乘积与反应物分压幂的乘积的比值,某物质的分压等于总压强×该物质的物质的量分数)。
(1)已知甲醇是一种清洁燃料,制备甲醇是煤液化的重要方向。若已知H2(g)、CO(g)、CH3OH(l)的燃烧热分别为∆H=-285.8kJ/mol、△H=-283.0kJ/mol、△H=-726.5kJ/mol,CO(g)+2H2(g)
 CH3OH(l)△H=
CH3OH(l)△H=(2)一定温度下,一定可以提高甲醇合成速率的措施有
a.增大起始通入
 值
值b.恒温恒容,再通入氦气
c.使用新型的高效正催化剂
d.将产生的甲醇及时移走
e.压缩体积,增大压强
(3)在恒温恒容条件下,下列说法可以判定反应CO(g)+2H2(g)
 CH3OH(g)已经达到平衡状态的是
CH3OH(g)已经达到平衡状态的是a.体系中碳氢单键数目不再改变
b.体系中n(CO):n(H2)不再改变
c.体系中压强或者平均摩尔质量不再改变
d.单位时间内消耗氢气和CH3OH的物质的量相等
(4)在恒压的容器中,曲线X、Y、Z分别表示在T1°C、T2°C和T3°C三种温度下合成甲醇气体的过程。控制不同的原料投料比,CO的平衡转化率如图所示:

①温度T1°C、T2°C和T3°C由高到低的顺序为:
②若温度为T3°C时,体系压强保持50aMPa,起始反应物投料比n(H2)/n(CO)=1.5,则平衡时CO和CH3OH的分压之比为
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】现代工业的发展导致CO2的大量排放,对环境造成的影响日益严重,通过各国科技工作者的努力,已经开发出许多将CO2回收利用的技术,其中催化转化法最具应用价值。回答下列问题:
(1)在催化转化法回收利用CO2的过程中,可能涉及以下化学反应:
①CO2(g)+2H2O(l) CH3OH(l)+
CH3OH(l)+ O2(g) ΔH=+727kJ·mol-1 ΔG=+818kJ·mol-1
O2(g) ΔH=+727kJ·mol-1 ΔG=+818kJ·mol-1
②CO2(g)+3H2O(l) CH4(g)+O2(g) ΔH=+890kJ·mol-1 ΔG=+818kJ·mol-1
CH4(g)+O2(g) ΔH=+890kJ·mol-1 ΔG=+818kJ·mol-1
③CO2(g)+3H2(g) CH3OH(l)+H2O(l) ΔH=-131kJ·mol-1 ΔG=-9.35kJ·mol-1
CH3OH(l)+H2O(l) ΔH=-131kJ·mol-1 ΔG=-9.35kJ·mol-1
④CO2(g)+4H2(g) CH4(g)+2H2O(l) ΔH=-253kJ·mol-1 ΔG=-130kJ·mol-1
CH4(g)+2H2O(l) ΔH=-253kJ·mol-1 ΔG=-130kJ·mol-1
从化学平衡的角度来看,上述化学反应中反应进行程度最小的是__ ,反应进行程度最大的是__ 。
(2)反应CO2+4H2 CH4+2H2O称为Sabatier反应,可用于载人航空航天工业。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。
CH4+2H2O称为Sabatier反应,可用于载人航空航天工业。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。
①在载人航天器中利用Sabatier反应实现回收CO2,再生O2,其反应过程如图所示,这种方法再生O2的最大缺点是需要不断补充__ (填化学式)。

②在1.5MPa,气体流速为20mL·min-1时研究温度对催化剂催化性能的影响,得到CO2的转化率(%)如下:
分析上表数据可知:__ (填化学式)的催化性能更好。
③调整气体流速,研究其对某催化剂催化效率的影响,得到CO2的转化率(%)如下:
分析上表数据可知:相同温度时,随着气体流速增加,CO2的转化率__ (填“增大”或“减小”),其可能的原因是__ 。
④在上述实验条件中,Sabatier反应最可能达到化学平衡状态的温度是__ ,在1L恒容密闭容器中发生该反应,已知初始反应气体中V(H2):V(CO2)=4:1,估算该温度下的平衡常数为__ (列出计算表达式)。
(3)通过改变催化剂可以改变CO2与H2反应催化转化的产物,如利用Co/C作为催化剂,反应后可以得到含有少量甲酸的甲醇。为了研究催化剂的稳定性,将Co/C催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇的产量如图所示,试推测甲醇产量变化的原因__ 。(已知Co的性质与Fe相似)

(1)在催化转化法回收利用CO2的过程中,可能涉及以下化学反应:
①CO2(g)+2H2O(l)
 CH3OH(l)+
CH3OH(l)+ O2(g) ΔH=+727kJ·mol-1 ΔG=+818kJ·mol-1
O2(g) ΔH=+727kJ·mol-1 ΔG=+818kJ·mol-1②CO2(g)+3H2O(l)
 CH4(g)+O2(g) ΔH=+890kJ·mol-1 ΔG=+818kJ·mol-1
CH4(g)+O2(g) ΔH=+890kJ·mol-1 ΔG=+818kJ·mol-1③CO2(g)+3H2(g)
 CH3OH(l)+H2O(l) ΔH=-131kJ·mol-1 ΔG=-9.35kJ·mol-1
CH3OH(l)+H2O(l) ΔH=-131kJ·mol-1 ΔG=-9.35kJ·mol-1④CO2(g)+4H2(g)
 CH4(g)+2H2O(l) ΔH=-253kJ·mol-1 ΔG=-130kJ·mol-1
CH4(g)+2H2O(l) ΔH=-253kJ·mol-1 ΔG=-130kJ·mol-1从化学平衡的角度来看,上述化学反应中反应进行程度最小的是
(2)反应CO2+4H2
 CH4+2H2O称为Sabatier反应,可用于载人航空航天工业。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。
CH4+2H2O称为Sabatier反应,可用于载人航空航天工业。我国化学工作者对该反应的催化剂及催化效率进行了深入的研究。①在载人航天器中利用Sabatier反应实现回收CO2,再生O2,其反应过程如图所示,这种方法再生O2的最大缺点是需要不断补充

②在1.5MPa,气体流速为20mL·min-1时研究温度对催化剂催化性能的影响,得到CO2的转化率(%)如下:
| 催化剂 | 180℃ | 200℃ | 220℃ | 280℃ | 300℃ | 320℃ | 340℃ | 360℃ |
| Co4N/Al2O3 | 8.0 | 20.3 | 37.3 | 74.8 | 84.4 | 85.3 | 86.8 | 90.1 |
| Co/Al2O3 | 0.2 | 0.7 | 2.0 | 22.4 | 37.6 | 48.8 | 54.9 | 59.8 |
分析上表数据可知:
③调整气体流速,研究其对某催化剂催化效率的影响,得到CO2的转化率(%)如下:
| 气体流速/mL·min-1 | 180℃ | 200℃ | 220℃ | 280℃ | 300℃ | 320℃ | 340℃ | 360℃ |
| 10 | 11.0 | 25.1 | 49.5 | 90.2 | 93.6 | 97.2 | 98.0 | 98.0 |
| 30 | 4.9 | 11.2 | 28.9 | 68.7 | 72.7 | 79.8 | 82.1 | 84.2 |
| 40 | 0.2 | 5.2 | 15.3 | 61.2 | 66.2 | 71.2 | 76.6 | 79.0 |
| 50 | 0.2 | 5.0 | 10.0 | 50.0 | 59.5 | 61.2 | 64.1 | 69.1 |
分析上表数据可知:相同温度时,随着气体流速增加,CO2的转化率
④在上述实验条件中,Sabatier反应最可能达到化学平衡状态的温度是
(3)通过改变催化剂可以改变CO2与H2反应催化转化的产物,如利用Co/C作为催化剂,反应后可以得到含有少量甲酸的甲醇。为了研究催化剂的稳定性,将Co/C催化剂循环使用,相同条件下,随着循环使用次数的增加,甲醇的产量如图所示,试推测甲醇产量变化的原因

您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】甲醇是重要的有机化工原料,目前世界甲醇年产量超过2.1×107吨,在能源紧张的今天,甲醇的需求也在增大。甲醇的合成方法是:
(i)CO(g)+2H2(g) CH3OH(g) ∆H=-90.1 kJ·mol-1
CH3OH(g) ∆H=-90.1 kJ·mol-1
(ii)2CO(g)+O2(g)=2CO2(g) ∆H=-566.0 kJ·mol-1
(iii)2H2(g)+O2(g)=2H2O(l) ∆H=-572.0 kJ·mol-1
若混合气体中有二氧化碳存在时,还发生下列反应:
(iv)CO2(g)+H2(g) CO(g)+H2O(g) ∆H=+41.1 kJ·mol-1
CO(g)+H2O(g) ∆H=+41.1 kJ·mol-1
回答下列问题:
(1)CH3OH(g)+ O2(g)=CO2(g)+2H2O(l) ∆H=
O2(g)=CO2(g)+2H2O(l) ∆H=_____ kJ·mol-1。
(2)在恒温恒容的密闭容器中发生反应(i),各物质的浓度如表:
①x=_______ 。
②前2min内H2的平均反应速率v(H2)=______ 。该温度下,反应(i)的平衡常数K=_____ (保留2位有效数字)。
③反应进行到第2min时,改变了反应条件,改变的这个条件可能是______ (填字母)。
a.使用催化剂 b.降低温度 c.增加H2的浓度
(3)图中是温度、压强与反应(i)中CO转化率的关系。
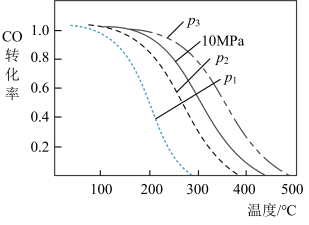
p1、p2、p3的大小关系为________ 。
②实际生产往往采用300~400℃和10 MPa的条件,其原因是_______ 。
(i)CO(g)+2H2(g)
 CH3OH(g) ∆H=-90.1 kJ·mol-1
CH3OH(g) ∆H=-90.1 kJ·mol-1(ii)2CO(g)+O2(g)=2CO2(g) ∆H=-566.0 kJ·mol-1
(iii)2H2(g)+O2(g)=2H2O(l) ∆H=-572.0 kJ·mol-1
若混合气体中有二氧化碳存在时,还发生下列反应:
(iv)CO2(g)+H2(g)
 CO(g)+H2O(g) ∆H=+41.1 kJ·mol-1
CO(g)+H2O(g) ∆H=+41.1 kJ·mol-1回答下列问题:
(1)CH3OH(g)+
 O2(g)=CO2(g)+2H2O(l) ∆H=
O2(g)=CO2(g)+2H2O(l) ∆H=(2)在恒温恒容的密闭容器中发生反应(i),各物质的浓度如表:
 | c(CO) | c(H2) | c(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | x | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
①x=
②前2min内H2的平均反应速率v(H2)=
③反应进行到第2min时,改变了反应条件,改变的这个条件可能是
a.使用催化剂 b.降低温度 c.增加H2的浓度
(3)图中是温度、压强与反应(i)中CO转化率的关系。

p1、p2、p3的大小关系为
②实际生产往往采用300~400℃和10 MPa的条件,其原因是
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】兰尼镍是一种带有多孔结构的细小晶粒组成的镍铝合金,被广泛用作有机物的氢化反应的催化剂。以红土镍矿(主要成分为NiS、FeS和SiO2等)为原料制备兰尼镍的工艺流程如下图所示:
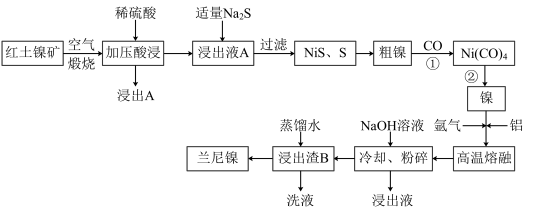
(1)煅烧时主要生成的气体产物是___________ ,浸出渣A的主要成分是____________ 。
(2)向浸出液A中加入适量Na2S,发生氧化还原的离子方程式为________________________ 。若Na2S过量时,则过滤出的固体中会混有__________ ;
(3)已知Ni(CO)4的沸点是42.2℃,Ni(S)+CO(g)⇌ Ni(CO)4(g)的平衡常数与温度的关系如下:
步骤①、步骤②的最佳温度分别是_______ 、_______ (填选项代号)
A. 25℃ B. 30℃ C. 50℃ D. 80℃ E. 230℃
(4)加氢氧化钠的目的是溶解部分铝,形成多孔结构的镍铝合金,已知红土镍矿中NiS质量分数45.5%,取1kg红土镍矿进行制备(不考虑制备过程中镍的损耗),熔融时加入270g铝,浸出时消耗800mL 5mol/LNaOH,理论上生成的兰尼镍的化学式为__________ 。

(1)煅烧时主要生成的气体产物是
(2)向浸出液A中加入适量Na2S,发生氧化还原的离子方程式为
(3)已知Ni(CO)4的沸点是42.2℃,Ni(S)+CO(g)⇌ Ni(CO)4(g)的平衡常数与温度的关系如下:
| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
A. 25℃ B. 30℃ C. 50℃ D. 80℃ E. 230℃
(4)加氢氧化钠的目的是溶解部分铝,形成多孔结构的镍铝合金,已知红土镍矿中NiS质量分数45.5%,取1kg红土镍矿进行制备(不考虑制备过程中镍的损耗),熔融时加入270g铝,浸出时消耗800mL 5mol/LNaOH,理论上生成的兰尼镍的化学式为
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】工业制硝酸的主要反应为 4NH3(g)+5O2(g)⇌4NO(g)+6H2O(l)△H
(1)已知:氢气的燃烧热为285.8 kJ•mol-1
N2(g)+3H2(g)⇌2NH3(g)△H=-92.4 kJ•mol-1
N2(g)+O2(g)⇌2NO(g)△H=+180.6 kJ•mol-1
则上述工业制硝酸的主要反应的△H=______ 。
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
①反应在第2 min到第4 min内,O2的平均反应速率为______ 。
②反应在第6 min时改变了条件,改变的条件可能是______ (填序号)。
A 使用催化剂 B 升高温度 C 减小压强 D 增加O2的浓度
③下列说法中能说明4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)达到平衡状态的是______ (填序号)。
A 单位时间内生成n mol NO的同时,生成n mol NH3
B 条件一定,混合气体的平均相对分子质量不再变化
C 百分含量w(NH3)=w(NO)
D 反应速率v(NH3)∶v(O2) ∶v(NO) ∶v(H2O)=4∶5∶4∶6
E 若在恒温恒压下容积可变的容器中反应,混合气体的密度不再变化
(3)某研究所组装的CH3OH-O2燃料电池的工作原理如图所示。
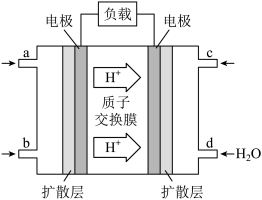
①该电池工作时,b口通入的物质为______ 。
②该电池正极的电极反应式为______ 。
(1)已知:氢气的燃烧热为285.8 kJ•mol-1
N2(g)+3H2(g)⇌2NH3(g)△H=-92.4 kJ•mol-1
N2(g)+O2(g)⇌2NO(g)△H=+180.6 kJ•mol-1
则上述工业制硝酸的主要反应的△H=
(2)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
| 浓度 | c(NH3)(mol•L-1) | c(O2)(mol•L-1) | c(NO)(mol•L-1) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2 min | 0.6 | a | 0.2 |
| 第4 min | 0.3 | 0.975 | 0.5 |
| 第6 min | 0.3 | 0.975 | 0.5 |
| 第8 min | 0.7 | 1.475 | 0.1 |
①反应在第2 min到第4 min内,O2的平均反应速率为
②反应在第6 min时改变了条件,改变的条件可能是
A 使用催化剂 B 升高温度 C 减小压强 D 增加O2的浓度
③下列说法中能说明4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)达到平衡状态的是
A 单位时间内生成n mol NO的同时,生成n mol NH3
B 条件一定,混合气体的平均相对分子质量不再变化
C 百分含量w(NH3)=w(NO)
D 反应速率v(NH3)∶v(O2) ∶v(NO) ∶v(H2O)=4∶5∶4∶6
E 若在恒温恒压下容积可变的容器中反应,混合气体的密度不再变化
(3)某研究所组装的CH3OH-O2燃料电池的工作原理如图所示。

①该电池工作时,b口通入的物质为
②该电池正极的电极反应式为
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】依据相关知识回答下列问题:
Ⅰ.键能是指在25 ℃、101 kPa,将1 mol理想气体分子AB拆开为中性气态原子A和B时所需要的能量。显然键能越大,化学键越牢固,含有该键的分子越稳定。
(1)已知键能:H-H键为436 kJ•mol-1;H-F键为565 kJ•mol-1;H-Cl键为431 kJ•mol-1;H-Br键为366 kJ•mol-1。则下列分子受热时最稳定的是_______。
(2)能用键能大小解释的是_______。
(3)已知:H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,生成lmol NH3过程中放出46kJ的热量。则N≡N的键能为_______ kJ/mol。
Ⅱ.CO与H2反应可制备CH3OH,由CH3OH和O2构成的质子交换膜燃料电池的结构示意图如下。
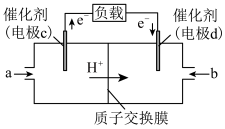
(4)电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是_______ (填“正极”或“负极”),c电极的电极反应式为_______ 。若外电路中转移2 mol电子,则上述燃料电池所消耗的O2在标准状况下的体积为_______ L。
(5)下列反应中,属于吸热反应的是_______ (填序号)
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳 ⑤食物因氧化而腐败 ⑥Ba(OH)2•8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应
Ⅰ.键能是指在25 ℃、101 kPa,将1 mol理想气体分子AB拆开为中性气态原子A和B时所需要的能量。显然键能越大,化学键越牢固,含有该键的分子越稳定。
(1)已知键能:H-H键为436 kJ•mol-1;H-F键为565 kJ•mol-1;H-Cl键为431 kJ•mol-1;H-Br键为366 kJ•mol-1。则下列分子受热时最稳定的是_______。
| A.HF | B.HCl | C.HBr | D.H2 |
| A.氮气的化学性质比氧气稳定 | B.常温常压下溴呈液态,碘呈固态 |
| C.稀有气体一般很难发生化学反应 | D.硝酸易挥发而硫酸难挥发 |
Ⅱ.CO与H2反应可制备CH3OH,由CH3OH和O2构成的质子交换膜燃料电池的结构示意图如下。

(4)电池总反应为2CH3OH+3O2=2CO2+4H2O,则c电极是
(5)下列反应中,属于吸热反应的是
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳 ⑤食物因氧化而腐败 ⑥Ba(OH)2•8H2O与NH4Cl反应 ⑦铁粉与稀盐酸反应
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】甲烷是重要的能源和化工原料,可用于合成氨原料气的制备。一定温度下,在体积为2L的密闭容器中,充入2.0molCH4(g)和4.0molH2O(g),发生反应:CH4(g)+H2O(g) 3H2(g)+CO(g),测得CH4(g)的物质的量随时间变化如表所示:
3H2(g)+CO(g),测得CH4(g)的物质的量随时间变化如表所示:
(1)2~4min内,用H2表示的化学反应速率v(H2)=______ 。
(2)4min时,CH4的消耗速率______ CH4的生成速率(填“大于”、“小于”或“等于”)。
(3)反应达到平衡时,混合气体中H2O(g)的体积分数为______ %。
(4)CH4是一种清洁能源,可作燃料电池。某甲烷燃料电池以稀硫酸为电解质溶液,其正极的电极反应式为______ ;电路每转移4mol电子时,消耗CH4的体积(标准状况下)为______ L。
 3H2(g)+CO(g),测得CH4(g)的物质的量随时间变化如表所示:
3H2(g)+CO(g),测得CH4(g)的物质的量随时间变化如表所示:| 时间/min | 0 | 2 | 4 | 6 | 8 |
| n(CH4)/mol | 2.0 | 1.2 | 0.8 | 1.0 | 1.0 |
(2)4min时,CH4的消耗速率
(3)反应达到平衡时,混合气体中H2O(g)的体积分数为
(4)CH4是一种清洁能源,可作燃料电池。某甲烷燃料电池以稀硫酸为电解质溶液,其正极的电极反应式为
您最近半年使用:0次



