铜冶金术以火法治为主,炼铜的副产品SO2多用于制硫酸和石背等化学产品。火法炼铜的工艺流程如下:

反应I:2Cu2S(s)+3O2(g)→2Cu2O(s)+2SO2(g)+768.2kJ
反应II:2Cu2O(s)+Cu2S(s)→6Cu(s)+SO2(g)-116.0kJ
(1)在反应Ⅱ中,每生成1mol SO2转移电子_______ mol,反应Cu2S(s)+O2(g)→2Cu(s)+SO2(g)+Q的Q=_____ kJ。
(2)理论上m1:m2=_________ 。

反应I:2Cu2S(s)+3O2(g)→2Cu2O(s)+2SO2(g)+768.2kJ
反应II:2Cu2O(s)+Cu2S(s)→6Cu(s)+SO2(g)-116.0kJ
(1)在反应Ⅱ中,每生成1mol SO2转移电子
(2)理论上m1:m2=
更新时间:2020-05-17 16:48:30
|
相似题推荐
填空题
|
较易
(0.85)
名校
解题方法
【推荐1】化学与生产、生活、环境息息相关。从化学视角回答下列问题:
(1)精美的雕花玻璃使我们的世界变得绚丽多彩,雕花玻璃涉及的主要反应的化学方程式为_______ 。
(2)NO2是造成酸雨的污染物之一,实验室可将NO2与O2同时通入水中,使NO2完全被吸收,写出NO2完全被吸收的化学方程式_______ 。
(3)二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂,工业上是用氯酸钠(NaClO3)与盐酸反应生成ClO2气体的,反应过程中同时会生成氯气。
_______NaClO3+_______HCl(浓)=_______Cl2 ↑ +_______ClO2↑+ _______NaCl+_______
①配平上述化学方程式,并在方程式上面用“双线桥”标明电子转移的方向和数目______ 。
②该反应中HCl表现的性质是_______ ;氧化剂与还原剂的物质的量之比为_______ ;反应中生成标准状况下的Cl2 5.6L时,转移电子的数目为_______ 。
(1)精美的雕花玻璃使我们的世界变得绚丽多彩,雕花玻璃涉及的主要反应的化学方程式为
(2)NO2是造成酸雨的污染物之一,实验室可将NO2与O2同时通入水中,使NO2完全被吸收,写出NO2完全被吸收的化学方程式
(3)二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂,工业上是用氯酸钠(NaClO3)与盐酸反应生成ClO2气体的,反应过程中同时会生成氯气。
_______NaClO3+_______HCl(浓)=_______Cl2 ↑ +_______ClO2↑+ _______NaCl+_______
①配平上述化学方程式,并在方程式上面用“双线桥”标明电子转移的方向和数目
②该反应中HCl表现的性质是
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】(1)从海水中可提取多种化工原料,下图是工业上对海水资源进行综合利用的流程图。试回答下列问题:
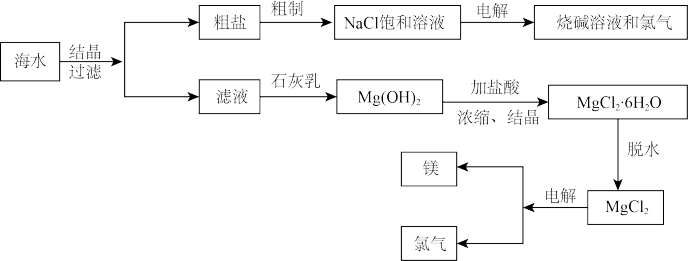
①若粗盐中含有杂质Ca2+、Mg2+、SO ,精制时所用试剂为A.盐酸 B.BaCl2溶液 C.NaOH溶液 D.Na2CO3溶液。则加入试剂的顺序是
,精制时所用试剂为A.盐酸 B.BaCl2溶液 C.NaOH溶液 D.Na2CO3溶液。则加入试剂的顺序是________ (填序号)。
②写出电解NaCl饱和溶液制备NaOH和Cl2的化学方程式:_________________ 。
③电解熔融MgCl2可制取镁和Cl2,方程式为_______________________________ 。其中Cl2和Ca(OH)2反应可制得漂白粉。制漂白粉的化学方程式为__________ 。
(2)NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。在催化剂作用下,NH3可与NO2发生如下反应:8NH3+6NO2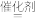 7N2+12H2O
7N2+12H2O
①该反应的氧化剂是_______ 。
②用双线桥表示该反应中电子转移的方向和数目_______________
③标准状况下生成15.68LN2,转移电子为_________ mol

①若粗盐中含有杂质Ca2+、Mg2+、SO
 ,精制时所用试剂为A.盐酸 B.BaCl2溶液 C.NaOH溶液 D.Na2CO3溶液。则加入试剂的顺序是
,精制时所用试剂为A.盐酸 B.BaCl2溶液 C.NaOH溶液 D.Na2CO3溶液。则加入试剂的顺序是②写出电解NaCl饱和溶液制备NaOH和Cl2的化学方程式:
③电解熔融MgCl2可制取镁和Cl2,方程式为
(2)NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。在催化剂作用下,NH3可与NO2发生如下反应:8NH3+6NO2
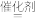 7N2+12H2O
7N2+12H2O①该反应的氧化剂是
②用双线桥表示该反应中电子转移的方向和数目
③标准状况下生成15.68LN2,转移电子为
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐1】研究CO2的再利用有利于低碳减排的同时获得新的能源物质。如一定条件下,CO2加氢可制得甲醇: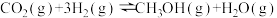
 。回答下列问题:
。回答下列问题:
(1)我国科研人员研究的该反应历程如图,吸附在催化剂表面上的物种用“*”表示,“TS”表示过渡态,括号里的数字表示微粒的相对总能量(单位为eV)。
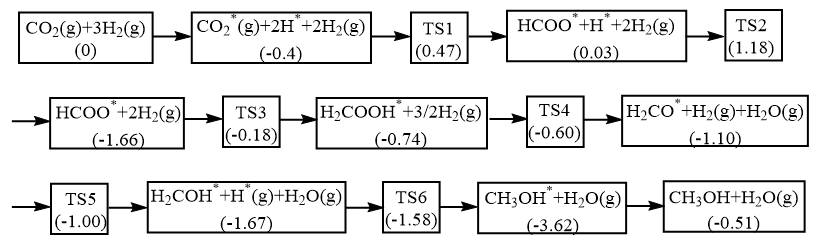
该反应
___________ 0(填“>”或“<”);该历程中总反应的决速步方程式为___________ 。
(2)T℃时,在一容积为2L的恒容密闭容器中充入2mol CO2和6molH2,测得不同时刻容器中的压强关系如下表所示:
①用H2表示该反应0~5min内的平均反应速率为___________ 。
②CO2的平衡转化率为___________ ;T℃时,该反应的平衡常数为___________ (保留一位小数)。
③其它条件不变,下列措施能同时增大反应速率和H2平衡转化率的是___________ (填标号)。
a.升高温度 b.按原比例再充入一定量CO2和H2
c.将 和
和 液化移出 d.缩小容器体积
液化移出 d.缩小容器体积
 。回答下列问题:
。回答下列问题:(1)我国科研人员研究的该反应历程如图,吸附在催化剂表面上的物种用“*”表示,“TS”表示过渡态,括号里的数字表示微粒的相对总能量(单位为eV)。

该反应

(2)T℃时,在一容积为2L的恒容密闭容器中充入2mol CO2和6molH2,测得不同时刻容器中的压强关系如下表所示:
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
 | 0.80 | 0.72 | 0.66 | 0.62 | 0.60 | 0.60 |
①用H2表示该反应0~5min内的平均反应速率为
②CO2的平衡转化率为
③其它条件不变,下列措施能同时增大反应速率和H2平衡转化率的是
a.升高温度 b.按原比例再充入一定量CO2和H2
c.将
 和
和 液化移出 d.缩小容器体积
液化移出 d.缩小容器体积
您最近一年使用:0次
【推荐2】碳和硫的化合物在生产生活中的应用非常广泛。
⑴用生物质热解气(主要成分为CO、CH4、H2)将SO2在高温下还原成单质硫。涉及的部分反应如下:
2CO(g) + SO2 (g) = S(g) + 2CO2(g) ΔH1 = +8.0kJ/mol
2CO(g) + O2 (g) = 2CO2(g) ΔH2 = -566.0kJ/mol
2H2 (g) + O2 (g) = 2H2O (g) ΔH3 = -483.6kJ/mol
则2H2 (g) + SO2 (g) = S(g) + 2 H2O (g) ΔH4 =________
⑵欲用1L Na2CO3溶液将6.99gBaSO4固体全部转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为________ 。(忽略溶液体积的变化)[已知:常温下Ksp(BaSO4)=1×10-11, Ksp(BaCO3)=1×10-10]
(3)在25 ℃时,将a mol/L的氨水溶液与0.02mol/L的HCl溶液等体积混合后溶液呈中性,则氨水的电离平衡常数Kb =________ 。
⑴用生物质热解气(主要成分为CO、CH4、H2)将SO2在高温下还原成单质硫。涉及的部分反应如下:
2CO(g) + SO2 (g) = S(g) + 2CO2(g) ΔH1 = +8.0kJ/mol
2CO(g) + O2 (g) = 2CO2(g) ΔH2 = -566.0kJ/mol
2H2 (g) + O2 (g) = 2H2O (g) ΔH3 = -483.6kJ/mol
则2H2 (g) + SO2 (g) = S(g) + 2 H2O (g) ΔH4 =
⑵欲用1L Na2CO3溶液将6.99gBaSO4固体全部转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为
(3)在25 ℃时,将a mol/L的氨水溶液与0.02mol/L的HCl溶液等体积混合后溶液呈中性,则氨水的电离平衡常数Kb =
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐3】在400℃、101 kPa时,NO2(g) +CO(g)=NO(g) + CO2(g) 反应过程的能量变化如下图所示。
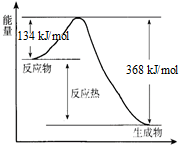
反应过程
(1)该反应是_____________ (填“吸热”或“放热”)反应。
(2)该反应的热化学方程式为_____________ 。
(3)改变下列条件都可使该反应的反应速率改变,其中通过降低活化能加快反应速率的是_____________ 。
a.浓度 b.压强 c.温度 d.催化剂
(4)反应体系中加入催化剂对反应热是否有影响?____ (填“是”或“否”),原因是____ 。

反应过程
(1)该反应是
(2)该反应的热化学方程式为
(3)改变下列条件都可使该反应的反应速率改变,其中通过降低活化能加快反应速率的是
a.浓度 b.压强 c.温度 d.催化剂
(4)反应体系中加入催化剂对反应热是否有影响?
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐1】(1)1mol 乙烷在氧气中完全燃烧生成二氧化碳和液态水,放出热量 1558.3kJ。写出 乙烷燃烧的热化学方程式:__________________ 。
(2)已知:2SO2(g)+O2(g)=2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH=-113.0 kJ·mol-1
则反应 NO2(g)+SO2(g)=SO3(g)+NO(g)的 ΔH=_______________ kJ·mol-1。
(3)向盛有10mL0.01 mol/L 的硫氰化钾溶液的小烧杯中,加入10mol0.01mol/L的FeCl3溶液,混合液立即___ 。写出上述反应的离子方程式____________________ 。
(2)已知:2SO2(g)+O2(g)=2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH=-113.0 kJ·mol-1
则反应 NO2(g)+SO2(g)=SO3(g)+NO(g)的 ΔH=
(3)向盛有10mL0.01 mol/L 的硫氰化钾溶液的小烧杯中,加入10mol0.01mol/L的FeCl3溶液,混合液立即
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】已知下列热化学方程式:
①H2(g)+ O2(g)=H2O(l) ΔH=-285kJ/mol
O2(g)=H2O(l) ΔH=-285kJ/mol
②H2(g)+ O2(g)=H2O(g) ΔH=-241.8kJ/mol
O2(g)=H2O(g) ΔH=-241.8kJ/mol
③C(s)+ O2(g)=CO(g) ΔH=-110.4 kJ/mol
O2(g)=CO(g) ΔH=-110.4 kJ/mol
④C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
回答下列各问:
(1)上述反应中属于放热反应的是__ 。
(2)C的燃烧热为___ 。
(3)燃烧10gH2生成液态水,放出的热量为___ 。
(4)CO燃烧的热化学方程式为___ 。
(5)为了控制温室效应,各国科学家提出了不少设想。有人根据液态CO2密度大于海水密度的事实,设想将CO2液化后,送入深海海底,以减少大气中的CO2。为使CO2液化,可采取的措施__ 。
a.减压、升温 b.增压、降温 c.减压、降温 d.增压、升温
(6)写出下列反应的热化学方程式,N2(g)与适量H2(g)反应,生成2molNH3(g),放出92.2kJ热量___ 。
①H2(g)+
 O2(g)=H2O(l) ΔH=-285kJ/mol
O2(g)=H2O(l) ΔH=-285kJ/mol②H2(g)+
 O2(g)=H2O(g) ΔH=-241.8kJ/mol
O2(g)=H2O(g) ΔH=-241.8kJ/mol③C(s)+
 O2(g)=CO(g) ΔH=-110.4 kJ/mol
O2(g)=CO(g) ΔH=-110.4 kJ/mol④C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
回答下列各问:
(1)上述反应中属于放热反应的是
(2)C的燃烧热为
(3)燃烧10gH2生成液态水,放出的热量为
(4)CO燃烧的热化学方程式为
(5)为了控制温室效应,各国科学家提出了不少设想。有人根据液态CO2密度大于海水密度的事实,设想将CO2液化后,送入深海海底,以减少大气中的CO2。为使CO2液化,可采取的措施
a.减压、升温 b.增压、降温 c.减压、降温 d.增压、升温
(6)写出下列反应的热化学方程式,N2(g)与适量H2(g)反应,生成2molNH3(g),放出92.2kJ热量
您最近一年使用:0次

 2Cl2(g)+2H2O(g)
2Cl2(g)+2H2O(g)


