2020年1月,南开大学研究团队“高效手性螺环催化剂的发现”获得2019年度国家自然科学技术一等奖,含多种金属元素的催化剂正在刷新合成化学的新高度。
回答下列问题:
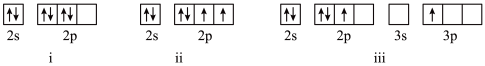
(1)形成“刚性”螺环的元素是碳,基态碳原子的价电子轨道表达式是___ 。
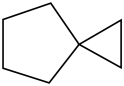
(2)如图是一种简单螺环烃,分子中碳原子的杂化方式为___ ,分子中___ (填“含”或“不含”)手性碳原子。
(3)铁及其化合物羰基铁[Fe(CO)5]常用作催化剂。
①1mol Fe(CO)5分子中含有的σ键数目为____ ,写出一种与CO互为等电子体的离子___ 。
②Fe(CO)5是一种浅黄色液体,熔点-20℃,沸点103℃,热稳定性较高,易溶于苯等有机溶剂,不溶于水。Fe(CO)5是___ (填“极性”或“非极性”)分子;配体CO提供孤电子对的原子是C而不是O,原因是____ 。
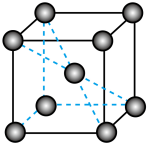
③如图是某Fe单质的晶胞模型。已知晶体密度为d g·cm-3,则铁原子的半径为___ nm(用含有d、NA的代数式表示)。
(4)在某些过渡金属的羰基化合物中,中心原子的价电子数与配体提供的电子数之和满足“18e-结构规则”。羰基铁与羰基镍的化学式分别为Fe(CO)5和Ni(CO)4,则羰基铬的化学式是___ 。
回答下列问题:
(1)形成“刚性”螺环的元素是碳,基态碳原子的价电子轨道表达式是
(2)如图是一种简单螺环烃,分子中碳原子的杂化方式为

(3)铁及其化合物羰基铁[Fe(CO)5]常用作催化剂。
①1mol Fe(CO)5分子中含有的σ键数目为
②Fe(CO)5是一种浅黄色液体,熔点-20℃,沸点103℃,热稳定性较高,易溶于苯等有机溶剂,不溶于水。Fe(CO)5是
③如图是某Fe单质的晶胞模型。已知晶体密度为d g·cm-3,则铁原子的半径为

(4)在某些过渡金属的羰基化合物中,中心原子的价电子数与配体提供的电子数之和满足“18e-结构规则”。羰基铁与羰基镍的化学式分别为Fe(CO)5和Ni(CO)4,则羰基铬的化学式是
更新时间:2020-06-01 10:47:42
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】元素周期表中第四周期的某些元素在生产、生活中有着广泛的应用。
(1)硒常用作光敏材料,基态硒原子的价电子排布图为__________ ;与硒同周期的p区元素中第一电离能大于硒的元素有__________ 种;SeO3的空间构型是_______________ 。
(2)科学家在研究金属矿物质组分的过程中,发现了Cu—Ni—Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体的方法是_____________________________________ 。
(3)镍能与类卤素(SCN)2反应生成Ni(SCN)2。(SCN)2分子中硫原子的杂化方式是__________________ ,σ键和π键数目之比为_____________ 。
(4)Co(NH3)5Cl3是钴的一种配合物,向100mL0.2mol·L-1该配合物的溶液中加入足量AgNO3溶液,生成5.74g白色沉淀,则该配合物的化学式为_____________ ,中心离子的配位数为________________ 。
(5)已知:r(Fe2+)为61pm,r(Co2+)为65pm。在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3的分解温度低于CoCO3,原因是__________________________________ 。
(6)某离子型铁的氧化物晶胞如下图所示,它由X、Y组成,则该氧化物的化学式为________________________ 。已知该晶体的密度为dg·cm-3,阿伏伽德罗常数的值为NA,则该晶体的晶胞参数a=_______ pm(用含d和NA的代数式表示)。

(1)硒常用作光敏材料,基态硒原子的价电子排布图为
(2)科学家在研究金属矿物质组分的过程中,发现了Cu—Ni—Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体的方法是
(3)镍能与类卤素(SCN)2反应生成Ni(SCN)2。(SCN)2分子中硫原子的杂化方式是
(4)Co(NH3)5Cl3是钴的一种配合物,向100mL0.2mol·L-1该配合物的溶液中加入足量AgNO3溶液,生成5.74g白色沉淀,则该配合物的化学式为
(5)已知:r(Fe2+)为61pm,r(Co2+)为65pm。在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3的分解温度低于CoCO3,原因是
(6)某离子型铁的氧化物晶胞如下图所示,它由X、Y组成,则该氧化物的化学式为

您最近一年使用:0次
【推荐2】氟及其化合物在生产、生活中十分重要,人们对它的研究和应用过程十分曲折。回答下列问题:
(1)1670年,德国人玻璃工斯瓦恩哈德无意中将萤石(CaF2)与浓硫酸1∶1混合在一起,结果产生了一种具有刺激性气味的烟雾,他发现这种气体能腐蚀玻璃,从而研究出一种不用金刚石或其他磨料也可以在玻璃上刻蚀图案的方法。写出这种刺激性气味的烟雾腐蚀玻璃(含 )的化学反应方程式:
)的化学反应方程式:___________ 。
(2)单质氟的制备是化学史上一段悲壮的历史,有多位化学家中毒,甚至付出生命。终于,1886年法国化学家莫瓦桑在低温下电解熔融的氟化氢钾(KHF2)制得单质氟,同时得到另一种气体单质。写出电解制备单质氟的阴极反应方程式:___________ 。
(3)氟单质的反应性非常强,可与稀有气体氙(Xe)发生反应。已知:
在标准压强 条件下
条件下
Ⅰ.
Ⅱ.
以反应Ⅰ为例,用 代表某组分的平衡分压,则
代表某组分的平衡分压,则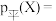 平衡时X的体积分数
平衡时X的体积分数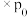 ,
,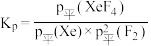 。
。
①根据上述数据判断反应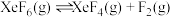 的焓变
的焓变
___________ (填“>”“<”或“=”)0。
②在一定压强下,提高平衡时 选择性的方法为
选择性的方法为___________ 或___________ 。
③若在标准压强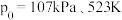 条件下以
条件下以 和
和 制取
制取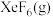 ,并使产物中
,并使产物中 ,则
,则 的平衡分压为标准压强(
的平衡分压为标准压强( )的
)的___________ 倍(用分数表示)。
(4)氟元素可以与很多元素形成化合物,其中氟与氧形成的 是一种比较稳定的化合物,经测定其键角小于
是一种比较稳定的化合物,经测定其键角小于 的键角,试解释原因
的键角,试解释原因___________ 。
(1)1670年,德国人玻璃工斯瓦恩哈德无意中将萤石(CaF2)与浓硫酸1∶1混合在一起,结果产生了一种具有刺激性气味的烟雾,他发现这种气体能腐蚀玻璃,从而研究出一种不用金刚石或其他磨料也可以在玻璃上刻蚀图案的方法。写出这种刺激性气味的烟雾腐蚀玻璃(含
 )的化学反应方程式:
)的化学反应方程式:(2)单质氟的制备是化学史上一段悲壮的历史,有多位化学家中毒,甚至付出生命。终于,1886年法国化学家莫瓦桑在低温下电解熔融的氟化氢钾(KHF2)制得单质氟,同时得到另一种气体单质。写出电解制备单质氟的阴极反应方程式:
(3)氟单质的反应性非常强,可与稀有气体氙(Xe)发生反应。已知:
在标准压强
 条件下
条件下Ⅰ.

Ⅱ.

以反应Ⅰ为例,用
 代表某组分的平衡分压,则
代表某组分的平衡分压,则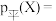 平衡时X的体积分数
平衡时X的体积分数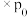 ,
,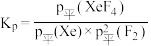 。
。①根据上述数据判断反应
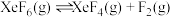 的焓变
的焓变
②在一定压强下,提高平衡时
 选择性的方法为
选择性的方法为③若在标准压强
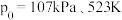 条件下以
条件下以 和
和 制取
制取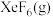 ,并使产物中
,并使产物中 ,则
,则 的平衡分压为标准压强(
的平衡分压为标准压强( )的
)的(4)氟元素可以与很多元素形成化合物,其中氟与氧形成的
 是一种比较稳定的化合物,经测定其键角小于
是一种比较稳定的化合物,经测定其键角小于 的键角,试解释原因
的键角,试解释原因
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】我国是率先掌握通过非线性光学晶体( KBBF)变频来获得深紫外激光技术的国家,KBF4是合成KBBF的主要原料,高温下分解为KF和BF3。
(1)灼烧钾及其化合物时,会产生特殊的焰色,这是由于钾元素的核外电子由_______ ( 填“激发态”或“基态”)跃迁到另一个状态时产生的光谱,该光谱属于_______ (填“发射”或“吸收”)光谱。
(2)离子晶体KF的晶格能(气态离子形成1 mol离子晶体释放的能量)可通过Bom-Haber循环计算得到:

①KF的晶格能为_______ kJ·mol-1。
②已知:气态非金属原子获得1个电子形成气态阴离子所释放的能量叫该原子的第一亲和能,则F原子的第一亲和能为_______ kJ·mol-1,试解释同周期元素第一亲和能F>O>C>N的原因:_______ 。
(3)BF3、NH3和PH3分子中键角由大到小的顺序为_______ 。
(4)已知BF3中存在π键,则BF3中B- F键的键长_______ (填“大于”“小于”或“等于”)  中B-F键的键长;
中B-F键的键长; 的中心原子的轨道杂化类型是
的中心原子的轨道杂化类型是_______ 。
(5)KF晶体的晶胞与NaCl相似,若K+按ABCACB……方式堆积,则F-占据的是K+围成的_______ 空隙(填几何空间构型) ,每个K+周围紧邻的K+个数为_______ 。设 NA为阿伏加德罗常数的值,KF晶体的密度为ρg·cm-3,则K+与K+的最短距离为_______ pm(用含ρ、NA的代数式表示)。
(1)灼烧钾及其化合物时,会产生特殊的焰色,这是由于钾元素的核外电子由
(2)离子晶体KF的晶格能(气态离子形成1 mol离子晶体释放的能量)可通过Bom-Haber循环计算得到:

①KF的晶格能为
②已知:气态非金属原子获得1个电子形成气态阴离子所释放的能量叫该原子的第一亲和能,则F原子的第一亲和能为
(3)BF3、NH3和PH3分子中键角由大到小的顺序为
(4)已知BF3中存在π键,则BF3中B- F键的键长
 中B-F键的键长;
中B-F键的键长; 的中心原子的轨道杂化类型是
的中心原子的轨道杂化类型是(5)KF晶体的晶胞与NaCl相似,若K+按ABCACB……方式堆积,则F-占据的是K+围成的
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】太阳能的开发利用在新能源研究中占据重要地位.单晶硅太阳能电池片在加工时,一般掺杂微置的锎.硼.镓.硒等。回答下列问题:
(1)硒的基态原子的电子排布式为________ 。已知铜和某元素M的电负性分别是1.9和3.0,则铜与M形成的化合物属于________ 填“离子”,“共价”)化合物。已知高温下Cu2O比CuO更稳定,试从铜原子核外电子结构变化角度解释________________ 。
(2)铜与类卤素(SCN)2反应生成Cu(SCN)2,类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N )的沸点低于异硫氰酸(H﹣N=C=S)的沸点.其原因是________ 。
(3)硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,如BF3能与NH3反应生成BF3·NH3.在BF3·NH3中B原子的杂化方式为________ ,B与N之间形成配位键,氮原子提供________ 。写出一种与NH3互为等电子体的离子的化学式______________ 。
(4)含硼化合物是一种常见的还原剂,结构如图所示。请在图中画出配位键________ 。

(5)多硼酸根离子可以通过三角形共用原子连接成链状,片状或者三维网状多硼酸根离子。下图是无限长单链结构的多硼酸根离子,其中与原子数之比为,化学式为________________

(1)硒的基态原子的电子排布式为
(2)铜与类卤素(SCN)2反应生成Cu(SCN)2,类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N )的沸点低于异硫氰酸(H﹣N=C=S)的沸点.其原因是
(3)硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,如BF3能与NH3反应生成BF3·NH3.在BF3·NH3中B原子的杂化方式为
(4)含硼化合物是一种常见的还原剂,结构如图所示。请在图中画出配位键

(5)多硼酸根离子可以通过三角形共用原子连接成链状,片状或者三维网状多硼酸根离子。下图是无限长单链结构的多硼酸根离子,其中与原子数之比为,化学式为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】磷化硼是一种典型的超硬无机材料,常以BCl3、PH3为原料制备。回答下列问题:
(1)基态P原子与B原子中未成对电子数之比为___ 。
(2)与BC13分子互为等电子体的一种离子为___ (填化学式)。
(3)PH3分子的立体结构为___ ;PH3的沸点___ (填“高于”或“低于”)NH3,理由是___ 。
(4)BCl3、PCl3和PF3三种分子中键角由大到小的顺序为___ 。
(5)BCl3可转化为硼酸,硼酸为一元弱酸的原因是___ (用离子方程式表示)。
(6)磷化硼晶胞的示意图如图甲所示,其中实心球表示P原子,空心球表示B原子,晶胞中P原子空间堆积方式为___ 。已知磷化硼晶体的密度为ρg·cm-3,设阿伏加 德罗常数的值为NA,则晶胞中B原子与P原子间最短距离为___ pm。若磷化硼晶胞沿着体对角线方向的投影如图乙所示(虚线圆圈表示P原子的投影),请在图乙中用实线圆圈画出B原子的投影位置___ (注意原子体积的相对大小)。

(1)基态P原子与B原子中未成对电子数之比为
(2)与BC13分子互为等电子体的一种离子为
(3)PH3分子的立体结构为
(4)BCl3、PCl3和PF3三种分子中键角由大到小的顺序为
(5)BCl3可转化为硼酸,硼酸为一元弱酸的原因是
(6)磷化硼晶胞的示意图如图甲所示,其中实心球表示P原子,空心球表示B原子,晶胞中P原子空间堆积方式为

您最近一年使用:0次
【推荐3】盐酸、硝酸、硫酸在工业生产中具有重要的作用。
(1)“王水”是浓盐酸和浓硝酸按体积比3: l组成的混合物,“王水”溶金的原理为HNO3+3HCl=Cl2+NOCl+2H2O,金离子与氯离子形成AuCl4-离子,增强了金属的还原能力。
① 试写出金与王水反应生成H[AuCl4]的化学方程式:_________ ;其中AuCl4-的配位数是________ ;
② 已知:NOCl的熔点-645℃,沸点-5.5℃,NOCl固体的晶体类型是__________ ;
③ 组成NOCl分子的三种元素中,电负性N_____ O(填“>”、“<”或“=”);熔沸点H2O____ NH3(填“>”、“<”或“=”);与NH3互为等电子体的阳离子有________ (写出一种即可)。
(2)硝酸在有机反应中也有重要用途。TNT炸药、苦味酸是硝酸与甲苯、苯酚发生取代反应制成的。其中甲苯分子中碳原子的杂化方式为______ , 1mol甲苯分子中含有σ键的数目为_____ ;试解释在水中苯酚溶解度大于甲苯的原因________ 。
(3)在硝酸工业中有一种重要金属即为Cu,CuCl晶胞结构如图所示。已知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,则该晶胞边长为_______ pm (只写计算式)。
(1)“王水”是浓盐酸和浓硝酸按体积比3: l组成的混合物,“王水”溶金的原理为HNO3+3HCl=Cl2+NOCl+2H2O,金离子与氯离子形成AuCl4-离子,增强了金属的还原能力。
① 试写出金与王水反应生成H[AuCl4]的化学方程式:
② 已知:NOCl的熔点-645℃,沸点-5.5℃,NOCl固体的晶体类型是
③ 组成NOCl分子的三种元素中,电负性N
(2)硝酸在有机反应中也有重要用途。TNT炸药、苦味酸是硝酸与甲苯、苯酚发生取代反应制成的。其中甲苯分子中碳原子的杂化方式为

(3)在硝酸工业中有一种重要金属即为Cu,CuCl晶胞结构如图所示。已知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,则该晶胞边长为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】超分子指多个分子组合在一起形成的具有特定结构和功能的聚集体,超分子内部分子通过非共价键相结合.冠醚是大环多醚类物质的总称,能与阳离子作用,并随环大小不同对阳离子具有选择性作用,图为常见的三种冠醚结构。
已知: 与冠醚b结合能力强,使钾盐在该液体冠醚中溶解性好.
与冠醚b结合能力强,使钾盐在该液体冠醚中溶解性好.
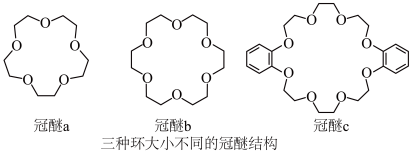
(1)下列冠醚中O原子的基态或激发态价电子中,能量由低到高排列的正确顺序为________ 。
(2) 具有强氧化性,
具有强氧化性, 在元素周期表中的位置是
在元素周期表中的位置是________ ,其水溶液对环己烯的氧化效果很差,若将环己烯溶于冠醚b再加入 ,氧化效果大幅度提升,原因是
,氧化效果大幅度提升,原因是________ 。
(3)分子A(结构如图所示)能与冠醚c形成一种分子梭结构,其中N的杂化为________ ,该分子梭可以通过加入酸或碱使冠醚c在位点1和位点2之间来回移动.加酸冠醚c移动到位点2,冠醚c与位点2之间的相互作用为________ 。
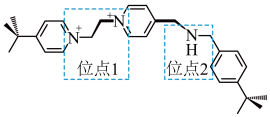
a.静电相互作用 b.离子键 c.共价键 d.氢键
(4) 与冠醚a结合能力强,
与冠醚a结合能力强, 有独特的电性、磁性和光致发光性能。
有独特的电性、磁性和光致发光性能。
① 的价电子排布式为
的价电子排布式为________ 。
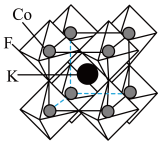
② 晶体结构如图所示,每个小正八面体的顶点均为F原子,该立方晶胞中
晶体结构如图所示,每个小正八面体的顶点均为F原子,该立方晶胞中 的配位数为
的配位数为________ ,该晶体密度为 ,则该晶胞的棱长为
,则该晶胞的棱长为________  。
。
已知:
 与冠醚b结合能力强,使钾盐在该液体冠醚中溶解性好.
与冠醚b结合能力强,使钾盐在该液体冠醚中溶解性好.
(1)下列冠醚中O原子的基态或激发态价电子中,能量由低到高排列的正确顺序为

(2)
 具有强氧化性,
具有强氧化性, 在元素周期表中的位置是
在元素周期表中的位置是 ,氧化效果大幅度提升,原因是
,氧化效果大幅度提升,原因是(3)分子A(结构如图所示)能与冠醚c形成一种分子梭结构,其中N的杂化为

a.静电相互作用 b.离子键 c.共价键 d.氢键
(4)
 与冠醚a结合能力强,
与冠醚a结合能力强, 有独特的电性、磁性和光致发光性能。
有独特的电性、磁性和光致发光性能。①
 的价电子排布式为
的价电子排布式为②
 晶体结构如图所示,每个小正八面体的顶点均为F原子,该立方晶胞中
晶体结构如图所示,每个小正八面体的顶点均为F原子,该立方晶胞中 的配位数为
的配位数为 ,则该晶胞的棱长为
,则该晶胞的棱长为 。
。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题。
(1)请把B以及B同周期且原子序数比B小的原子按第一电离能从大到小的顺序排列:_______ (用相应的元素符号表示)。A、D两种元素中,电负性A_______ D(填“>”或“<”)
(2)基态B原子的价电子排布图为_______ ,占据最高能级的电子云轮廓图形状为_______ 。
(3)C的最高价含氧酸根离子的空间构型为_______ ,中心原子杂化轨道类型为_______ 。
(4)下图是E与镍形成的合金的立方晶胞结构,其中原子A的坐标参数为(0,1,0)。

①原子B的坐标参数为_______
②)若该晶体密度为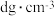 ,则E与镍原子间最短距离为
,则E与镍原子间最短距离为_______ pm(用含d和NA的式子表示)
(5)Ni属于_______ 区的元素,元素E与镍的第二电离能分别为: ,
, ,从原子结构知识解释
,从原子结构知识解释 的原因是
的原因是_______ 。
| A | 基态原子最外层电子数是次外层的三倍 |
| B | 基态原子核外有13种不同运动状态的电子 |
| C | 与B同一周期,原子中未成对电子数是同周期中最多 |
| D |  的核外电子排布与氩原子相同 的核外电子排布与氩原子相同 |
| E | 是ds区原子序数最小的元素 |
(2)基态B原子的价电子排布图为
(3)C的最高价含氧酸根离子的空间构型为
(4)下图是E与镍形成的合金的立方晶胞结构,其中原子A的坐标参数为(0,1,0)。

①原子B的坐标参数为
②)若该晶体密度为
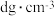 ,则E与镍原子间最短距离为
,则E与镍原子间最短距离为(5)Ni属于
 ,
, ,从原子结构知识解释
,从原子结构知识解释 的原因是
的原因是
您最近一年使用:0次
【推荐3】铁、钴及其化合物在生活中有广泛应用。
(1)Fe2+的基态核外电子排布式为___________ 。
(2)实验室用KSCN溶液、苯酚检验Fe3+。
①1mol苯酚分子中含有σ键的数目为___________ 。
②类卤素离子SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H S
S C≡N)和异硫氰酸
C≡N)和异硫氰酸 ,这两种酸中沸点较高的是
,这两种酸中沸点较高的是___________ ,原因:___________ 。
(3)氮化铁晶体的晶胞结构如图−1所示。该晶体中铁、氮的微粒个数之比为___________ 。

(4)某铁的化合物结构简式如图−2所示:

①上述化合物中所含有的非金属元素的电负性由大到小的顺序为___________ (用元素符号表示)。
②上述化合物中氮原子的杂化方式为___________ 。
(5)配合物[Co(NH3)5Cl]Cl2中与Co2+形成配位键的原子是___________ (用元素符号表示),与NH3互为等电子体的离子是___________ ,区别[Co(NH3)5Cl]Cl2和[Co(NH3)6]Cl3这两种晶体的实验方案为___________ 。
(1)Fe2+的基态核外电子排布式为
(2)实验室用KSCN溶液、苯酚检验Fe3+。
①1mol苯酚分子中含有σ键的数目为
②类卤素离子SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H
 S
S C≡N)和异硫氰酸
C≡N)和异硫氰酸 ,这两种酸中沸点较高的是
,这两种酸中沸点较高的是(3)氮化铁晶体的晶胞结构如图−1所示。该晶体中铁、氮的微粒个数之比为

(4)某铁的化合物结构简式如图−2所示:

①上述化合物中所含有的非金属元素的电负性由大到小的顺序为
②上述化合物中氮原子的杂化方式为
(5)配合物[Co(NH3)5Cl]Cl2中与Co2+形成配位键的原子是
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】一定条件下,Fe、HCN与K2CO3可发生反应Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O。
请回答下列问题:
(1)金属铁的晶胞如下图所示,其配位数为________ 。

(2)HCN分子的结构式为________ ,写出一种与CN-互为等电子体的阴离子:________ 。
(3)NH3的键角大于H2O,原因是____________ 。
(4)K4Fe(CN)6的中心离子的价层电子排布图为__________ 。
(5)C、N、O、H的第一电离能由小到大的顺序为___________ 。
(6)冰的晶体结构模型如图所示,其晶胞结构(如图所示)与金刚石的晶胞结构相似,水分子间以氢键相连,则一个晶胞中含有_____ 个氢键,用NA表示阿伏加 德罗常数的值,若氢键的键长为dnm,则晶体密度ρ=________ (用含有d、NA的代数式表示)g·cm-3。

请回答下列问题:
(1)金属铁的晶胞如下图所示,其配位数为

(2)HCN分子的结构式为
(3)NH3的键角大于H2O,原因是
(4)K4Fe(CN)6的中心离子的价层电子排布图为
(5)C、N、O、H的第一电离能由小到大的顺序为
(6)冰的晶体结构模型如图所示,其晶胞结构(如图所示)与金刚石的晶胞结构相似,水分子间以氢键相连,则一个晶胞中含有

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】铜是人类最早发现的金属之一,铜及其化合物在生活和生产中有着广泛的应用。根据信息回答下列问题:
(1)基态铜原子价层电子的轨道表达式为_______ 中,单质铜是由_______ 键形成的晶体。
(2)与铜同周期,N能层电子数与铜相同,熔点最低的金属是_______ 。
(3)农药波尔多液的有效杀菌成分是Cu2(OH)2SO4 (碱式硫酸铜) ,Cu2(OH)2SO4中非金属元素电负性由小到大的顺序是_______ ,写出与 SO 互为等电子体的一种分子的化学式
互为等电子体的一种分子的化学式_______ 。
(4)氨缩脲( )分子中氮原子的杂化类型为
)分子中氮原子的杂化类型为_______ ,σ 键与π键的数目之比为 _______ 。氨缩脲与胆矾溶液反应得到如图所示的离子,1mol该离子中含配位键的数目为_______ 。

(5)白铜(铜镍合金)的立方晶胞结构如图所示,其中原子A的坐标参数为(0,1,0)。 原子B的坐标参数为_______ ;若该晶体密度为dg·cm-3,阿伏加德罗常数为NA,则铜镍原子间最短距离为 _______ pm。

(1)基态铜原子价层电子的轨道表达式为
(2)与铜同周期,N能层电子数与铜相同,熔点最低的金属是
(3)农药波尔多液的有效杀菌成分是Cu2(OH)2SO4 (碱式硫酸铜) ,Cu2(OH)2SO4中非金属元素电负性由小到大的顺序是
 互为等电子体的一种分子的化学式
互为等电子体的一种分子的化学式(4)氨缩脲(
 )分子中氮原子的杂化类型为
)分子中氮原子的杂化类型为
(5)白铜(铜镍合金)的立方晶胞结构如图所示,其中原子A的坐标参数为(0,1,0)。 原子B的坐标参数为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态Fe2+的简化电子排布式为______________________ 。
(2)FeCl3的熔点为306 ℃,沸点为315 ℃, FeCl3的晶体类型是_________ 。FeSO4常作净水剂和补铁剂,SO 的立体构型是
的立体构型是___________________ 。
(3)实验室用KSCN溶液、苯酚(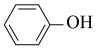 )检验Fe3+。N、O、S三种元素的第一电离能由大到小的顺序为
)检验Fe3+。N、O、S三种元素的第一电离能由大到小的顺序为____________________ (用元素符号表示),苯酚中碳原子的杂化轨道类型为__________________________ 。
(4)羰基铁[Fe (CO)5]可用作催化剂、汽油抗爆剂等。1 mol Fe (CO)5分子中含_______ mol σ键,与CO互为等电子体的离子是_______________ (填化学式,写一种)。
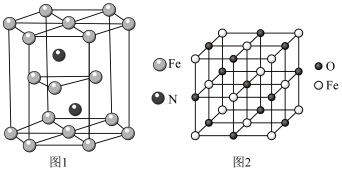
(5)氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为________ 。
(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-3, NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____________ ;Fe2+与O2-最短核间距为_________ pm。
(1)基态Fe2+的简化电子排布式为
(2)FeCl3的熔点为306 ℃,沸点为315 ℃, FeCl3的晶体类型是
 的立体构型是
的立体构型是(3)实验室用KSCN溶液、苯酚(
 )检验Fe3+。N、O、S三种元素的第一电离能由大到小的顺序为
)检验Fe3+。N、O、S三种元素的第一电离能由大到小的顺序为(4)羰基铁[Fe (CO)5]可用作催化剂、汽油抗爆剂等。1 mol Fe (CO)5分子中含
(5)氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为
(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-3, NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为

您最近一年使用:0次



