研究氮氧化物的反应机理,对于消除其对环境的污染具有重要意义。
(1)升高温度,绝大多数的化学反应速率增大,但是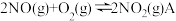 的反应速率却随着温度的升高而减小。查阅资料得知,该反应历程分为以下两步:
的反应速率却随着温度的升高而减小。查阅资料得知,该反应历程分为以下两步:
Ⅰ.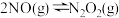 (快)
(快) 
 正
正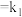 正
正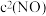
 逆
逆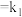 逆
逆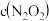
Ⅱ.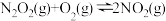 (慢)
(慢) 
 正
正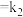 正
正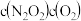
 逆
逆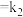 逆
逆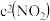
回答:
①反应 的
的
____ (用含 和
和 的式子表示)。一定温度下,反应
的式子表示)。一定温度下,反应 达到平衡状态,写出用
达到平衡状态,写出用 正、
正、 逆、
逆、 正、
正、 逆表示的平衡常数表达式
逆表示的平衡常数表达式
____ 。
②决定 反应速率的是反应Ⅱ,则反应Ⅰ的活化能
反应速率的是反应Ⅱ,则反应Ⅰ的活化能 与反应Ⅱ的活化能
与反应Ⅱ的活化能 的大小关系为
的大小关系为
____  (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。
(2)亚硝酸氯( )是有机合成中重要的试剂,可
)是有机合成中重要的试剂,可 与
与 在一定条件下合成。在
在一定条件下合成。在 容器恒温条件下,将物质的量之和为
容器恒温条件下,将物质的量之和为 的
的 和
和 以不同的氮氯比进行如下反应:
以不同的氮氯比进行如下反应: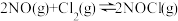
 ,平衡时某反应物的转化率与氮氯比及不同温度的关系结果如下图。
,平衡时某反应物的转化率与氮氯比及不同温度的关系结果如下图。
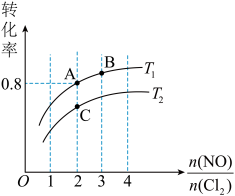
①判断图中温度 、
、 的关系:
的关系:
____  。(填“
。(填“ ”、“
”、“ ”或“
”或“ ”)
”)
②图中纵坐标为物质____ (填化学式)的转化率,理由是_____ 。
③图中 、
、 、
、 三点中平衡时
三点中平衡时 体积分数最大的是
体积分数最大的是____ 。(填“ ”、“
”、“ ”或“
”或“ ”)
”)
④ 温度下,该反应的平衡常数
温度下,该反应的平衡常数
____ 。
(1)升高温度,绝大多数的化学反应速率增大,但是
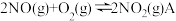 的反应速率却随着温度的升高而减小。查阅资料得知,该反应历程分为以下两步:
的反应速率却随着温度的升高而减小。查阅资料得知,该反应历程分为以下两步:Ⅰ.
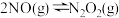 (快)
(快) 
 正
正 正
正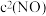
 逆
逆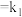 逆
逆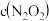
Ⅱ.
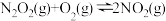 (慢)
(慢) 
 正
正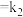 正
正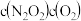
 逆
逆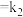 逆
逆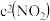
回答:
①反应
 的
的
 和
和 的式子表示)。一定温度下,反应
的式子表示)。一定温度下,反应 达到平衡状态,写出用
达到平衡状态,写出用 正、
正、 逆、
逆、 正、
正、 逆表示的平衡常数表达式
逆表示的平衡常数表达式
②决定
 反应速率的是反应Ⅱ,则反应Ⅰ的活化能
反应速率的是反应Ⅱ,则反应Ⅰ的活化能 与反应Ⅱ的活化能
与反应Ⅱ的活化能 的大小关系为
的大小关系为
 (填“
(填“ ”“
”“ ”或“
”或“ ”)。
”)。(2)亚硝酸氯(
 )是有机合成中重要的试剂,可
)是有机合成中重要的试剂,可 与
与 在一定条件下合成。在
在一定条件下合成。在 容器恒温条件下,将物质的量之和为
容器恒温条件下,将物质的量之和为 的
的 和
和 以不同的氮氯比进行如下反应:
以不同的氮氯比进行如下反应: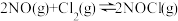
 ,平衡时某反应物的转化率与氮氯比及不同温度的关系结果如下图。
,平衡时某反应物的转化率与氮氯比及不同温度的关系结果如下图。
①判断图中温度
 、
、 的关系:
的关系:
 。(填“
。(填“ ”、“
”、“ ”或“
”或“ ”)
”)②图中纵坐标为物质
③图中
 、
、 、
、 三点中平衡时
三点中平衡时 体积分数最大的是
体积分数最大的是 ”、“
”、“ ”或“
”或“ ”)
”)④
 温度下,该反应的平衡常数
温度下,该反应的平衡常数
更新时间:2020-06-09 16:35:35
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】 有效转化是研究“碳中和”的重要方向。
有效转化是研究“碳中和”的重要方向。
(1) 可用于人工合成淀粉,其中前两步的反应如下图所示。
可用于人工合成淀粉,其中前两步的反应如下图所示。
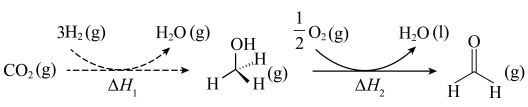
已知

则 的
的
___________ (用 、
、 、
、 表示)。
表示)。
(2)CO2催化加氢可合成乙烯,反应为2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH<0,在恒压密闭容器中,起始充入2molCO2(g)和6molH2(g)发生反应,不同温度下达到平衡时各组分的体积分数随温度的变化如图所示。
C2H4(g)+4H2O(g) ΔH<0,在恒压密闭容器中,起始充入2molCO2(g)和6molH2(g)发生反应,不同温度下达到平衡时各组分的体积分数随温度的变化如图所示。
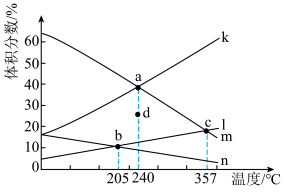
①下列说法正确的是____
A.b点时:2v正(H2)=3v逆(H2O)
B.a、b、c三点的平衡常数:Ka>Kc>Kb
C.将H2O(g)液化分离可提高C2H4的产率
D.活性更高的催化剂可提高CO2的平衡转化率
②表示C2H4体积分数随温度变化的曲线是___________ (填“k”“l”“m”或“n”)
③若d点表示240℃某时刻H2的体积分数,保持温度不变,则反应向_________ (填“正”或“逆”)反应方向进行。
④205℃,反应达b点所用时间为tmin,则此过程中用CO2表示的反应速率是______ mol/min。若平衡时b点总压为P,则平衡常数Kp=_________ (列出计算式,以分压表示,分压=总压×物质的量分数)。
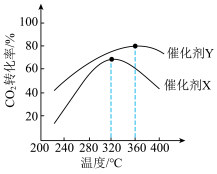
⑤其他条件相同,分别在催化剂X、Y作用下发生该反应,测得相同时间CO2的转化率与温度的关系如下图所示。使用催化剂X,当温度高于302℃,CO2转化随着温度升高而下降的原因是___________ 。
 有效转化是研究“碳中和”的重要方向。
有效转化是研究“碳中和”的重要方向。(1)
 可用于人工合成淀粉,其中前两步的反应如下图所示。
可用于人工合成淀粉,其中前两步的反应如下图所示。
已知


则
 的
的
 、
、 、
、 表示)。
表示)。(2)CO2催化加氢可合成乙烯,反应为2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g) ΔH<0,在恒压密闭容器中,起始充入2molCO2(g)和6molH2(g)发生反应,不同温度下达到平衡时各组分的体积分数随温度的变化如图所示。
C2H4(g)+4H2O(g) ΔH<0,在恒压密闭容器中,起始充入2molCO2(g)和6molH2(g)发生反应,不同温度下达到平衡时各组分的体积分数随温度的变化如图所示。
①下列说法正确的是
A.b点时:2v正(H2)=3v逆(H2O)
B.a、b、c三点的平衡常数:Ka>Kc>Kb
C.将H2O(g)液化分离可提高C2H4的产率
D.活性更高的催化剂可提高CO2的平衡转化率
②表示C2H4体积分数随温度变化的曲线是
③若d点表示240℃某时刻H2的体积分数,保持温度不变,则反应向
④205℃,反应达b点所用时间为tmin,则此过程中用CO2表示的反应速率是
⑤其他条件相同,分别在催化剂X、Y作用下发生该反应,测得相同时间CO2的转化率与温度的关系如下图所示。使用催化剂X,当温度高于302℃,CO2转化随着温度升高而下降的原因是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】CO是合成尿素、甲酸的原料。
(1)在100 kPa和T K下,由稳定单质生成1 mol化合物的焓变称为该物质在T K时的标准摩尔生成焓,用符号ΔHθ表示。已知石墨和一氧化碳的燃烧热分别为393.5 kJ·mol-1和283.0 kJ·mol-1,则CO(g)的ΔHθ=_________ 。
(2)合成尿素的反应:2NH3(g)+CO(g)⇌CO(NH2)2(g)+H2(g) ΔH=-81.0 kJ·mol-1;T℃时,在体积为2 L 的恒容密闭容器中,将2 mol的NH3和1 mol CO混合反应,5 min时,NH3的转化率为80%。则0~5 min平均反应速率为v(CO)=_________ 。
已知:
则:K1________ (填“>”或“<”)126.5;其判断理由是__________ 。
(3)若保持恒温恒容条件,将物质的量之和为3 mol的NH3和CO以不同的氨碳比进行反应,结果如图所示:

①若图中c表示平衡体系中尿素的体积分数,则a表示________ 的转化率。
②当 =
=________ 时,尿素含量最大;在该条件下,对于该反应既能增大反应速率又能使平衡正向移动的措施是_____ (写一种)。
(1)在100 kPa和T K下,由稳定单质生成1 mol化合物的焓变称为该物质在T K时的标准摩尔生成焓,用符号ΔHθ表示。已知石墨和一氧化碳的燃烧热分别为393.5 kJ·mol-1和283.0 kJ·mol-1,则CO(g)的ΔHθ=
(2)合成尿素的反应:2NH3(g)+CO(g)⇌CO(NH2)2(g)+H2(g) ΔH=-81.0 kJ·mol-1;T℃时,在体积为2 L 的恒容密闭容器中,将2 mol的NH3和1 mol CO混合反应,5 min时,NH3的转化率为80%。则0~5 min平均反应速率为v(CO)=
已知:
| 温度/K | 398 | 498 | … |
| 平衡常数(K) | 126.5 | K1 | … |
则:K1
(3)若保持恒温恒容条件,将物质的量之和为3 mol的NH3和CO以不同的氨碳比进行反应,结果如图所示:

①若图中c表示平衡体系中尿素的体积分数,则a表示
②当
 =
=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】工业上采用乙苯与CO2脱氢生产重要化工原料苯乙烯的反应:
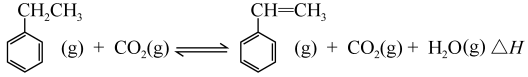
其中乙苯在CO2气氛中的反应可分两步进行:

(1)上述乙苯与CO2反应的反应热△H=_______________ 。
(2)下列叙述不能说明乙苯与CO2反应已达到平衡状态的是________________ 。
a.恒温恒压时气体密度不变 b.c(CO2) = c(CO)
c.消耗1molCO2同时生成 1molH2O d.CO2的体积分数保持不变
(3)在3L密闭容器内,乙苯与CO2发生反应。在三种不同的条件下进行实验,乙苯、CO2的起始浓度均分别为1 mol/L和3 mol/L,其中实验I在T1。C、P1 Pa下,而实验II、III分别改变了某一个实验条件(假设均不影响物质的状态),乙苯的浓度随时间的变化如图1所示。

①实验I乙苯在0-50min时的反应速率为_______________ 。
②实验Ⅱ可能改变条件的是____________________ 。
③图2是实验I中苯乙烯体积分数V%随时间t的变化曲线,请在图2中补画实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线_______ 。
(4)实验I达到平衡后,在该温度下,向该容器中再通入乙苯和CO2各1mol,重新达到平衡时,乙苯的转化率将__________ (填“增大”、“减小”或“不变”),此时平衡常数为______________ 。

其中乙苯在CO2气氛中的反应可分两步进行:

(1)上述乙苯与CO2反应的反应热△H=
(2)下列叙述不能说明乙苯与CO2反应已达到平衡状态的是
a.恒温恒压时气体密度不变 b.c(CO2) = c(CO)
c.消耗1molCO2同时生成 1molH2O d.CO2的体积分数保持不变
(3)在3L密闭容器内,乙苯与CO2发生反应。在三种不同的条件下进行实验,乙苯、CO2的起始浓度均分别为1 mol/L和3 mol/L,其中实验I在T1。C、P1 Pa下,而实验II、III分别改变了某一个实验条件(假设均不影响物质的状态),乙苯的浓度随时间的变化如图1所示。

①实验I乙苯在0-50min时的反应速率为
②实验Ⅱ可能改变条件的是
③图2是实验I中苯乙烯体积分数V%随时间t的变化曲线,请在图2中补画实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线
(4)实验I达到平衡后,在该温度下,向该容器中再通入乙苯和CO2各1mol,重新达到平衡时,乙苯的转化率将
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】甲醇合成反应为:CO(g)+2H2(g)  CH3OH(g)。工业上用天然气为原料,分为两阶段:
CH3OH(g)。工业上用天然气为原料,分为两阶段:
Ⅰ、制备合成气:
用天然气和水制取原料气的方程式为:____________________ 。
原料气中常添加CO2以解决合成气中H2过量CO不足问题,请用方程式解释原因_____________________ 。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为_________ 。
Ⅱ、合成甲醇:
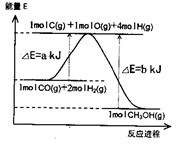
(1)反应过程中物质能量变化如图所示。写出合成甲醇的热化学方程式____ 。
实验室在1L密闭容器中进行模拟合成实验。将1molCO和2molH2通入容器中,分别恒温在3000C和5000C反应,每隔一定时间测得容器中甲醇的浓度如下:
(2)在3000C反应开始10分钟内,H2的平均反应速率_____________ 。
(3)5000C平衡常数K=___________ 。
(4)在另一体积不变的容器中,充入1.2molCO和2.0molH2,一定条件下达到平衡,测得容器内压强为起始的一半。计算该条件下H2转化率为________ 。
 CH3OH(g)。工业上用天然气为原料,分为两阶段:
CH3OH(g)。工业上用天然气为原料,分为两阶段:Ⅰ、制备合成气:
用天然气和水制取原料气的方程式为:
原料气中常添加CO2以解决合成气中H2过量CO不足问题,请用方程式解释原因
Ⅱ、合成甲醇:
(1)反应过程中物质能量变化如图所示。写出合成甲醇的热化学方程式

实验室在1L密闭容器中进行模拟合成实验。将1molCO和2molH2通入容器中,分别恒温在3000C和5000C反应,每隔一定时间测得容器中甲醇的浓度如下:
| 10min | 20min | 30min | 40min | 50min | 60min | |
| 3000C | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 5000C | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
(3)5000C平衡常数K=
(4)在另一体积不变的容器中,充入1.2molCO和2.0molH2,一定条件下达到平衡,测得容器内压强为起始的一半。计算该条件下H2转化率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】请回答下列问题。
I.在一定体积的密闭容器中,进行如下化学反应: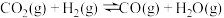 ,其化学平衡常数K和温度T的关系如表所示:
,其化学平衡常数K和温度T的关系如表所示:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_______ 。
(2)该反应的正反应为_______ (填“吸热”或“放热”)反应。
(3)某温度下,平衡浓度符合下式: ,试判断此时的温度为
,试判断此时的温度为_______  。此温度下加入
。此温度下加入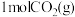 和
和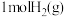 ,充分反应,达到平衡时,CO2的转化率为
,充分反应,达到平衡时,CO2的转化率为_______ 。
(4)在 时,发生上述反应,某一时刻测得容器内各物质的浓度分别为
时,发生上述反应,某一时刻测得容器内各物质的浓度分别为 为
为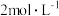 ,
, 为
为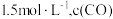 为
为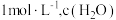 为
为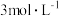 ,则此时平衡
,则此时平衡_______ (填“向左移动”“向右移动”或“不移动”)。
II.H2S受热发生分解反应: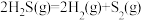 ,在密闭容器中充入
,在密闭容器中充入 ,压强为p时,控制不同的温度(从左到右依次为
,压强为p时,控制不同的温度(从左到右依次为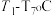 )进行实验,H2S的平衡转化率如图所示。
)进行实验,H2S的平衡转化率如图所示。

(5)压强为p,温度为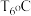 时,反应经
时,反应经 达到平衡,则平均反应速率
达到平衡,则平均反应速率
_______ 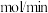 。
。
(6)若压强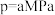 ,温度为
,温度为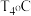 时,该反应的平衡常数
时,该反应的平衡常数
_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
I.在一定体积的密闭容器中,进行如下化学反应:
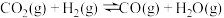 ,其化学平衡常数K和温度T的关系如表所示:
,其化学平衡常数K和温度T的关系如表所示: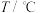 | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=
(2)该反应的正反应为
(3)某温度下,平衡浓度符合下式:
 ,试判断此时的温度为
,试判断此时的温度为 。此温度下加入
。此温度下加入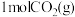 和
和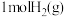 ,充分反应,达到平衡时,CO2的转化率为
,充分反应,达到平衡时,CO2的转化率为(4)在
 时,发生上述反应,某一时刻测得容器内各物质的浓度分别为
时,发生上述反应,某一时刻测得容器内各物质的浓度分别为 为
为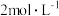 ,
, 为
为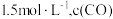 为
为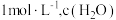 为
为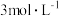 ,则此时平衡
,则此时平衡II.H2S受热发生分解反应:
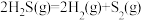 ,在密闭容器中充入
,在密闭容器中充入 ,压强为p时,控制不同的温度(从左到右依次为
,压强为p时,控制不同的温度(从左到右依次为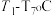 )进行实验,H2S的平衡转化率如图所示。
)进行实验,H2S的平衡转化率如图所示。
(5)压强为p,温度为
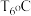 时,反应经
时,反应经 达到平衡,则平均反应速率
达到平衡,则平均反应速率
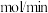 。
。(6)若压强
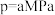 ,温度为
,温度为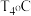 时,该反应的平衡常数
时,该反应的平衡常数
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O⇌2NH3+ O2,进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3 h):
O2,进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3 h):
请回答下列问题:
(1)50℃时从开始到3h内以O2物质的量变化表示的平均反应速率为___________ mol·h-1
(2)该反应过程与能量关系可用如图表示,则反应的热化学方程式是___________ 。

(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率较慢。请提出可提高其反应速率且增大NH3生成量的建议:___________ 。
(4)工业合成氨的热化学方程式为N2(g)+3H2(g)⇌2NH3(g)ΔH=-92.4 kJ/mol。在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:
①该条件下的平衡常数为___________ ;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。反应放出的热量___________ (填“>”“<”或“=” )92.4 kJ。
 O2,进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3 h):
O2,进一步研究NH3生成量与温度的关系,部分实验数据见表(反应时间3 h):| T/℃ | 30 | 40 | 50 |
| 生成NH3量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
(1)50℃时从开始到3h内以O2物质的量变化表示的平均反应速率为
(2)该反应过程与能量关系可用如图表示,则反应的热化学方程式是

(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率较慢。请提出可提高其反应速率且增大NH3生成量的建议:
(4)工业合成氨的热化学方程式为N2(g)+3H2(g)⇌2NH3(g)ΔH=-92.4 kJ/mol。在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:
①该条件下的平衡常数为
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。反应放出的热量
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
真题
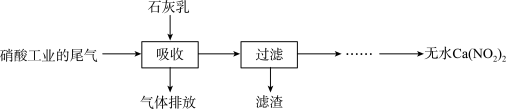
【推荐1】利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如下:
(1)一定条件下,NO 与NO2存在下列反应:NO(g)+NO2(g) N2O3(g),其平衡常数表达式为K =
N2O3(g),其平衡常数表达式为K = _____________ 。
(2)上述工艺中采用气-液逆流接触吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋), 其目的是_____________________ ;滤渣可循环使用,滤渣的主要成分是______________ (填化学式)。
(3)该工艺需控制NO 和NO2物质的量之比接近1 颐1。若n(NO):n(NO2)>1 颐1,则会导致__________________ ;若n(NO):n(NO2)<1 :1,则会导致_________________________ 。
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式为_____________________________________ 。

(1)一定条件下,NO 与NO2存在下列反应:NO(g)+NO2(g)
 N2O3(g),其平衡常数表达式为K =
N2O3(g),其平衡常数表达式为K = (2)上述工艺中采用气-液逆流接触吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋), 其目的是
(3)该工艺需控制NO 和NO2物质的量之比接近1 颐1。若n(NO):n(NO2)>1 颐1,则会导致
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】钛酸钡(BaTiO3)是一种强介电化合物,是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶 瓷工业的支柱”。
Ⅰ、固相合成法是钛酸钡的传统制备方法,典型的工艺是将等物质的量的碳酸钡和二氧化钛混合,在1500℃下反应 24 小时。
(1)写出发生反应的化学方程式:_____ 。
(2)该工艺的优点为工艺简单,不足之处为_____ 。
Ⅱ、工业上还可以 BaCO3、TiCl4为原料,采用草酸盐共沉淀法制备草酸氧钛钡晶体[BaTiO(C2O4)2•4H2O],再高温煅烧制得钛酸钡粉末,其制备工业流程如图所示。
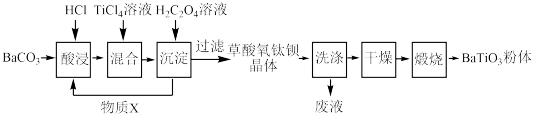
(3)为提高 BaCO3的酸浸率,可采取的措施为_____ (任答一点)。
(4)加入 H2C2O4溶液时,可循环使用的物质 X 是_____ 。
(5)研究表明,钛离子在不同 pH 下可以 TiO(OH)+、TiOC2O4或 TiO(C2O4)2等形式存在(如图),所以在制备草酸氧钛钡晶体时要用到氨水调节混合溶液的 pH. 请结合图示信息分析,混合溶液的最佳 pH 为_____ 左右。
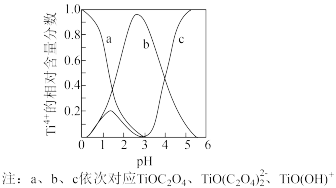
(6)高温煅烧草酸氧钛钡晶体[BaTiO(C2O4)2•4H2O]得到 BaTiO3 的同时,生成高温气体产物有 CO、_____ 和_____ 。成都七中某兴趣小组在实验室里模拟“高温煅烧”操作时所使用的陶瓷仪器有_____ 。
(7)将 TiCl4水解产物加热脱水可生成 TiO2,写出 TiCl4 水解的化学方程式:_____ 。
Ⅰ、固相合成法是钛酸钡的传统制备方法,典型的工艺是将等物质的量的碳酸钡和二氧化钛混合,在1500℃下反应 24 小时。
(1)写出发生反应的化学方程式:
(2)该工艺的优点为工艺简单,不足之处为
Ⅱ、工业上还可以 BaCO3、TiCl4为原料,采用草酸盐共沉淀法制备草酸氧钛钡晶体[BaTiO(C2O4)2•4H2O],再高温煅烧制得钛酸钡粉末,其制备工业流程如图所示。

(3)为提高 BaCO3的酸浸率,可采取的措施为
(4)加入 H2C2O4溶液时,可循环使用的物质 X 是
(5)研究表明,钛离子在不同 pH 下可以 TiO(OH)+、TiOC2O4或 TiO(C2O4)2等形式存在(如图),所以在制备草酸氧钛钡晶体时要用到氨水调节混合溶液的 pH. 请结合图示信息分析,混合溶液的最佳 pH 为

(6)高温煅烧草酸氧钛钡晶体[BaTiO(C2O4)2•4H2O]得到 BaTiO3 的同时,生成高温气体产物有 CO、
(7)将 TiCl4水解产物加热脱水可生成 TiO2,写出 TiCl4 水解的化学方程式:
您最近一年使用:0次
【推荐3】随着农业发展和军工生产的需要,科学家们先后研究并实现了氨的工业生产,今日粮食的产量之高也离不开合成氨工业的发展。除了氨气外,含氮物质在生活中也随处可见。
(1)下列关于NH3性质的解释合理的是______ (单选)。
(2)合成氨工业先驱哈伯(P•Haber)利用N2和H2在Fe催化作用下最早人工合成氨气,请根据表中键能的相关数据,计算合成氨反应的热效应:N2(g)+3H2(g) 2NH3(g) ΔH=
2NH3(g) ΔH=______ kJ•mol-1。
(3)下列关于合成氨工艺的下列理解,正确的是______ (单选)。
(4)尿素(NH2CONH2)又称碳酰胺,是含氮量最高的氮肥,同时也是一种重要的化工产品,有很多用途。工业上利用二氧化碳和氨气在一定条件下合成尿素,涉及的反应如下:
反应Ⅰ:2NH3(g)+CO2(g)=H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272kJ•mol-1
反应Ⅱ:H2NCOONH4(s)=CO(NH2)2(s)+H2O(g) ΔH2=138kJ•mol-1
写出二氧化碳和氨气合成尿素固体和水蒸气的总热化学方程式______ 。
(5)上述反应自发进行的条件是______ (填“低温”、“高温”或“任意条件”)。
(6)化工生产中利用尿素溶液可吸收尾气中的氯气,生成两种气体,一种是空气的主要成分,另一种是温室气体的主要成分,同时溶液pH降低,该反应的化学方程式______ 。
(7)利用NO2与NH3的反应构成电池的方法(产物中一种是无毒气体,且在空气中占比较大),既能实现有效消除氮氧化物的排放,又能提供电能,装置如图所示。
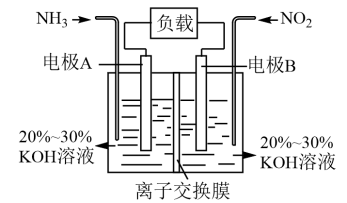
其中A电极的电极反应式为______ 。
(8)下列关于该电池的说法正确的是______ (不定项)。
(1)下列关于NH3性质的解释合理的是
| A.NH3分子中氮原子的杂化方式是sp2,空间构型是平面三角形 |
| B.NH3分子中氮原子的价层电子对数为3 |
| C.8NH3+3Cl2=N2+6NH4Cl中氧化剂与还原剂的物质的量之比为3:2 |
D.氨水中存在NH ,因为NH3•H2O是离子化合物 ,因为NH3•H2O是离子化合物 |
 2NH3(g) ΔH=
2NH3(g) ΔH=| 化学键 | HH | NH | N≡N |
| 键能/( kJ•mol-1) | 436 | 391 | 945 |
| A.当温度、压强一定时,在原料气中添加少量惰性气体,有利于提高平衡转化率 |
| B.增大体系的压强能增大活化分子的百分数,从而加快反应速率 |
| C.合成氨反应选择在高温条件下进行时为了使平衡向正反应方向 |
| D.原料气须经过净化处理,以防止催化剂中毒和安全事故发生 |
反应Ⅰ:2NH3(g)+CO2(g)=H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272kJ•mol-1
反应Ⅱ:H2NCOONH4(s)=CO(NH2)2(s)+H2O(g) ΔH2=138kJ•mol-1
写出二氧化碳和氨气合成尿素固体和水蒸气的总热化学方程式
(5)上述反应自发进行的条件是
(6)化工生产中利用尿素溶液可吸收尾气中的氯气,生成两种气体,一种是空气的主要成分,另一种是温室气体的主要成分,同时溶液pH降低,该反应的化学方程式
(7)利用NO2与NH3的反应构成电池的方法(产物中一种是无毒气体,且在空气中占比较大),既能实现有效消除氮氧化物的排放,又能提供电能,装置如图所示。

其中A电极的电极反应式为
(8)下列关于该电池的说法正确的是
| A.电子从右侧电极经过负载后流向左侧电极 |
| B.为使电池持续放电,离子交换膜需选用阳离子交换膜 |
| C.反应的总方程是6NO2+8NH3=7N2+12H2O |
| D.当有4.48LNO2(标准状况下)被处理时,转移电子物质的量为0.8mol |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】在密闭容器中进行反应:①Fe(s)+CO2(g) FeO(s)+CO(g) ΔH1=a kJ·mol-1反应②2CO(g)+O2(g)
FeO(s)+CO(g) ΔH1=a kJ·mol-1反应②2CO(g)+O2(g) 2CO2(g) △H2=bkJ·mol-1
2CO2(g) △H2=bkJ·mol-1
(1)写出铁块与氧气生成1mol氧化亚铁固体的热化学方程式____ 。
(2)反应①的化学平衡常数表达式K=___ ,已知500℃时反应①的平衡常数K=1.0,在此温度下2L密闭容器中进行反应①,Fe和CO2的起始量均为2.0mol,达到平衡时CO2的转化率为___ ,CO的平衡浓度为____ 。
(3)反应②的逆反应速率与时间的关系如图所示。由图可知,反应在t1、t3时都达到了平衡,而t2、t4时都只改变了一种条件,试判断改变的条件:t2时___ ;t4时____ 。

 FeO(s)+CO(g) ΔH1=a kJ·mol-1反应②2CO(g)+O2(g)
FeO(s)+CO(g) ΔH1=a kJ·mol-1反应②2CO(g)+O2(g) 2CO2(g) △H2=bkJ·mol-1
2CO2(g) △H2=bkJ·mol-1(1)写出铁块与氧气生成1mol氧化亚铁固体的热化学方程式
(2)反应①的化学平衡常数表达式K=
(3)反应②的逆反应速率与时间的关系如图所示。由图可知,反应在t1、t3时都达到了平衡,而t2、t4时都只改变了一种条件,试判断改变的条件:t2时

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI酸性溶液中进行模拟研究。
(1)O3将I-氧化成I2的过程可发生如下反应:
②IO-(aq)+H+(aq) HOI(aq)
HOI(aq) 
③HOI(aq)+I-(aq)+H+(aq) I2(aq)+H2O(l)
I2(aq)+H2O(l) 
写出O3将I-氧化的总反应的热化学方程式为:____________ 。
(2)在溶液中存在化学平衡I2(aq)+I-(aq) I3-(aq),在反应的整个过程中I3-物质的量浓度变化情况是
I3-(aq),在反应的整个过程中I3-物质的量浓度变化情况是_______ 。
(3)为探究温度对I2(aq)+I-(aq) I3-(aq)
I3-(aq) 反应的影响。在某温度T1下,将NaI酸性溶液置于密闭容器中,并充入一定量的O3(g)(O3气体不足,不考虑生成物O2与I-反应反应)。在t时刻,测得容器中I2(g)的浓度,然后分别在温度为T2、T3、T4、T5下,保证其他初始实验条件不变,重复上述实验,经过相同时间测得I2(g)的浓度。得到趋势图(如下图一所示)
反应的影响。在某温度T1下,将NaI酸性溶液置于密闭容器中,并充入一定量的O3(g)(O3气体不足,不考虑生成物O2与I-反应反应)。在t时刻,测得容器中I2(g)的浓度,然后分别在温度为T2、T3、T4、T5下,保证其他初始实验条件不变,重复上述实验,经过相同时间测得I2(g)的浓度。得到趋势图(如下图一所示)

①若在T3时,容器中无O3,T4~T5温度区间容器内I2(g)浓度呈现如图一所示的变化趋势。则
______ 0(填“>0”、“=”或“<”);该条件下在温度T4时,将一定量的I2投入0.20
 溶液中充分反应,测得I-浓度变化如图二所示。在t2时刻,将该反应体系温度从T4上升到T5,并维持该温度。请在图二中画出t2时刻后溶液中I-浓度变化总趋势曲线
溶液中充分反应,测得I-浓度变化如图二所示。在t2时刻,将该反应体系温度从T4上升到T5,并维持该温度。请在图二中画出t2时刻后溶液中I-浓度变化总趋势曲线______ 。
②由I2(aq)+I-(aq) I3-(aq),在水溶液中难以准确测定I2的浓度。本实验将一定量的I2投入0.20
I3-(aq),在水溶液中难以准确测定I2的浓度。本实验将一定量的I2投入0.20
 溶液中充分反应,并在溶液中加入一定量的CCl4充分萃取后,测出CCl4中I2的浓度为0.11
溶液中充分反应,并在溶液中加入一定量的CCl4充分萃取后,测出CCl4中I2的浓度为0.11 ,此时溶液中I-为0.10
,此时溶液中I-为0.10 。查阅资料可知,在一定温度下,发生萃取后I2在CCl4中的浓度与I2在水中的浓度之比为一常数
。查阅资料可知,在一定温度下,发生萃取后I2在CCl4中的浓度与I2在水中的浓度之比为一常数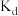 (已知
(已知 时,
时,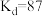 )。根据上述实验相关数据,计算温度为
)。根据上述实验相关数据,计算温度为 时,I2(aq)+I-(aq)
时,I2(aq)+I-(aq)  I3-(aq)反应的平衡常数K的值为
I3-(aq)反应的平衡常数K的值为___________ 。
③已知该反应中υ正=k正·c(I2)·c(I-),υ逆=k逆·c(I3-),其中 、
、 均为速率常数,则
均为速率常数,则 为
为________________ 。(以K和 表示)。
表示)。
(4)优质的锂电池可用于心脏起搏器延续患者的生命。它的正极材料是聚2-乙烯吡啶(简写为P2VP)和I2的复合物,电解质是固态薄膜状碘化锂。总反应为: P2VP·nI2+2Li=P2VP·(n-1)I2+2LiI。该电池的正极反应式为________ 。
(1)O3将I-氧化成I2的过程可发生如下反应:
①I-(aq)+O3(g)=IO-(aq)+O2(g) 
②IO-(aq)+H+(aq)
 HOI(aq)
HOI(aq) 
③HOI(aq)+I-(aq)+H+(aq)
 I2(aq)+H2O(l)
I2(aq)+H2O(l) 
写出O3将I-氧化的总反应的热化学方程式为:
(2)在溶液中存在化学平衡I2(aq)+I-(aq)
 I3-(aq),在反应的整个过程中I3-物质的量浓度变化情况是
I3-(aq),在反应的整个过程中I3-物质的量浓度变化情况是(3)为探究温度对I2(aq)+I-(aq)
 I3-(aq)
I3-(aq) 反应的影响。在某温度T1下,将NaI酸性溶液置于密闭容器中,并充入一定量的O3(g)(O3气体不足,不考虑生成物O2与I-反应反应)。在t时刻,测得容器中I2(g)的浓度,然后分别在温度为T2、T3、T4、T5下,保证其他初始实验条件不变,重复上述实验,经过相同时间测得I2(g)的浓度。得到趋势图(如下图一所示)
反应的影响。在某温度T1下,将NaI酸性溶液置于密闭容器中,并充入一定量的O3(g)(O3气体不足,不考虑生成物O2与I-反应反应)。在t时刻,测得容器中I2(g)的浓度,然后分别在温度为T2、T3、T4、T5下,保证其他初始实验条件不变,重复上述实验,经过相同时间测得I2(g)的浓度。得到趋势图(如下图一所示)
①若在T3时,容器中无O3,T4~T5温度区间容器内I2(g)浓度呈现如图一所示的变化趋势。则


 溶液中充分反应,测得I-浓度变化如图二所示。在t2时刻,将该反应体系温度从T4上升到T5,并维持该温度。请在图二中画出t2时刻后溶液中I-浓度变化总趋势曲线
溶液中充分反应,测得I-浓度变化如图二所示。在t2时刻,将该反应体系温度从T4上升到T5,并维持该温度。请在图二中画出t2时刻后溶液中I-浓度变化总趋势曲线②由I2(aq)+I-(aq)
 I3-(aq),在水溶液中难以准确测定I2的浓度。本实验将一定量的I2投入0.20
I3-(aq),在水溶液中难以准确测定I2的浓度。本实验将一定量的I2投入0.20
 溶液中充分反应,并在溶液中加入一定量的CCl4充分萃取后,测出CCl4中I2的浓度为0.11
溶液中充分反应,并在溶液中加入一定量的CCl4充分萃取后,测出CCl4中I2的浓度为0.11 ,此时溶液中I-为0.10
,此时溶液中I-为0.10 。查阅资料可知,在一定温度下,发生萃取后I2在CCl4中的浓度与I2在水中的浓度之比为一常数
。查阅资料可知,在一定温度下,发生萃取后I2在CCl4中的浓度与I2在水中的浓度之比为一常数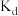 (已知
(已知 时,
时,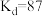 )。根据上述实验相关数据,计算温度为
)。根据上述实验相关数据,计算温度为 时,I2(aq)+I-(aq)
时,I2(aq)+I-(aq)  I3-(aq)反应的平衡常数K的值为
I3-(aq)反应的平衡常数K的值为③已知该反应中υ正=k正·c(I2)·c(I-),υ逆=k逆·c(I3-),其中
 、
、 均为速率常数,则
均为速率常数,则 为
为 表示)。
表示)。(4)优质的锂电池可用于心脏起搏器延续患者的生命。它的正极材料是聚2-乙烯吡啶(简写为P2VP)和I2的复合物,电解质是固态薄膜状碘化锂。总反应为: P2VP·nI2+2Li=P2VP·(n-1)I2+2LiI。该电池的正极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】研究氮、碳及其化合物的资源化利用具有重要的意义。
(1)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示。由图可知合成氨反应 的
的
___________ kJ⋅mol-1,反应速率最慢的步骤的化学方程式为___________ 。

(2)若将2.0mol 和6.0mol
和6.0mol 通入体积为1L的密闭容器中,分别在
通入体积为1L的密闭容器中,分别在 和
和 温度下进行反应。曲线A表示
温度下进行反应。曲线A表示 温度下
温度下 的变化,曲线B表示
的变化,曲线B表示 温度下
温度下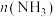 的变化,
的变化, 温度下反应到a点恰好达到平衡。
温度下反应到a点恰好达到平衡。

①温度
___________ (填“>”、“<”或“=”,下同) 。
。 温度下恰好平衡时,曲线B上的点为
温度下恰好平衡时,曲线B上的点为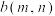 ,则m
,则m___________ 12,n___________ 3。
② 温度下,若某时刻容器内气体的压强为起始时的80%,则此时
温度下,若某时刻容器内气体的压强为起始时的80%,则此时
___________ (填“>”、“<”或“=”)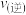 。
。
(3)以焦炭为原料,在高温下与水蒸气反应可制得水煤气,涉及反应如下:
I.
 kJ⋅mol-1
kJ⋅mol-1 
Ⅱ.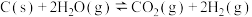
 kJ⋅mol-1
kJ⋅mol-1 
Ⅲ.
 kJ⋅mol-1
kJ⋅mol-1 
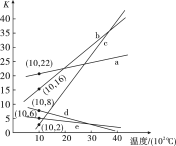
三个反应的平衡常数随温度变化的关系如图所示,则表示 、
、 、
、 的曲线分别是(填字母)
的曲线分别是(填字母)___________ 、___________ 、___________ 。
(4) 在Cu-ZnO催化下,同时发生反应①、②,是解决温室效应和能源短缺的重要手段。
在Cu-ZnO催化下,同时发生反应①、②,是解决温室效应和能源短缺的重要手段。
①
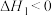
②

在容积不变的密闭容器中,保持温度不变,充入一定量的 和
和 ,起始及达平衡时,容器内各气体的物质的量及总压强如下表所示:
,起始及达平衡时,容器内各气体的物质的量及总压强如下表所示:
若容器内反应①、②均达到平衡时,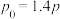 ,反应①的平衡常数
,反应①的平衡常数
___________ 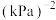 。(用含p的式子表示)
。(用含p的式子表示)
(1)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示。由图可知合成氨反应
 的
的

(2)若将2.0mol
 和6.0mol
和6.0mol 通入体积为1L的密闭容器中,分别在
通入体积为1L的密闭容器中,分别在 和
和 温度下进行反应。曲线A表示
温度下进行反应。曲线A表示 温度下
温度下 的变化,曲线B表示
的变化,曲线B表示 温度下
温度下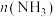 的变化,
的变化, 温度下反应到a点恰好达到平衡。
温度下反应到a点恰好达到平衡。
①温度

 。
。 温度下恰好平衡时,曲线B上的点为
温度下恰好平衡时,曲线B上的点为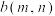 ,则m
,则m②
 温度下,若某时刻容器内气体的压强为起始时的80%,则此时
温度下,若某时刻容器内气体的压强为起始时的80%,则此时
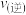 。
。(3)以焦炭为原料,在高温下与水蒸气反应可制得水煤气,涉及反应如下:
I.

 kJ⋅mol-1
kJ⋅mol-1 
Ⅱ.
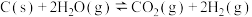
 kJ⋅mol-1
kJ⋅mol-1 
Ⅲ.

 kJ⋅mol-1
kJ⋅mol-1 
三个反应的平衡常数随温度变化的关系如图所示,则表示
 、
、 、
、 的曲线分别是(填字母)
的曲线分别是(填字母)
(4)
 在Cu-ZnO催化下,同时发生反应①、②,是解决温室效应和能源短缺的重要手段。
在Cu-ZnO催化下,同时发生反应①、②,是解决温室效应和能源短缺的重要手段。①

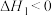
②


在容积不变的密闭容器中,保持温度不变,充入一定量的
 和
和 ,起始及达平衡时,容器内各气体的物质的量及总压强如下表所示:
,起始及达平衡时,容器内各气体的物质的量及总压强如下表所示: |  |  | CO |  | 总压强/kPa | |
| 起始/mol | 0.5 | 0.9 | 0 | 0 | 0 |  |
| 平衡/mol | n | 0.3 | p |
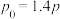 ,反应①的平衡常数
,反应①的平衡常数
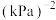 。(用含p的式子表示)
。(用含p的式子表示)
您最近一年使用:0次



