随着农业发展和军工生产的需要,科学家们先后研究并实现了氨的工业生产,今日粮食的产量之高也离不开合成氨工业的发展。除了氨气外,含氮物质在生活中也随处可见。
(1)下列关于NH3性质的解释合理的是______ (单选)。
(2)合成氨工业先驱哈伯(P•Haber)利用N2和H2在Fe催化作用下最早人工合成氨气,请根据表中键能的相关数据,计算合成氨反应的热效应:N2(g)+3H2(g) 2NH3(g) ΔH=
2NH3(g) ΔH=______ kJ•mol-1。
(3)下列关于合成氨工艺的下列理解,正确的是______ (单选)。
(4)尿素(NH2CONH2)又称碳酰胺,是含氮量最高的氮肥,同时也是一种重要的化工产品,有很多用途。工业上利用二氧化碳和氨气在一定条件下合成尿素,涉及的反应如下:
反应Ⅰ:2NH3(g)+CO2(g)=H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272kJ•mol-1
反应Ⅱ:H2NCOONH4(s)=CO(NH2)2(s)+H2O(g) ΔH2=138kJ•mol-1
写出二氧化碳和氨气合成尿素固体和水蒸气的总热化学方程式______ 。
(5)上述反应自发进行的条件是______ (填“低温”、“高温”或“任意条件”)。
(6)化工生产中利用尿素溶液可吸收尾气中的氯气,生成两种气体,一种是空气的主要成分,另一种是温室气体的主要成分,同时溶液pH降低,该反应的化学方程式______ 。
(7)利用NO2与NH3的反应构成电池的方法(产物中一种是无毒气体,且在空气中占比较大),既能实现有效消除氮氧化物的排放,又能提供电能,装置如图所示。
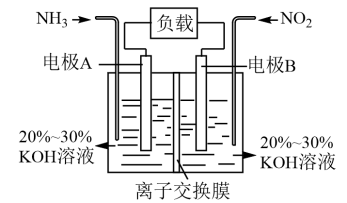
其中A电极的电极反应式为______ 。
(8)下列关于该电池的说法正确的是______ (不定项)。
(1)下列关于NH3性质的解释合理的是
| A.NH3分子中氮原子的杂化方式是sp2,空间构型是平面三角形 |
| B.NH3分子中氮原子的价层电子对数为3 |
| C.8NH3+3Cl2=N2+6NH4Cl中氧化剂与还原剂的物质的量之比为3:2 |
D.氨水中存在NH ,因为NH3•H2O是离子化合物 ,因为NH3•H2O是离子化合物 |
 2NH3(g) ΔH=
2NH3(g) ΔH=| 化学键 | HH | NH | N≡N |
| 键能/( kJ•mol-1) | 436 | 391 | 945 |
| A.当温度、压强一定时,在原料气中添加少量惰性气体,有利于提高平衡转化率 |
| B.增大体系的压强能增大活化分子的百分数,从而加快反应速率 |
| C.合成氨反应选择在高温条件下进行时为了使平衡向正反应方向 |
| D.原料气须经过净化处理,以防止催化剂中毒和安全事故发生 |
反应Ⅰ:2NH3(g)+CO2(g)=H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272kJ•mol-1
反应Ⅱ:H2NCOONH4(s)=CO(NH2)2(s)+H2O(g) ΔH2=138kJ•mol-1
写出二氧化碳和氨气合成尿素固体和水蒸气的总热化学方程式
(5)上述反应自发进行的条件是
(6)化工生产中利用尿素溶液可吸收尾气中的氯气,生成两种气体,一种是空气的主要成分,另一种是温室气体的主要成分,同时溶液pH降低,该反应的化学方程式
(7)利用NO2与NH3的反应构成电池的方法(产物中一种是无毒气体,且在空气中占比较大),既能实现有效消除氮氧化物的排放,又能提供电能,装置如图所示。

其中A电极的电极反应式为
(8)下列关于该电池的说法正确的是
| A.电子从右侧电极经过负载后流向左侧电极 |
| B.为使电池持续放电,离子交换膜需选用阳离子交换膜 |
| C.反应的总方程是6NO2+8NH3=7N2+12H2O |
| D.当有4.48LNO2(标准状况下)被处理时,转移电子物质的量为0.8mol |
更新时间:2023/04/20 12:24:43
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】甲醇常利用煤气化过程中生成的CO和H2来制备:CO(g)+2H2(g)  CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:
(1)关于该反应的下列说法中,正确的是_______ (填字母);
A ,
, B.
B. ,
, C.
C. ,
, D.
D. ,
,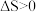
(2)恒容条件下,达到平衡后,下列措施中能使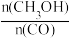 增大的有
增大的有______ 。
A.降低温度 B.充入 气 C.再冲入
气 C.再冲入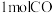 和
和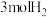 D.使用催化剂
D.使用催化剂
(3)若在一体积可变的密闭容器中充入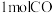 、
、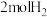 和小
和小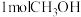 ,达到平衡时测的混合气体的密度是同温同压下起始的1.6倍(三种物质均处于气态),则平衡时混合气体的平均摩尔质量=
,达到平衡时测的混合气体的密度是同温同压下起始的1.6倍(三种物质均处于气态),则平衡时混合气体的平均摩尔质量=_______ 
(4)根据图示,写出此反应的热化学方程式______________________________ .
 CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:
(1)关于该反应的下列说法中,正确的是
A
 ,
, B.
B. ,
, C.
C. ,
, D.
D. ,
,
(2)恒容条件下,达到平衡后,下列措施中能使
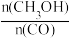 增大的有
增大的有A.降低温度 B.充入
 气 C.再冲入
气 C.再冲入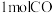 和
和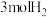 D.使用催化剂
D.使用催化剂(3)若在一体积可变的密闭容器中充入
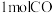 、
、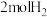 和小
和小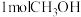 ,达到平衡时测的混合气体的密度是同温同压下起始的1.6倍(三种物质均处于气态),则平衡时混合气体的平均摩尔质量=
,达到平衡时测的混合气体的密度是同温同压下起始的1.6倍(三种物质均处于气态),则平衡时混合气体的平均摩尔质量=
(4)根据图示,写出此反应的热化学方程式
您最近一年使用:0次
【推荐2】硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g)+ O2(g)
O2(g) SO3(g) △H=-98 kJ·mol-1。
SO3(g) △H=-98 kJ·mol-1。
回答下列问题:
(1)已知液态二氧化硫可以发生类似于水自身电离:2SO2(l) SO2++SO
SO2++SO 。SO2+中的σ键和π键数目之比为
。SO2+中的σ键和π键数目之比为__________ 。
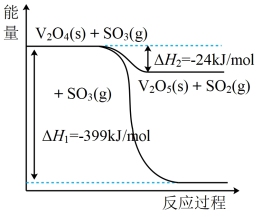
(1)钒催化剂参与反应的能量变化如图所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为________ 。
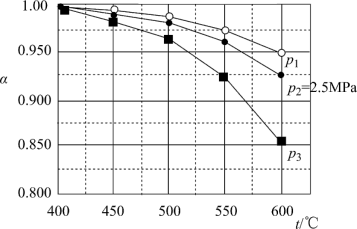
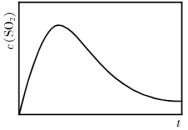
(3)当SO2(g)、O2(g)和N2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5 MPa、2.5 MPa和5.0 MPa压强下,SO2平衡转化率α随温度的变化如图所示。反应在5.0MPa、550℃时的α=__________ 。
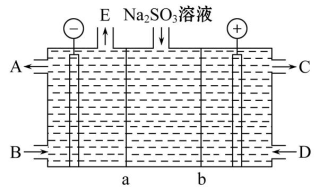
(4)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3进行电解生产硫酸,其中阴、阳膜组合电解装置如图所示,电极材料为石墨。A~E分别代表生产中的原料或产品,b表示_____ (填“阴”或“阳”)离子交换膜。阳极的电极反应式为_________ 。
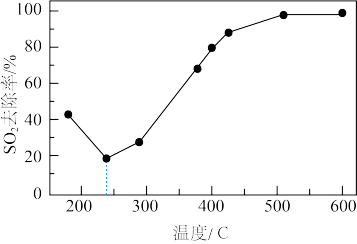
(5)研究在一定条件下,CO可以去除烟气中的SO2,其反应原理如下: 2CO+SO2=2CO2+S其他条件相同,以γ-Al2O3(一种多孔性物质,每克的内表面积高达数百平方米,具有良好的吸附性能)作为催化剂,研究表明,γ-Al2O3在240℃以上发挥催化作用。反应相同的时间,SO2的去除率随反应温度的变化如图所示。240℃以前,随着温度的升高,SO2去除率降低的原因是_____ 。240℃以后,随着温度的升高,SO2去除率迅速增大的主要原因是__________ 。
 O2(g)
O2(g) SO3(g) △H=-98 kJ·mol-1。
SO3(g) △H=-98 kJ·mol-1。回答下列问题:
(1)已知液态二氧化硫可以发生类似于水自身电离:2SO2(l)
 SO2++SO
SO2++SO 。SO2+中的σ键和π键数目之比为
。SO2+中的σ键和π键数目之比为(1)钒催化剂参与反应的能量变化如图所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为

(3)当SO2(g)、O2(g)和N2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5 MPa、2.5 MPa和5.0 MPa压强下,SO2平衡转化率α随温度的变化如图所示。反应在5.0MPa、550℃时的α=

(4)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3进行电解生产硫酸,其中阴、阳膜组合电解装置如图所示,电极材料为石墨。A~E分别代表生产中的原料或产品,b表示

(5)研究在一定条件下,CO可以去除烟气中的SO2,其反应原理如下: 2CO+SO2=2CO2+S其他条件相同,以γ-Al2O3(一种多孔性物质,每克的内表面积高达数百平方米,具有良好的吸附性能)作为催化剂,研究表明,γ-Al2O3在240℃以上发挥催化作用。反应相同的时间,SO2的去除率随反应温度的变化如图所示。240℃以前,随着温度的升高,SO2去除率降低的原因是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) + 2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ: CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
由表中数据判断ΔH1____ 0 (填“>”、“=”或“<”)。
② 某温度下,将2mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为___________ ,此时的温度为_______ (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(l) ΔH1=-1451.6kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2 =-566.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_________________________________________
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置:

①该电池的能量转化形式为___________________________ 。
②工作一段时间后,测得溶液的pH减小。请写出该电池的负极的电极反应式。_____________________________
③用该电池电解(惰性电极)500mL某CuSO4溶液,电解一段时间后,为使电解质溶液恢复到原状态,需要向溶液中加入9.8g Cu(OH)2固体。则原CuSO4溶液的物质的量浓度为___________ mol/L(假设电解前后溶液体积不变)。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) + 2H2(g)
 CH3OH(g) ΔH1
CH3OH(g) ΔH1反应Ⅱ: CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2①下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
② 某温度下,将2mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(l) ΔH1=-1451.6kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2 =-566.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置:

①该电池的能量转化形式为
②工作一段时间后,测得溶液的pH减小。请写出该电池的负极的电极反应式。
③用该电池电解(惰性电极)500mL某CuSO4溶液,电解一段时间后,为使电解质溶液恢复到原状态,需要向溶液中加入9.8g Cu(OH)2固体。则原CuSO4溶液的物质的量浓度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】硫酸在国民经济中占有极其重要的地位,工业上常以黄铁矿为原料用接触法制硫酸。
(1)接触室中发生的反应:
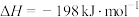 。
。
①若测得2h后 的浓度为0.6
的浓度为0.6 ,此时间内
,此时间内 的消耗速率为0.2
的消耗速率为0.2 ,则开始时
,则开始时 的浓度为
的浓度为_________  。
。
②将0.050mol (g)和0.030mol
(g)和0.030mol  (g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测
(g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测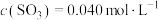 。计算该条件下反应的平衡常数K=
。计算该条件下反应的平衡常数K=_________ , 的平衡转化率为
的平衡转化率为_________ 。
③ 可作为该反应的催化剂,其过程如图。c步的化学方程式可表示为
可作为该反应的催化剂,其过程如图。c步的化学方程式可表示为_________ 。
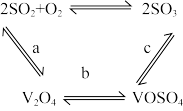
(2)硫酸的生产中,下列说法不正确的是_________(填字母)。
(3)为减少 的排放,工业上将
的排放,工业上将 转化为
转化为 固定,但存在C0会同时发生以下两个反应:
固定,但存在C0会同时发生以下两个反应:
恒容、恒温( )条件下,反应体系中
)条件下,反应体系中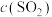 随时间t变化的总趋势如图。结合已知信息分析
随时间t变化的总趋势如图。结合已知信息分析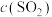 随时间t变化的原因:
随时间t变化的原因:_________ 。
(1)接触室中发生的反应:
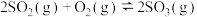
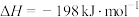 。
。①若测得2h后
 的浓度为0.6
的浓度为0.6 ,此时间内
,此时间内 的消耗速率为0.2
的消耗速率为0.2 ,则开始时
,则开始时 的浓度为
的浓度为 。
。②将0.050mol
 (g)和0.030mol
(g)和0.030mol  (g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测
(g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测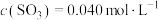 。计算该条件下反应的平衡常数K=
。计算该条件下反应的平衡常数K= 的平衡转化率为
的平衡转化率为③
 可作为该反应的催化剂,其过程如图。c步的化学方程式可表示为
可作为该反应的催化剂,其过程如图。c步的化学方程式可表示为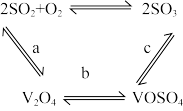
(2)硫酸的生产中,下列说法不正确的是_________(填字母)。
| A.把黄铁矿磨成细粉末在“沸腾”状态下燃烧,可以提高反应速率和原料的利用率 |
| B.气体在进接触室前要先净化,可防止催化剂中毒 |
| C.接触室中反应温度采用400~500℃,主要是为了提高原料的平衡转化率 |
D.吸收塔中操作采取逆流的形式, 从下而上,水从上而下 从下而上,水从上而下 |
 的排放,工业上将
的排放,工业上将 转化为
转化为 固定,但存在C0会同时发生以下两个反应:
固定,但存在C0会同时发生以下两个反应:| 反应 | 活化能 | 平衡常数 | |
| Ⅰ |  | 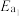 | 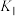 |
| Ⅱ |  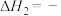 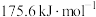 | 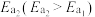 | 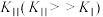 |
恒容、恒温(
 )条件下,反应体系中
)条件下,反应体系中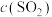 随时间t变化的总趋势如图。结合已知信息分析
随时间t变化的总趋势如图。结合已知信息分析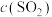 随时间t变化的原因:
随时间t变化的原因:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】氨是一种重要的基础化工产品。
(1)合成氨的原料气(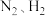 及少量
及少量 的混合气)在进入合成塔前需除去
的混合气)在进入合成塔前需除去 ,原因是
,原因是___________ 。
原料气中的 常用甲烷水蒸气重整反应制备,涉及的主要反应如下:
常用甲烷水蒸气重整反应制备,涉及的主要反应如下:
反应Ⅰ: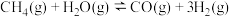
反应Ⅱ: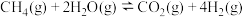
反应Ⅲ: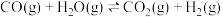
一定条件下,向体积为V的恒容容器中充入 甲烷和
甲烷和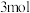 水蒸气,达到平衡时,甲烷和水蒸气的转化率分别是80%和40%,则
水蒸气,达到平衡时,甲烷和水蒸气的转化率分别是80%和40%,则 的物质的量为
的物质的量为________  ,写出反应Ⅲ的平衡常数
,写出反应Ⅲ的平衡常数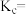
___________ 。
(2) 与
与 作用分别生成
作用分别生成 的反应均为放热反应。工业尾气中的
的反应均为放热反应。工业尾气中的 可通过催化氧化为
可通过催化氧化为 除去。将一定比例的
除去。将一定比例的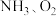 和
和 的混合气体以一定流速经过装有催化剂的反应管,
的混合气体以一定流速经过装有催化剂的反应管, 的转化率、
的转化率、 的选择性[
的选择性[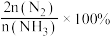 ]与温度的关系如图。
]与温度的关系如图。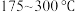 范围内升高温度,出口处氮氧化物的量
范围内升高温度,出口处氮氧化物的量________ (填“增大”或“减小), 的平衡转化率
的平衡转化率________ (填“增大”或“减小”)。
②为能更有效除去尾气中的 ,保护环境,应选择的最佳温度为
,保护环境,应选择的最佳温度为________ (填序号)。
A. B.
B. C.
C.
(3)氨气也可与氨的氧化物反应生成氮气,该反应可用于处理氮的氧化物。例如: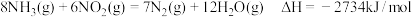 ,将
,将 和
和 以一定的流速,分别通过甲、乙两种催化剂发生上述反应,相同时间内测量逸出气体中
以一定的流速,分别通过甲、乙两种催化剂发生上述反应,相同时间内测量逸出气体中 含量,从而确定
含量,从而确定 的转化率,结果如图所示:
的转化率,结果如图所示:___________ (填“是”或“不是”)平衡状态,原因是___________ 。
(1)合成氨的原料气(
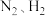 及少量
及少量 的混合气)在进入合成塔前需除去
的混合气)在进入合成塔前需除去 ,原因是
,原因是原料气中的
 常用甲烷水蒸气重整反应制备,涉及的主要反应如下:
常用甲烷水蒸气重整反应制备,涉及的主要反应如下:反应Ⅰ:
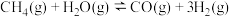
反应Ⅱ:
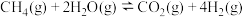
反应Ⅲ:
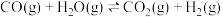
一定条件下,向体积为V的恒容容器中充入
 甲烷和
甲烷和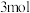 水蒸气,达到平衡时,甲烷和水蒸气的转化率分别是80%和40%,则
水蒸气,达到平衡时,甲烷和水蒸气的转化率分别是80%和40%,则 的物质的量为
的物质的量为 ,写出反应Ⅲ的平衡常数
,写出反应Ⅲ的平衡常数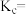
(2)
 与
与 作用分别生成
作用分别生成 的反应均为放热反应。工业尾气中的
的反应均为放热反应。工业尾气中的 可通过催化氧化为
可通过催化氧化为 除去。将一定比例的
除去。将一定比例的 和
和 的混合气体以一定流速经过装有催化剂的反应管,
的混合气体以一定流速经过装有催化剂的反应管, 的转化率、
的转化率、 的选择性[
的选择性[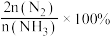 ]与温度的关系如图。
]与温度的关系如图。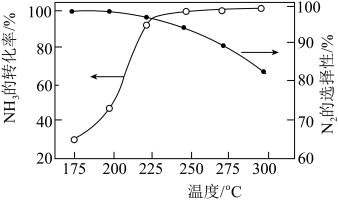
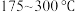 范围内升高温度,出口处氮氧化物的量
范围内升高温度,出口处氮氧化物的量 的平衡转化率
的平衡转化率②为能更有效除去尾气中的
 ,保护环境,应选择的最佳温度为
,保护环境,应选择的最佳温度为A.
 B.
B. C.
C.
(3)氨气也可与氨的氧化物反应生成氮气,该反应可用于处理氮的氧化物。例如:
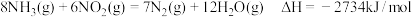 ,将
,将 和
和 以一定的流速,分别通过甲、乙两种催化剂发生上述反应,相同时间内测量逸出气体中
以一定的流速,分别通过甲、乙两种催化剂发生上述反应,相同时间内测量逸出气体中 含量,从而确定
含量,从而确定 的转化率,结果如图所示:
的转化率,结果如图所示: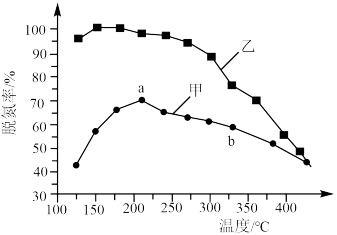
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】钢铁工业在我国国民经济中处于十分重要的位置,工业上采用高炉冶炼,常用赤铁矿、焦炭、空气和熔剂(石灰石)作原料。已知赤铁矿被还原剂还原时是逐级进行的,还原时温度及CO、CO2平衡混合气体中CO的体积分数的关系如下图:
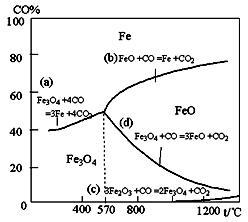
(1)铁在元素周期表中位于________ 周期____ 族
(2)在温度低于570℃时,还原分两阶段完成,在温度高于570℃时,依次发生的还原反应有:_______________ (选用右图中的a、b、c、d填空)
(3)为减少高炉冶铁时,含CO的尾气排放,下列研究方向不可取的是__________ 。
(a)其它条件不变,增加高炉的高度
(b)调节还原时的炉温
(c)增加原料中焦炭与赤铁矿的比例
(d)将生成的铁水及时移出
(4)已知下列反应数值:
反应④△H4=________________________ kJ·mol-1。
(5)1100℃时, FeO(s)+CO(g) Fe(s)+CO2(g),平衡常数K=0.4。今在一密闭容器中,加入7.2gFeO,同时通入4.48LCO(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为:
Fe(s)+CO2(g),平衡常数K=0.4。今在一密闭容器中,加入7.2gFeO,同时通入4.48LCO(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为:_______________ 。

(1)铁在元素周期表中位于
(2)在温度低于570℃时,还原分两阶段完成,在温度高于570℃时,依次发生的还原反应有:
(3)为减少高炉冶铁时,含CO的尾气排放,下列研究方向不可取的是
(a)其它条件不变,增加高炉的高度
(b)调节还原时的炉温
(c)增加原料中焦炭与赤铁矿的比例
(d)将生成的铁水及时移出
(4)已知下列反应数值:
| 反应序号 | 化学反应 | 反应热 |
| ① | Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) | △H1= -26.7kJ·mol-1 |
| ② | 3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) | △H2= -50.8kJ·mol-1 |
| ③ | Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) | △H3= -36.5kJ·mol-1 |
| ④ | FeO(s)+CO(g)=Fe(s)+CO2(g) | △H4 |
反应④△H4=
(5)1100℃时, FeO(s)+CO(g)
 Fe(s)+CO2(g),平衡常数K=0.4。今在一密闭容器中,加入7.2gFeO,同时通入4.48LCO(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为:
Fe(s)+CO2(g),平衡常数K=0.4。今在一密闭容器中,加入7.2gFeO,同时通入4.48LCO(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】CO、H2是重要的工业原料,在高温、催化剂存在的条件下,可用甲烷 和水蒸气为原料制取它:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH0
CO(g)+3H2(g) ΔH0
(1)已知:
① 2H2(g)+O2(g)=2H2O(g) ΔH1=-484kJ·mol-1
② CH4(g)+1.5O2(g)=CO(g)+2H2O(g) ΔH2=-564kJ·mol-1。
则ΔH0 =_____ 。
(2)一定温度下,将一定量甲烷与水蒸气的混合气体置于某密闭容器中发生反应 生成 CO、H2,测得反应体系中平衡时的某种量值 X 与温度(T)、压强(P)之间的关系如图 所示:
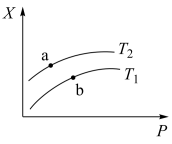
若 X 表示 CH4的百分含量,则 T1_________ T2(填“>”“<”“无法确定”,下同),X 还可 以表示_____ (在下列选项中选填序号),a、b 两点的平衡常数 K(a) ____ K(b)。
A.混合气体的平均摩尔质量 B.CO 的产率 C.ΔH 值
(3)若在 T3时将 4mol H2O(g)与 a mol CH4置于 2L 恒容密闭容器中,测得 CO 的 浓度(mol/L)与时间 t(min)的关系如图 所示。
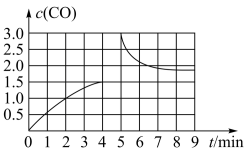
①反应 4min 后达平衡, 反应 4min 内用 H2浓度变化表示的反应速率 v(H2)=__________________
②若在第 5 分钟时改变条件,CO 浓度变化曲线如图 所示,则改变条件可能是____________
(4)从焓变角度上看,反应 CO2(g)+H2O(g)=CO(g)+H2(g)+O2(g)_____ (填“具 有”或“不具有”)自发性。
 CO(g)+3H2(g) ΔH0
CO(g)+3H2(g) ΔH0(1)已知:
① 2H2(g)+O2(g)=2H2O(g) ΔH1=-484kJ·mol-1
② CH4(g)+1.5O2(g)=CO(g)+2H2O(g) ΔH2=-564kJ·mol-1。
则ΔH0 =
(2)一定温度下,将一定量甲烷与水蒸气的混合气体置于某密闭容器中发生反应 生成 CO、H2,测得反应体系中平衡时的某种量值 X 与温度(T)、压强(P)之间的关系如图 所示:

若 X 表示 CH4的百分含量,则 T1
A.混合气体的平均摩尔质量 B.CO 的产率 C.ΔH 值
(3)若在 T3时将 4mol H2O(g)与 a mol CH4置于 2L 恒容密闭容器中,测得 CO 的 浓度(mol/L)与时间 t(min)的关系如图 所示。

①反应 4min 后达平衡, 反应 4min 内用 H2浓度变化表示的反应速率 v(H2)=
②若在第 5 分钟时改变条件,CO 浓度变化曲线如图 所示,则改变条件可能是
(4)从焓变角度上看,反应 CO2(g)+H2O(g)=CO(g)+H2(g)+O2(g)
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】钛是世界上具有战略意义的金属,被称为“第三金属”,其产品被应用于航空航天领域。工业上用钛铁矿【主要成分FeTiO3(含Fe2O3杂质)】经过处理,得到钛白粉(TiO2),进一步制备金属钛。
Ⅰ.酸浸法:(工艺流程如下)

(1)混合液中除H+、TiO2+之外,还存在的阳离子有____________ 。
(2)加入过量铁粉,发生反应的离子方程式为___________________ 。
(3)从钛白粉生产TiCl4的反应为:TiO2(s)+2Cl2=TiCl4(l)+O2(g) △H=+161.9kJ/mol,该反应在高温下_____ (填“能”或“不能”)自发进行。理由是:________________ 。
(4)酸浸过程中,在不同温度下,Ti元素的浸出率如图所示。请用化学原理解释温度超过80℃后,浸出率下降的原因________________ 。(浸出率指固体中某元素溶解于液体溶剂中的比例。)

Ⅱ.氯化法:工艺流程如下:
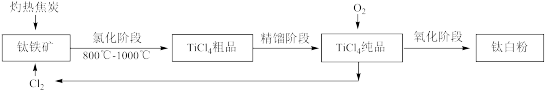
氯化阶段用氯气分解钛原料,使钛化合物转变为四氯化钛,反应方程式为:2FeTiO3+6C+7Cl2 2FeCl3+2TiCl4+6CO,再冷却至136℃,精馏提纯,升温氧化(1300℃,氧化阶段产生的Cl2可以循环利用),得到钛白粉。
2FeCl3+2TiCl4+6CO,再冷却至136℃,精馏提纯,升温氧化(1300℃,氧化阶段产生的Cl2可以循环利用),得到钛白粉。
(5)用此方法生产160t纯TiO2,理论上需要消耗Cl2_______ t。【已知:M(TiO2)=80g/mol;M(Cl2)=71g/mol】
Ⅰ.酸浸法:(工艺流程如下)

(1)混合液中除H+、TiO2+之外,还存在的阳离子有
(2)加入过量铁粉,发生反应的离子方程式为
(3)从钛白粉生产TiCl4的反应为:TiO2(s)+2Cl2=TiCl4(l)+O2(g) △H=+161.9kJ/mol,该反应在高温下
(4)酸浸过程中,在不同温度下,Ti元素的浸出率如图所示。请用化学原理解释温度超过80℃后,浸出率下降的原因

Ⅱ.氯化法:工艺流程如下:

氯化阶段用氯气分解钛原料,使钛化合物转变为四氯化钛,反应方程式为:2FeTiO3+6C+7Cl2
 2FeCl3+2TiCl4+6CO,再冷却至136℃,精馏提纯,升温氧化(1300℃,氧化阶段产生的Cl2可以循环利用),得到钛白粉。
2FeCl3+2TiCl4+6CO,再冷却至136℃,精馏提纯,升温氧化(1300℃,氧化阶段产生的Cl2可以循环利用),得到钛白粉。(5)用此方法生产160t纯TiO2,理论上需要消耗Cl2
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】碳、氮化合物在生产、生活中具有重要作用。回答下列问题:
(1)已知在298K和101kPa条件下,有如下反应:
反应Ⅰ:C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
反应Ⅱ:2C(s)+O2(g)=2CO(g)△H2=-221kJ•mol-1
反应Ⅲ:N2(g)+O2(g)=2NO(g)△H3=+180.5kJ•mol-1
①汽车尾气净化原理为反应Ⅳ:2NO(g)+2CO(g)⇌N2(g)+2CO2(g),其反应热ΔH=______ ,该反应能自发进行的条件是______ (填“低温”或“高温”)。
②在恒容密闭容器中发生Ⅳ的反应,下列有关该反应的说法中正确的是____ (填字母)。
A.升高温度,平衡常数减小
B.体系达到平衡后,加入催化剂,平衡正向移动
C.增大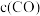 ,平衡逆向移动,NO的转化率降低
,平衡逆向移动,NO的转化率降低
D.其他条件不变,向平衡体系充入CO2气体,K值减小
E.该反应过程中,气体的密度始终保持不变
(2)氮的一种氢化物是HN3,其水溶液酸性与醋酸相似,常温下,将a mol·L-1的HN3与b mol·L-1的Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(N ),则该混合物溶液呈
),则该混合物溶液呈_____ (填“酸”“碱”或“中”)性,混合液中c(HN3)=_____ mol·L-1。
(3)利用电解法可以消除废水溶液中CN-,其原理为:碱性条件下,阳极Cl-先转化为ClO-,再将CN-氧化为两种无污染的气体。
①阳极电极反应式为_____ 。
②阳极附近溶液中除去CN-的离子方程式为______ 。
(1)已知在298K和101kPa条件下,有如下反应:
反应Ⅰ:C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
反应Ⅱ:2C(s)+O2(g)=2CO(g)△H2=-221kJ•mol-1
反应Ⅲ:N2(g)+O2(g)=2NO(g)△H3=+180.5kJ•mol-1
①汽车尾气净化原理为反应Ⅳ:2NO(g)+2CO(g)⇌N2(g)+2CO2(g),其反应热ΔH=
②在恒容密闭容器中发生Ⅳ的反应,下列有关该反应的说法中正确的是
A.升高温度,平衡常数减小
B.体系达到平衡后,加入催化剂,平衡正向移动
C.增大
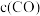 ,平衡逆向移动,NO的转化率降低
,平衡逆向移动,NO的转化率降低D.其他条件不变,向平衡体系充入CO2气体,K值减小
E.该反应过程中,气体的密度始终保持不变
(2)氮的一种氢化物是HN3,其水溶液酸性与醋酸相似,常温下,将a mol·L-1的HN3与b mol·L-1的Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(N
 ),则该混合物溶液呈
),则该混合物溶液呈(3)利用电解法可以消除废水溶液中CN-,其原理为:碱性条件下,阳极Cl-先转化为ClO-,再将CN-氧化为两种无污染的气体。
①阳极电极反应式为
②阳极附近溶液中除去CN-的离子方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
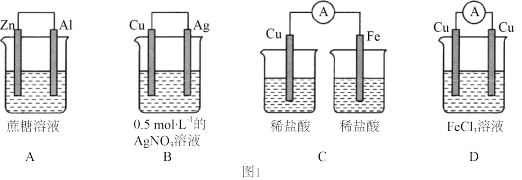
【推荐1】I.根据所学知识,按要求回答下列问题:
(1)如图1所示的四种装置中可以构成原电池的是_______ (填字母)。能构成原电池的装置中,负极材料是_______ (填元素符号),反应一段时间后,电解质溶液质量_______ (填“增大“减小”或“不变”),正极的电极反应式为_______ 。
(2)原电池可以将化学能直接转化为电能,根据这一原理推测,能设计原电池的氧化还原反应应该是_______ (填“吸热”或“放热”)反应,下列物质之间的化学变化能设计成原电池的是_______ (填字母)。
A.碳与二氧化碳反应 B.碳酸氢钠与盐酸应
C.氢气与氧气反应 D.氢氧化钠与盐酸反应
II.NO2(红棕色)和N2O4(无色)之间发生反应:N2O4(g) 2NO2(g)。将一定量N2O4气体充入体积为2L的恒容密闭容器中,控制反应温度为T。
2NO2(g)。将一定量N2O4气体充入体积为2L的恒容密闭容器中,控制反应温度为T。
(3)下列可以说明该反应达到平衡的是 _______ (填标号)。
(4)在温度为T的条件下,向该恒容密闭容器中充入0.04 mol·L-1 N2O4,c(NO2)随时间的变化曲线如图所示。
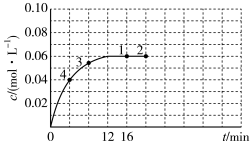
①请在图上画出N2O4的浓度随时间的变化曲线_______
②该条件下,N2O4的平衡转化率是_______ 。
③下列措施能使该反应速率加快的是:_______ (填标号)。
A.增大NO2的浓度 B.增大容器体积 C.加入合适的催化剂 D.恒容条件下充入He
(1)如图1所示的四种装置中可以构成原电池的是

(2)原电池可以将化学能直接转化为电能,根据这一原理推测,能设计原电池的氧化还原反应应该是
A.碳与二氧化碳反应 B.碳酸氢钠与盐酸应
C.氢气与氧气反应 D.氢氧化钠与盐酸反应
II.NO2(红棕色)和N2O4(无色)之间发生反应:N2O4(g)
 2NO2(g)。将一定量N2O4气体充入体积为2L的恒容密闭容器中,控制反应温度为T。
2NO2(g)。将一定量N2O4气体充入体积为2L的恒容密闭容器中,控制反应温度为T。(3)下列可以说明该反应达到平衡的是 _______ (填标号)。
| A.c(N2O4):c(NO2)=1:2 | B.v正(N2O4)=2v逆(NO2) |
| C.容器内气体的颜色不再变化 | D.混合气体的压强不再变化 |

①请在图上画出N2O4的浓度随时间的变化曲线
②该条件下,N2O4的平衡转化率是
③下列措施能使该反应速率加快的是:
A.增大NO2的浓度 B.增大容器体积 C.加入合适的催化剂 D.恒容条件下充入He
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】研究性学习小组对某工厂排出的烟道气(主要成分为NO、NO2、N2、粉尘和少量水蒸气)进行处理,实验装置如图:
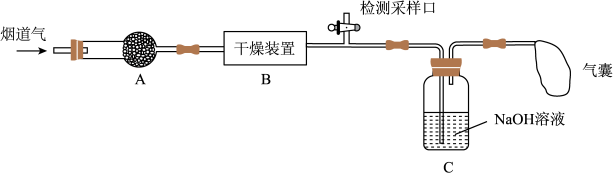
已知:NO、NO2能与NaOH溶液发生如下反应:NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO2+ NaNO3+H2O;但NO不能单独与NaOH溶液反应。
(1)实验时在装置A的干燥管中放置一团棉花,吸收粉尘。装置B的干燥装置中应盛放的试剂为____ (填字母)。
a.碱石灰 b.浓硫酸 c.五水合硫酸铜(CuSO4•5H2O)
(2)气体在被装置C中的NaOH溶液吸收前,需在检测采样口测定气体中NO和NO2的含量。为确保NO和NO2气体能够被NaOH溶液完全吸收,则需控制参加反应的NO和NO2物质的量比值为____ (填字母)。
a.≥1 b.=1 c.≤1
(3)若进入装置C的气体中NO和NO2物质的量比值不符合(2)中要求,则气囊中除含有N2外,可能含有少量NO气体。甲同学设计了喷淋吸收塔装置(如图所示),用NaClO溶液来进一步处理NO气体。
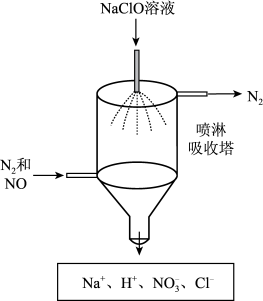
①NaClO溶液吸收NO时发生反应的离子方程式为____ 。
②该装置的优点是____ 。
(4)装置C的吸收液中NO 、NO
、NO 直接排放也会造成水体污染。乙同学设计了以下实验将溶液中
直接排放也会造成水体污染。乙同学设计了以下实验将溶液中 、NO
、NO 转化为N2,实现氮的脱除,具体步骤如下:
转化为N2,实现氮的脱除,具体步骤如下:
①向装置C的吸收液中加入适量H2O2溶液,充分反应后,蒸发浓缩,得到c(NO )为0.1000mol·L-1的溶液甲。写出H2O2溶液将吸收液中的NO
)为0.1000mol·L-1的溶液甲。写出H2O2溶液将吸收液中的NO 氧化为NO
氧化为NO 的离子方程式:
的离子方程式:____ 。
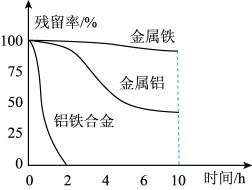
②量取三份50mL溶液甲,分别用金属铝、金属铁和铝铁合金在45℃、惰性气体氛围中将溶液甲中的NO 还原为N2,从而实现脱氮,溶液中NO
还原为N2,从而实现脱氮,溶液中NO 的残留率(残留率=
的残留率(残留率= ×100%)与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是
×100%)与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是____ 。

已知:NO、NO2能与NaOH溶液发生如下反应:NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO2+ NaNO3+H2O;但NO不能单独与NaOH溶液反应。
(1)实验时在装置A的干燥管中放置一团棉花,吸收粉尘。装置B的干燥装置中应盛放的试剂为
a.碱石灰 b.浓硫酸 c.五水合硫酸铜(CuSO4•5H2O)
(2)气体在被装置C中的NaOH溶液吸收前,需在检测采样口测定气体中NO和NO2的含量。为确保NO和NO2气体能够被NaOH溶液完全吸收,则需控制参加反应的NO和NO2物质的量比值为
a.≥1 b.=1 c.≤1
(3)若进入装置C的气体中NO和NO2物质的量比值不符合(2)中要求,则气囊中除含有N2外,可能含有少量NO气体。甲同学设计了喷淋吸收塔装置(如图所示),用NaClO溶液来进一步处理NO气体。

①NaClO溶液吸收NO时发生反应的离子方程式为
②该装置的优点是
(4)装置C的吸收液中NO
 、NO
、NO 直接排放也会造成水体污染。乙同学设计了以下实验将溶液中
直接排放也会造成水体污染。乙同学设计了以下实验将溶液中 、NO
、NO 转化为N2,实现氮的脱除,具体步骤如下:
转化为N2,实现氮的脱除,具体步骤如下:①向装置C的吸收液中加入适量H2O2溶液,充分反应后,蒸发浓缩,得到c(NO
 )为0.1000mol·L-1的溶液甲。写出H2O2溶液将吸收液中的NO
)为0.1000mol·L-1的溶液甲。写出H2O2溶液将吸收液中的NO 氧化为NO
氧化为NO 的离子方程式:
的离子方程式:②量取三份50mL溶液甲,分别用金属铝、金属铁和铝铁合金在45℃、惰性气体氛围中将溶液甲中的NO
 还原为N2,从而实现脱氮,溶液中NO
还原为N2,从而实现脱氮,溶液中NO 的残留率(残留率=
的残留率(残留率= ×100%)与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是
×100%)与反应时间的关系如图所示。0~2h内,铝铁合金的脱氮效率比金属铝、金属铁要高得多,其可能原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】合理利用资源,加强环境保护,降低碳排放,实施低碳经济是今后经济生活的主流。回答下列问题:
(1)下列措施不利于有效减少二氧化碳的是_______(填字母)。
(2)科学家致力于二氧化碳的“组合转化”技术研究,如将CO2和H2以1∶4的物质的量之比混合通入反应器,在适当条件下反应可获得一种重要能源。请完成以下化学方程式:
CO2+4H2
_______ +2H2O
(3)用CO2合成燃料甲醇(CH3OH)是碳减排的新方向。现进行如下实验:某温度下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),在体积为1 L的密闭容器中,充入2 mol CO2和6 mol H2 。
① 能判断该反应已达化学平衡的标志是_______ (填字母)。
a.CO2百分含量保持不变
b.容器中混合气体的质量保持不变
c.容器中H2浓度与CO2浓度之比为3∶1
d.CO2的生成速率与CH3OH的生成速率相等
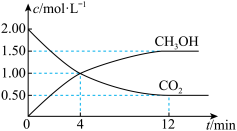
②现测得CO2和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,氢气的平均反应速率v(H2)=_______ 。
(4)以KOH为电解质的甲醇燃料电池总反应为2CH3OH+3O2+4KOH=2K2CO3+6H2O。通入甲醇的电极为燃料电池的_______ (填“正”或“负”)极,每消耗1molCH3OH转移电子_______ mol。
(1)下列措施不利于有效减少二氧化碳的是_______(填字母)。
| A.植树造林,保护森林,保护植被 |
| B.加大对煤和石油的开采,并鼓励使用液化石油气 |
| C.大力发展风能、水力、潮汐能发电和核电,大力推行太阳能的综合开发 |
| D.推广使用节能灯和节能电器,使用空调时夏季温度不宜设置过低,冬天不宜过高 |
CO2+4H2

(3)用CO2合成燃料甲醇(CH3OH)是碳减排的新方向。现进行如下实验:某温度下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),在体积为1 L的密闭容器中,充入2 mol CO2和6 mol H2 。
① 能判断该反应已达化学平衡的标志是
a.CO2百分含量保持不变
b.容器中混合气体的质量保持不变
c.容器中H2浓度与CO2浓度之比为3∶1
d.CO2的生成速率与CH3OH的生成速率相等
②现测得CO2和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,氢气的平均反应速率v(H2)=

(4)以KOH为电解质的甲醇燃料电池总反应为2CH3OH+3O2+4KOH=2K2CO3+6H2O。通入甲醇的电极为燃料电池的
您最近一年使用:0次



