Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为___ 、___ (填标号)。
A.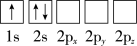
B.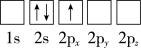
C.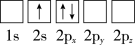
D.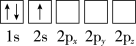
(2)Li+与H−具有相同的电子构型,r(Li+)小于r(H−),原因是___ 。
(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子(AlH )空间构型是
)空间构型是___ 、中心原子的杂化形式为___ 。
(4)Li2O是离子晶体,其晶格能可通过如图的Born−Haber循环计算得到。
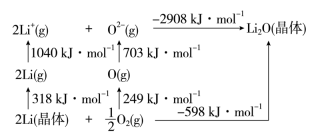
可知,Li原子的第一电离能为___ kJ·mol−1,O=O键键能为___ kJ·mol−1。
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为
A.

B.

C.

D.

(2)Li+与H−具有相同的电子构型,r(Li+)小于r(H−),原因是
(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子(AlH
 )空间构型是
)空间构型是(4)Li2O是离子晶体,其晶格能可通过如图的Born−Haber循环计算得到。
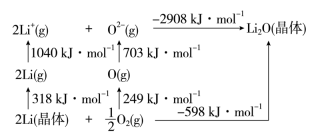
可知,Li原子的第一电离能为
更新时间:2020-06-18 08:28:33
|
相似题推荐
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐1】钙及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)基态钙原子的核外电子排布式为_______ ,能量最高的电子的电子云轮廓图形状是_______ 。
(2)含氟牙膏中氟离子将羟基磷酸钙[Ca5(PO4)3OH]转化为耐腐蚀的氟磷酸钙[Ca5(PO4)3F]。与 互为等电子体的分子为
互为等电子体的分子为_______ (填一种)。
(3)元素T与钙位于同周期,在前四周期中基态T原子的未成对电子数最多。T的一种离子与H2 NCH2CH2NH2(后面简写为en)、OH-、H2O组成配合物[T(OH)3( H2O)(cn)]。
①该配合物配位中心离子是_______ (填离子符号) ,其配位数为_______ 。
②该配合物中所含元素C、N、O分别可以和氢原子构成CH4、NH3、H2O三种分子的键角依次减小,其主要原因是_______ 。
(4)CaF2、CaCl2晶体的熔点依次为1402℃、782℃,二者熔点相差较大的主要原因是_______ 。
(5)CaSe(硒化钙)晶胞结构如图所示:

①该晶胞中,面心上6个Se2-相连构成的几何体是_______ ( 填字母)。
A.正四面体 B.立方体 C.正八面体 D.三角锥形
②已知硒化钙晶体的密度为dg∙cm-3,NA表示阿伏加德罗常数的值,则该晶胞中距离最近的Ca2+之间的距离为_______ pm(用含d和NA的代数式表示)。
(1)基态钙原子的核外电子排布式为
(2)含氟牙膏中氟离子将羟基磷酸钙[Ca5(PO4)3OH]转化为耐腐蚀的氟磷酸钙[Ca5(PO4)3F]。与
 互为等电子体的分子为
互为等电子体的分子为(3)元素T与钙位于同周期,在前四周期中基态T原子的未成对电子数最多。T的一种离子与H2 NCH2CH2NH2(后面简写为en)、OH-、H2O组成配合物[T(OH)3( H2O)(cn)]。
①该配合物配位中心离子是
②该配合物中所含元素C、N、O分别可以和氢原子构成CH4、NH3、H2O三种分子的键角依次减小,其主要原因是
(4)CaF2、CaCl2晶体的熔点依次为1402℃、782℃,二者熔点相差较大的主要原因是
(5)CaSe(硒化钙)晶胞结构如图所示:

①该晶胞中,面心上6个Se2-相连构成的几何体是
A.正四面体 B.立方体 C.正八面体 D.三角锥形
②已知硒化钙晶体的密度为dg∙cm-3,NA表示阿伏加德罗常数的值,则该晶胞中距离最近的Ca2+之间的距离为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐2】氟及其化合物用途十分广泛,回答下列问题:
(1)氟化物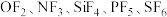 中,中心原子采取
中,中心原子采取 杂化且分子构型为正四面体形的是
杂化且分子构型为正四面体形的是_______ 。
(2)已知氟锑酸是一种超强酸,基态锑的电子排布式为_______ 。
(3)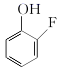 的分子内部存在氢键,画出氢键结构:
的分子内部存在氢键,画出氢键结构:_______ 。
(4)工业上电解 制取单质铝,常利用冰晶石
制取单质铝,常利用冰晶石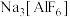 降低
降低 的熔点。冰晶石的生产原理为
的熔点。冰晶石的生产原理为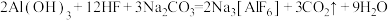 。
。
①测定气态 的摩尔质量时,往往得不到
的摩尔质量时,往往得不到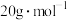 的数据,原因是
的数据,原因是_______ 。
②反应物中元素(氢除外)的第一电离能从大到小的顺序为_______ (用元素符号表示)。
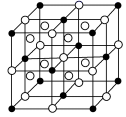
③冰晶石由阴阳离子两种微粒构成,冰晶石的晶胞结构如图所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是_______ (填具体的微粒符号)。
(1)氟化物
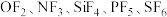 中,中心原子采取
中,中心原子采取 杂化且分子构型为正四面体形的是
杂化且分子构型为正四面体形的是(2)已知氟锑酸是一种超强酸,基态锑的电子排布式为
(3)
 的分子内部存在氢键,画出氢键结构:
的分子内部存在氢键,画出氢键结构:(4)工业上电解
 制取单质铝,常利用冰晶石
制取单质铝,常利用冰晶石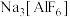 降低
降低 的熔点。冰晶石的生产原理为
的熔点。冰晶石的生产原理为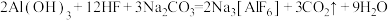 。
。①测定气态
 的摩尔质量时,往往得不到
的摩尔质量时,往往得不到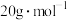 的数据,原因是
的数据,原因是②反应物中元素(氢除外)的第一电离能从大到小的顺序为
③冰晶石由阴阳离子两种微粒构成,冰晶石的晶胞结构如图所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是

您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐3】X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,Q的核电荷数是X与Z的核电荷数之和, E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为___________ 、____________ ;
(2)XZ2与YZ2分子的立体结构分别是___________ 和___________ ,在水中溶解度较大的是________ (填化学式);
(3)Q元素的价电子排布图为___________ ,在形成化合物时它的最高化合价为_____ ;
(4)Z与E形成的化合物中,各原子最外层都达到8电子结构,该化合物中心原子采用的轨道杂化方式是____________ 。
(1)X、Y的元素符号依次为
(2)XZ2与YZ2分子的立体结构分别是
(3)Q元素的价电子排布图为
(4)Z与E形成的化合物中,各原子最外层都达到8电子结构,该化合物中心原子采用的轨道杂化方式是
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
【推荐1】a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示。
请回答:
(1)画出d元素的原子结构示意图___________ 。
(2)b与其同周期相邻元素第一电离能由大到小的顺序为___________ (用元素符号表示)。
(3)c的氢化物水溶液中存在的氢键有___________ 种。
(4)a与其相邻同主族元素的最高价氧化物的熔点相差较大的原因是___________ 。
(5)若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,与A互为等电子体的一种分子为___________ (填化学式)。
(6)e与Au的合金可形成面心立方最密堆积的晶体,在晶胞中e原子处于面心,该晶体具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为___________ ,若该晶体的相对分子质量为M,密度为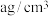 ,则晶胞的体积为
,则晶胞的体积为___________ ( 用表示阿伏伽德罗常数的值)。
用表示阿伏伽德罗常数的值)。
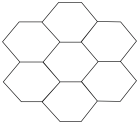
(7)a形成的某种单质的层状结构如图,其中a原子数、a-a键数之比为___________ 。
| a | 原子核外电子分别占3个不同能级,且每个能级上排布的电子数相同 |
| b | 基态原子的p轨道电子数比s轨道电子数少1 |
| c | 在周期表所列元素中电负性最大 |
| d | 位于周期表中第8纵行 |
| e | 基态原子M层全充满,N层只有一个电子 |
(1)画出d元素的原子结构示意图
(2)b与其同周期相邻元素第一电离能由大到小的顺序为
(3)c的氢化物水溶液中存在的氢键有
(4)a与其相邻同主族元素的最高价氧化物的熔点相差较大的原因是
(5)若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,与A互为等电子体的一种分子为
(6)e与Au的合金可形成面心立方最密堆积的晶体,在晶胞中e原子处于面心,该晶体具有储氢功能,氢原子可进入到由e原子与Au原子构成的四面体空隙中,储氢后的晶胞结构与金刚石晶胞结构相似,该晶体储氢后的化学式为
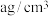 ,则晶胞的体积为
,则晶胞的体积为 用表示阿伏伽德罗常数的值)。
用表示阿伏伽德罗常数的值)。(7)a形成的某种单质的层状结构如图,其中a原子数、a-a键数之比为

您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐2】现有6种短周期元素X、Y、Z、W、M、Q,其原子序数依次增大,部分信息如下表:
请用相应的化学用语回答下列问题:
(1)中子数为8的一种Y原子常用于判断古生物化石年代,其原子符号是________ 。
(2)基态Q原子的核外电子排布中,电子占据的最高能级符号是________ ,其电子云轮廓图为________ 形。
(3)Z的电负性________ W的电负性(填“>”或“<”,下同),Z的第一电离能________ W的第一电离能,Z、W、M的简单离子半径由大到小的顺序是________ (用离子符号回答)。
(4)QW 的VSEPR模型是
的VSEPR模型是________ ,QW3分子中的键角是________ 。
(5)ZX 中的X—Z—X键角比ZX3中的X—Z—X键角大,原因是
中的X—Z—X键角比ZX3中的X—Z—X键角大,原因是________ 。
| X | 阴离子电子层结构与氦原子相同 |
| Y | 最高价氧化物在空气中增多会造成温室效应 |
| Z | 双原子单质分子中键与键的数目之比为1:2 |
| W | 基态原子的价电子排布式为nsnnpn+2 |
| M | 短周期元素中原子半径最大 |
| Q | 元素最高化合价与最低化合价的代数和等于4 |
(1)中子数为8的一种Y原子常用于判断古生物化石年代,其原子符号是
(2)基态Q原子的核外电子排布中,电子占据的最高能级符号是
(3)Z的电负性
(4)QW
 的VSEPR模型是
的VSEPR模型是(5)ZX
 中的X—Z—X键角比ZX3中的X—Z—X键角大,原因是
中的X—Z—X键角比ZX3中的X—Z—X键角大,原因是
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐3】下图是元素周期表的一部分,用化学用语回答下列问题:
(1)元素D的元素符号是______ ,元素Y所处的族序号是______ 。
(2)下列是元素X的某些原子的电子排布图,能量最高的原子是______(填字母)。
(3)元素F的基态原子中最高能层符号是______ ,元素J的基态原子中最高能级符号是______ 。
(4)元素H的基态原子的价层电子排布式______ ,元素L的基态原子的简化电子排布式______ 。
(5)画出元素I的原子结构示意图______ 。
(6)第三周期所列六种元素中,电负性最大的是______ (填元素符号,下同),原子半径最大的是______ ,第一电离能最小的是______ 。形成的简单离子中,离子半径最小的是______ 。
族 周期 | ⅠA 族 | O 族 | ||||||||||||||||
一 | A | |||||||||||||||||
二 | X | E | Y | |||||||||||||||
三 | B | F | G | I | J | K | ||||||||||||
四 | M | H | D | L |
(1)元素D的元素符号是
(2)下列是元素X的某些原子的电子排布图,能量最高的原子是______(填字母)。
A.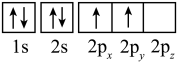 | B.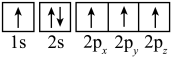 |
C. | D.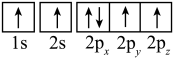 |
(3)元素F的基态原子中最高能层符号是
(4)元素H的基态原子的价层电子排布式
(5)画出元素I的原子结构示意图
(6)第三周期所列六种元素中,电负性最大的是
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐1】有U、V、W、X、Y、Z六种前四周期元素,原子序数依次增大,其相关信息如下表:
请回答下列问题:
(1)W、X、V第一电离能由大到小顺序:________________________ (用元素符号表示)
(2)V的最高价氧化物对应含氧酸中,酸根的立体构型为:_________ ,中心原子的杂化方式为:_______________ ;
(3)Y的基态原子的价电子排布图为____________________________ ;
(4)乙和丙分别是V和X的氢化物,这两种氢化物分子中都含有10个电子。两者沸点的关系为乙______ 丙(填“>”或“<”),原因是__________________________________________ ;
(5)V与W原子结合形成的V3W4晶体,其硬度比金刚石大,则V3W4晶体中属于____________ 晶体
| 元素编号 | 相关信息比 |
| U | 所处的周期数、族序数分别与其原子序数相等 |
| V | 基态时,电子分布在三个能级上,且各能级中电子数相等 |
| W | 基态时, 2p 轨道处于半充满状态 |
| X | 自然界中含量最多 |
| Y | 是第四周期元素中未成对电子数最多的元素 |
请回答下列问题:
(1)W、X、V第一电离能由大到小顺序:
(2)V的最高价氧化物对应含氧酸中,酸根的立体构型为:
(3)Y的基态原子的价电子排布图为
(4)乙和丙分别是V和X的氢化物,这两种氢化物分子中都含有10个电子。两者沸点的关系为乙
(5)V与W原子结合形成的V3W4晶体,其硬度比金刚石大,则V3W4晶体中属于
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐2】茉莉醛具有优雅的茉莉花香味,是一种广泛应用于化妆品、洗涤剂和空气清新剂的合成香料。
制备茉莉醛的一种反应原理、发生装置、工艺流程和有关数据如下:
I.反应原理:
II.发生装置:

III.工艺流程:

IV.关数据:
V.色谱分离图

回答下列问题:
(1)仪器b的名称是______ ;a与普通分液漏斗相比,其优点是______ 。
(2)“搅拌”中加入乙醇的作用是______ ;“加热”中需保持温度为60~65℃,应采取的加热方法是______ ;“操作I”的名称是______ 。
(3)柱色谱分离法是利用吸附剂对物质吸附能力的不同,进行物质分离提纯的一种方法。吸附剂一般难溶于水、表面积比较大,可选用下列物质中______ 作吸附剂。(填正确选项)
a.氯化钠 B.活性炭
(4)茉莉醛分子中碳原子的杂化方式为______ 。
(5)根据题中所给数据,所得茉莉醛产率约为______ %(保留三位有效数字)。
制备茉莉醛的一种反应原理、发生装置、工艺流程和有关数据如下:
I.反应原理:

II.发生装置:

III.工艺流程:

IV.关数据:
相对分子质量 | 密度/ | 沸点/℃ | |
苯甲醛 | 106 | 1.04 | 179 |
庚醛 | 114 | 0.85 | 153 |
茉莉醛 | 202 | 0.97 | 287 |

回答下列问题:
(1)仪器b的名称是
(2)“搅拌”中加入乙醇的作用是
(3)柱色谱分离法是利用吸附剂对物质吸附能力的不同,进行物质分离提纯的一种方法。吸附剂一般难溶于水、表面积比较大,可选用下列物质中
a.氯化钠 B.活性炭
(4)茉莉醛分子中碳原子的杂化方式为
(5)根据题中所给数据,所得茉莉醛产率约为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐3】硼(B)及其化合物在化学中有重要的地位,请回答下列问题: 是白色片状晶体(层状结构如图),有滑腻感,在冷水中溶解度很小,加热时溶解度增大。
是白色片状晶体(层状结构如图),有滑腻感,在冷水中溶解度很小,加热时溶解度增大。
①硼酸中B原子的杂化轨道类型为______ 。
②加热时,硼酸的溶解度增大,主要原因是______ 。
③硼酸是一元弱酸,在水中电离时,硼酸结合水电离出的 而呈酸性、硼酸的电离方程式:
而呈酸性、硼酸的电离方程式:______ 。
(2)立方氮化硼的结构与金刚石相似,晶胞结构如图所示。______ 。
②已知晶胞边长为361.5pm,则立方氮化硼的密度是______  。(只要求列算式,不必计算出数值,阿伏加德罗常数用
。(只要求列算式,不必计算出数值,阿伏加德罗常数用 表示)
表示)
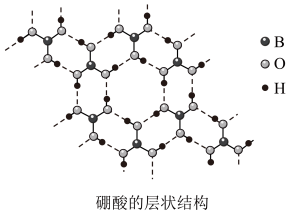
 是白色片状晶体(层状结构如图),有滑腻感,在冷水中溶解度很小,加热时溶解度增大。
是白色片状晶体(层状结构如图),有滑腻感,在冷水中溶解度很小,加热时溶解度增大。①硼酸中B原子的杂化轨道类型为
②加热时,硼酸的溶解度增大,主要原因是
③硼酸是一元弱酸,在水中电离时,硼酸结合水电离出的
 而呈酸性、硼酸的电离方程式:
而呈酸性、硼酸的电离方程式:(2)立方氮化硼的结构与金刚石相似,晶胞结构如图所示。

②已知晶胞边长为361.5pm,则立方氮化硼的密度是
 。(只要求列算式,不必计算出数值,阿伏加德罗常数用
。(只要求列算式,不必计算出数值,阿伏加德罗常数用 表示)
表示)
您最近一年使用:0次




