CuCl广泛应用于化工和印染等行业。某研究小组用粗铜(含杂质Fe) 为原料制备CuCl2·2H2O晶体,再用CuCl2·2H2O晶体制备CuCl。
(1)制备CuCl2·2H2O晶体:
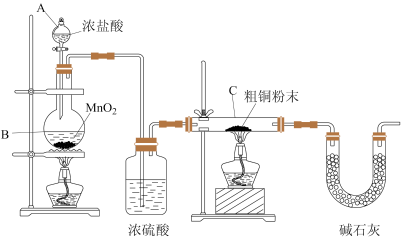
① B装置中发生反应的化学方程式是_________________
② 装置C中粗铜粉末(含杂质Fe)与气体充分反应时的生成物是______________
③ 反应完成后,将C中的固体用稀盐酸完全溶解,再调节pH值除杂,经一系列操作便可获得CuCl2·2H2O晶体。溶解C中生成物固体时,有时会加入少量双氧水,目的是__________
(2)制取CuCl,为了制取CuCl采用如图所示装置进行实验(夹持仪器略):
已知:
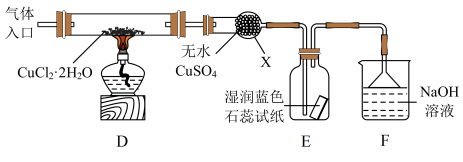
④仪器X的名称是__________
⑤实验操作的先后顺序是a→__________________________ →e(填操作的编号)。
a.检查装置的气密性后加入药品 b.熄灭酒精灯,冷却
c.在“气体入口”处通入干燥HCl d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
⑥装置F中NaOH溶液的作用是___________________ 。
⑦ 反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质。请分析产生CuCl2杂质的原因是__________________________
(1)制备CuCl2·2H2O晶体:

① B装置中发生反应的化学方程式是
② 装置C中粗铜粉末(含杂质Fe)与气体充分反应时的生成物是
③ 反应完成后,将C中的固体用稀盐酸完全溶解,再调节pH值除杂,经一系列操作便可获得CuCl2·2H2O晶体。溶解C中生成物固体时,有时会加入少量双氧水,目的是
(2)制取CuCl,为了制取CuCl采用如图所示装置进行实验(夹持仪器略):

已知:

④仪器X的名称是
⑤实验操作的先后顺序是a→
a.检查装置的气密性后加入药品 b.熄灭酒精灯,冷却
c.在“气体入口”处通入干燥HCl d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
⑥装置F中NaOH溶液的作用是
⑦ 反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质。请分析产生CuCl2杂质的原因是
更新时间:2020-06-28 23:56:03
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】双氧水和含氯消毒剂是生活中常用的消毒剂,了解物质的性质是科学合理使用化学品的基础和前提。请回答下列问题:
(1)某同学设计如下实验研究H2O2的性质:
①从理论上看H2O2既有氧化性又有还原性,具有还原性的原因是_______ 。
②能证明H2O2具有还原性的实验是_______ (填序号),写出该过程的离子方程式_______ 。
(2)“84”消毒液的有效成分为NaClO。
①将Cl2通入NaOH溶液中可制得“84”消毒液,反应的化学方程式_______ 。
②“84”消毒液不能与洁厕灵(主要成分为盐酸)混用的原因_______ (用化学用语解释其原理)。
(3)二氧化氯(ClO2)是广谱性具有强氧化性的高效低毒的消毒剂。
①用NaClO3氧化浓盐酸来制取ClO2,同时有Cl2生成,该过程的化学方程式为_______ 。
②若上述反应产生0.1 mol Cl2,转移电子的物质的量为_______ mol。
③ClO2消毒的效率(以单位质量得到电子数表示)是Cl2的_______ 倍。
(1)某同学设计如下实验研究H2O2的性质:
| 序号 | 实验 | 实验现象 |
| i | 向5%H2O2溶液中滴加酸性KMnO4溶液 | a.溶液紫色褪去 b.有大量气泡产生 |
| ii | 向5%H2O2溶液中滴加淀粉碘化钾溶液 | c.溶液变蓝 |
②能证明H2O2具有还原性的实验是
(2)“84”消毒液的有效成分为NaClO。
①将Cl2通入NaOH溶液中可制得“84”消毒液,反应的化学方程式
②“84”消毒液不能与洁厕灵(主要成分为盐酸)混用的原因
(3)二氧化氯(ClO2)是广谱性具有强氧化性的高效低毒的消毒剂。
①用NaClO3氧化浓盐酸来制取ClO2,同时有Cl2生成,该过程的化学方程式为
②若上述反应产生0.1 mol Cl2,转移电子的物质的量为
③ClO2消毒的效率(以单位质量得到电子数表示)是Cl2的
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】探究影响KMnO4与草酸(H2C2O4,二元弱酸)反应速率的因素。完成下列填空:
I.配制1.000×10-3 mol·L-1 KMnO4溶液、0.40 mol·L-1草酸溶液。
(1)用5.200×10-3 mol·L-1 KMnO4溶液配制100 mL 1.000×10-3 mol·L-1 KMnO4溶液需要的仪器有:_______ 。
II.将KMnO4溶液与草酸溶液按如下比例混合。
(2)实验①和②的目的是 _______ 。
(3)上述实验应控制pH相同,则应加入的试剂是_______ (选填选项)。
A.盐酸 B.硫酸 C.草酸
III.将溶液调至pH=1进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:
i.紫色溶液变为青色溶液;
ii.青色溶液逐渐褪至无色溶液。
资料:(a)Mn2+在溶液中无色;
(b)Mn3+无色,有强氧化性,发生反应Mn3++2
 [Mn(C2O4)2]-(青绿色)后氧化性减弱;
[Mn(C2O4)2]-(青绿色)后氧化性减弱;
(c)MnO 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和MnO2。
和MnO2。
(4)推测阶段i中可能产生了MnO 。该观点是否合理,并说明理由:
。该观点是否合理,并说明理由:_______ 。
IV.为证明溶液中含有[Mn(C2O4)2]-,测得反应过程中 和[Mn(C2O4)2]-浓度随时间的变化如下图:
和[Mn(C2O4)2]-浓度随时间的变化如下图:

(5)第i阶段中检测到有CO2产生,反应的离子方程式为_______ 。
(6)实验②在第ii阶段反应速率较大,猜测是c(Mn3+)较大引起的,请解释实验②中c(Mn3+)较大的原因_______ 。
(7)据此推测,若在第ii阶段将c(H+)调节至0.2 mol·L-1,溶液褪至无色的时间会_______ (填“增加”“减少” 或“不变”)。
I.配制1.000×10-3 mol·L-1 KMnO4溶液、0.40 mol·L-1草酸溶液。
(1)用5.200×10-3 mol·L-1 KMnO4溶液配制100 mL 1.000×10-3 mol·L-1 KMnO4溶液需要的仪器有:
II.将KMnO4溶液与草酸溶液按如下比例混合。
| 序号 | V(KMnO4) / mL | V(草酸) /mL | V(H2O) /mL | 反应温度 |
| ① | 2.0 | 2.0 | 0 | 20°C |
| ② | 2.0 | 1.0 | 1.0 | 20°C |
(3)上述实验应控制pH相同,则应加入的试剂是
A.盐酸 B.硫酸 C.草酸
III.将溶液调至pH=1进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:
i.紫色溶液变为青色溶液;
ii.青色溶液逐渐褪至无色溶液。
资料:(a)Mn2+在溶液中无色;
(b)Mn3+无色,有强氧化性,发生反应Mn3++2

 [Mn(C2O4)2]-(青绿色)后氧化性减弱;
[Mn(C2O4)2]-(青绿色)后氧化性减弱; (c)MnO
 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和MnO2。
和MnO2。(4)推测阶段i中可能产生了MnO
 。该观点是否合理,并说明理由:
。该观点是否合理,并说明理由:IV.为证明溶液中含有[Mn(C2O4)2]-,测得反应过程中
 和[Mn(C2O4)2]-浓度随时间的变化如下图:
和[Mn(C2O4)2]-浓度随时间的变化如下图:
(5)第i阶段中检测到有CO2产生,反应的离子方程式为
(6)实验②在第ii阶段反应速率较大,猜测是c(Mn3+)较大引起的,请解释实验②中c(Mn3+)较大的原因
(7)据此推测,若在第ii阶段将c(H+)调节至0.2 mol·L-1,溶液褪至无色的时间会
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下,回答下列问题
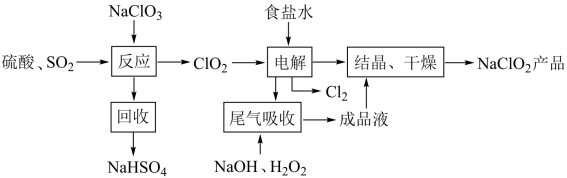
(1)NaClO2中Cl的化合价为______________________ .
(2)写出“反应”步骤中生成ClO2的化学方程式._______________________________ 。
(3)“电解”所用食盐水由粗盐水精制而成。粗盐精制时,为除去其中的Mg 2+和Ca 2+,要加入的试剂分别为_____________________ 、______________________ 。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应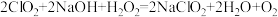 ,氧化剂与氧化产物的质量之比为
,氧化剂与氧化产物的质量之比为_________________ ,在标况下生成44.8LO2则转移电子的物质的量是____ .
(5)双氧水是中学常见的绿色化学试剂,既可以表现氧化性,又可以表现还原性。向双氧水中滴加酸性高锰酸钾溶液,产生气泡,紫红色褪去(已知Mn2+为无色),根据现象写出离子方程式._____________________________ 。

(1)NaClO2中Cl的化合价为
(2)写出“反应”步骤中生成ClO2的化学方程式.
(3)“电解”所用食盐水由粗盐水精制而成。粗盐精制时,为除去其中的Mg 2+和Ca 2+,要加入的试剂分别为
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应
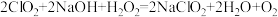 ,氧化剂与氧化产物的质量之比为
,氧化剂与氧化产物的质量之比为(5)双氧水是中学常见的绿色化学试剂,既可以表现氧化性,又可以表现还原性。向双氧水中滴加酸性高锰酸钾溶液,产生气泡,紫红色褪去(已知Mn2+为无色),根据现象写出离子方程式.
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】人类的农业生产离不开氮肥,几乎所有的氮肥都以氨为原料生产。某化学兴趣小组在实验室利用如图装置制备氨气并探究相关性质。
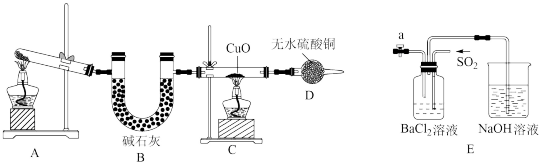
(1)该实验中A装置制备 的化学方程式是
的化学方程式是_______ 。
(2)D装置后接尾气吸收装置。下列能用来吸收尾气的装置是_______ (填装置序号)。
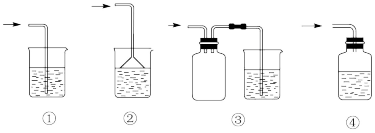
(3)若将D与a相连,在E中产生白色沉淀。其化学式为:_______ 。若向a处单独通入_______ (填下列气体字母编号),在E中也会产生白色沉淀。
A. B.
B. C.
C. D.
D.
(4)实验发现C中粉末完全变红,D中无水硫酸铜变蓝,还产生一种单质气体。
①若红色固体为单质,实验后将C中固体与浓硫酸混合加热,其化学方程式为:_______ ;若充分反应后红色固体有剩余,再加入下列的_______ (填字母)试剂,固体又可以继续溶解。
A.稀 B.
B. 溶液 C.
溶液 C. 溶液 D.
溶液 D. 溶液
溶液
②已知 也为红色固体,若反应前C中CuO质量为8g。反应后C中红色固体质量为6.8g,则C中发生的总反应化学方程式为:
也为红色固体,若反应前C中CuO质量为8g。反应后C中红色固体质量为6.8g,则C中发生的总反应化学方程式为:_______ 。

(1)该实验中A装置制备
 的化学方程式是
的化学方程式是(2)D装置后接尾气吸收装置。下列能用来吸收尾气的装置是

(3)若将D与a相连,在E中产生白色沉淀。其化学式为:
A.
 B.
B. C.
C. D.
D.
(4)实验发现C中粉末完全变红,D中无水硫酸铜变蓝,还产生一种单质气体。
①若红色固体为单质,实验后将C中固体与浓硫酸混合加热,其化学方程式为:
A.稀
 B.
B. 溶液 C.
溶液 C. 溶液 D.
溶液 D. 溶液
溶液②已知
 也为红色固体,若反应前C中CuO质量为8g。反应后C中红色固体质量为6.8g,则C中发生的总反应化学方程式为:
也为红色固体,若反应前C中CuO质量为8g。反应后C中红色固体质量为6.8g,则C中发生的总反应化学方程式为:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】A~J是中学化学中常见的化学物质,它们之间的相互转化关系如下列框图所示(部分反应的产物未列出)。

已知:A、F为无色气体单质,B为无色具有刺激性气味的碱性气体,C为黑色氧化物,E为红色金属单质。请回答下列问题:
(1)D的化学式为_____________ ;F的电子式为______________ 。
(2)B和C反应的化学方程式为_______________ 。该反应中生成1molF时,转移的电子数为_________ mol
(3)E与G的稀溶液反应的离子方程式为:____________________ 。
(4)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式___________________ 。

已知:A、F为无色气体单质,B为无色具有刺激性气味的碱性气体,C为黑色氧化物,E为红色金属单质。请回答下列问题:
(1)D的化学式为
(2)B和C反应的化学方程式为
(3)E与G的稀溶液反应的离子方程式为:
(4)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含 70%Cu、25%Al、4%Fe 及少量 Au、Pt 的合金,并设计出由合金制备硫酸铜和硫酸铝晶体的路线:
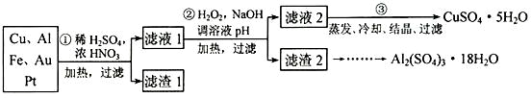
请回答下列问题:
(1)第①步 Cu与酸反应的离子方程式为__________________ ,得到滤渣 1的主要成分为_______________ 。
(2)第②步加 H2O2的作用是做氧化剂,将溶液中的 Fe2+氧化为 Fe3+,用 H2O2做氧化剂的优点是____________________ 。
(3)滤渣 2的主要成分是 Al(OH)3和 Fe(OH)3,在生产中如何分离两种沉淀,写出反应的离子方程式______________ 。
(4)第③步蒸发所需玻璃仪器为__________________ 。

请回答下列问题:
(1)第①步 Cu与酸反应的离子方程式为
(2)第②步加 H2O2的作用是做氧化剂,将溶液中的 Fe2+氧化为 Fe3+,用 H2O2做氧化剂的优点是
(3)滤渣 2的主要成分是 Al(OH)3和 Fe(OH)3,在生产中如何分离两种沉淀,写出反应的离子方程式
(4)第③步蒸发所需玻璃仪器为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】硫酸四氨合铜晶体([Cu(NH3)4]SO4·H2O)常用作杀虫剂、媒染剂,也是碱性镀铜中电镀液的主要成分。某学习小组在实验室以铜为主要原料合成该物质,设计的合成路线如图所示。
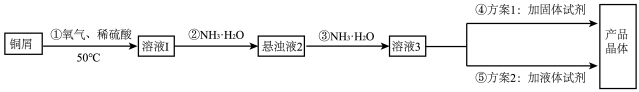
已知:①[Cu(NH3)4]SO4·H2O为绛蓝色晶体,常温下在空气中易与水和二氧化碳反应,生成铜的碱式盐,使晶体变成绿色粉末。在溶液中存在以下电离(解离)过程:
[Cu(NH3)4]SO4·H2O [Cu(NH3)4]2++
[Cu(NH3)4]2++  +H2O;
+H2O;
[Cu(NH3)4]2+ Cu2++4NH3。
Cu2++4NH3。
②(NH4)2SO4及[Cu(NH3)4]SO4·H2O)在水中均可溶,在乙醇中均难溶。若在铜氨溶液中加入乙醇,会析出绛蓝色的硫酸四氨合铜晶体;实验表明,若在铜氨溶液中加入硫酸钠或硫酸铵晶体时,同样会有硫酸四氯合铜晶体析出。
③CuSO4溶液在加热条件下可能会生成Cu(OH)2和Cu2(OH)2SO4。
请回答下列问题:
(1)实验室用如图装置制备合成[Cu(NH3)4]SO4·H2O所需的CuSO4溶液。
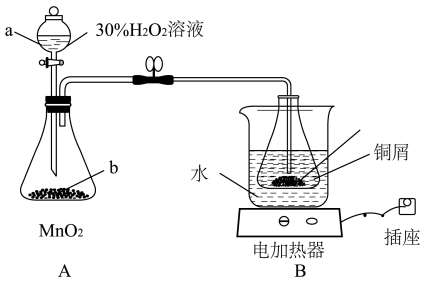
①仪器a的名称为____ ;装置B中发生反应的离子方程式为____ 。
②试用文字说明A装置气密性的检验方法____ 。
③装置B的加热方法称为水浴加热法,该加热方法的优点为____ 。
(2)方案1向溶液3中所加的固体试剂为____ ;说明加入该固体试剂的目的为____ 。
(3)方案2的实验步骤为a.加热蒸发,b.冷却溶液,c.加95%乙醇结晶,……
根据方案得到的产物晶体中往往含有Cu(OH)2或Cu2(OH)2SO4杂质,若要减少这类杂质的产生,对该方案应作如何调整?试提供一种你认为可行的方案:___ 。

已知:①[Cu(NH3)4]SO4·H2O为绛蓝色晶体,常温下在空气中易与水和二氧化碳反应,生成铜的碱式盐,使晶体变成绿色粉末。在溶液中存在以下电离(解离)过程:
[Cu(NH3)4]SO4·H2O
 [Cu(NH3)4]2++
[Cu(NH3)4]2++  +H2O;
+H2O;[Cu(NH3)4]2+
 Cu2++4NH3。
Cu2++4NH3。②(NH4)2SO4及[Cu(NH3)4]SO4·H2O)在水中均可溶,在乙醇中均难溶。若在铜氨溶液中加入乙醇,会析出绛蓝色的硫酸四氨合铜晶体;实验表明,若在铜氨溶液中加入硫酸钠或硫酸铵晶体时,同样会有硫酸四氯合铜晶体析出。
③CuSO4溶液在加热条件下可能会生成Cu(OH)2和Cu2(OH)2SO4。
请回答下列问题:
(1)实验室用如图装置制备合成[Cu(NH3)4]SO4·H2O所需的CuSO4溶液。

①仪器a的名称为
②试用文字说明A装置气密性的检验方法
③装置B的加热方法称为水浴加热法,该加热方法的优点为
(2)方案1向溶液3中所加的固体试剂为
(3)方案2的实验步骤为a.加热蒸发,b.冷却溶液,c.加95%乙醇结晶,……
根据方案得到的产物晶体中往往含有Cu(OH)2或Cu2(OH)2SO4杂质,若要减少这类杂质的产生,对该方案应作如何调整?试提供一种你认为可行的方案:
您最近一年使用:0次
【推荐2】超细碳酸锶是重要的无机化工产品。利用锶渣(主要成分SrSO4,含少量CaCO3、Fe2O3、Al2O3、MgCO3等杂质)制备超细碳酸锶的工艺如下:
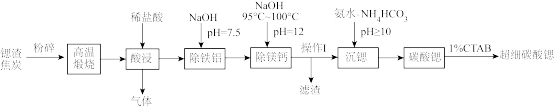
已知:①“高温煅烧”过程中发生的主要反应为:SrSO4+4C SrS+4CO↑
SrS+4CO↑
②Sr(OH)2、Ca(OH)2在不同温度下的溶解度表(g/100mLH2O)
回答下列问题:
(1)“粉碎”的目的是_______
(2)“酸浸”过程中主要反应的化学方程式为_______
(3)“除铁铝”过程中温度控制在75℃左右,适宜的加热方式为_______
(4)“操作I”为_______
(5)①写出“沉锶”的离子方程式_______
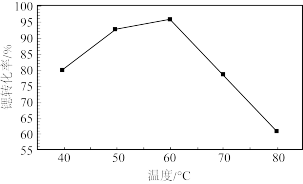
②反应温度对锶转化率的影响如图,温度高于60℃时,“锶转化率”降低的原因为_______ 。
③从平衡移动的角度分析“沉锶”过程中控制pH≥10的原因_______ 。

已知:①“高温煅烧”过程中发生的主要反应为:SrSO4+4C
 SrS+4CO↑
SrS+4CO↑②Sr(OH)2、Ca(OH)2在不同温度下的溶解度表(g/100mLH2O)
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 90 | 100 |
| 氢氧化钙 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | 0.07 |
| 氢氧化锶 | 0.91 | 1.77 | 3.95 | 8.42 | 20.20 | 44.50 | 91.20 |
回答下列问题:
(1)“粉碎”的目的是
(2)“酸浸”过程中主要反应的化学方程式为
(3)“除铁铝”过程中温度控制在75℃左右,适宜的加热方式为
(4)“操作I”为
(5)①写出“沉锶”的离子方程式
②反应温度对锶转化率的影响如图,温度高于60℃时,“锶转化率”降低的原因为

③从平衡移动的角度分析“沉锶”过程中控制pH≥10的原因
您最近一年使用:0次
【推荐3】以铬铁矿为原料[Fe(CrO2)2]可制备 K2Cr2O7和金属铬。实验流程如图:

已知:① +2H+=
+2H+= +H2O。②pH<3.0 时,
+H2O。②pH<3.0 时, 含量极小。
含量极小。
(1)写出铬铁矿焙烧转化为Na2CrO4的化学方程式:____ 。焙烧时不能使用陶瓷容器的原因是_____ 。
(2)加入稀硫酸后所得Na2Cr2O7溶液的pH应小于3.0,可用____ 测定溶液pH。
(3)操作①包括过滤和洗涤。实验室洗涤沉淀的操作是______ 。
(4)Na2S的作用是调节溶液的酸碱度和_____ 。
(5)Fe3+在pH为3.7 时可完全转化为Fe(OH)3。在上述流程中所得Na2Cr2O7溶液中含有少量Fe3+。请结合图中有关物质的溶解度曲线,设计由Na2Cr2O7溶液制备K2Cr2O7固体的实验方案(实验中须选用的试剂:硫酸、NaOH溶液、KCl固体、蒸馏水):______ 。


已知:①
 +2H+=
+2H+= +H2O。②pH<3.0 时,
+H2O。②pH<3.0 时, 含量极小。
含量极小。(1)写出铬铁矿焙烧转化为Na2CrO4的化学方程式:
(2)加入稀硫酸后所得Na2Cr2O7溶液的pH应小于3.0,可用
(3)操作①包括过滤和洗涤。实验室洗涤沉淀的操作是
(4)Na2S的作用是调节溶液的酸碱度和
(5)Fe3+在pH为3.7 时可完全转化为Fe(OH)3。在上述流程中所得Na2Cr2O7溶液中含有少量Fe3+。请结合图中有关物质的溶解度曲线,设计由Na2Cr2O7溶液制备K2Cr2O7固体的实验方案(实验中须选用的试剂:硫酸、NaOH溶液、KCl固体、蒸馏水):

您最近一年使用:0次



