CH4-CO2催化重整不仅可以得到CO和H2,还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g),△H>0
①有利于提高CH4平衡转化率的条件是____ (填字母)。
A高温低压B低温高压C高温高压D低温低压
②在体积恒定的密闭容器中进行该反应并达到平衡状态,若此时改变条件使平衡常数K值变大,该反应___ (填字母)
A.一定向正反应方向移动B.重新达到平衡后正反应速率增大
C.一定向逆反应方向移动D.重新达到平衡后逆反应速率减小
③某温度下,在体积为2L的容器中加入2 mol CH4、1mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,CO2的体积分数为_____
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
①由上表判断,催化剂X___ Y(填“优于”或“劣于”),理由是_______
②在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是___ (填标号)。
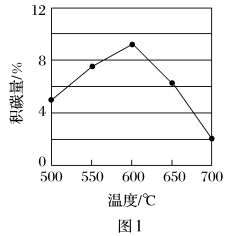
A.K积、K消均增加
B.v积减小、v消增加
C.K积减小、K消增加
D.v消增加的倍数比v积增加的倍数大
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g),△H>0
①有利于提高CH4平衡转化率的条件是
A高温低压B低温高压C高温高压D低温低压
②在体积恒定的密闭容器中进行该反应并达到平衡状态,若此时改变条件使平衡常数K值变大,该反应
A.一定向正反应方向移动B.重新达到平衡后正反应速率增大
C.一定向逆反应方向移动D.重新达到平衡后逆反应速率减小
③某温度下,在体积为2L的容器中加入2 mol CH4、1mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,CO2的体积分数为
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
| 积碳反应 CH4(g)= C(s)+2H2(g) | 消碳反应 CO2(g)+C(s)=2CO(g) | ||
| ΔH/(kJ·mol-1) | +75 | +172 | |
| 活化能(kJ·mol-1) | 催化剂X | 33 | 91 |
| 催化剂Y | 43 | 72 | |
①由上表判断,催化剂X
②在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是

A.K积、K消均增加
B.v积减小、v消增加
C.K积减小、K消增加
D.v消增加的倍数比v积增加的倍数大
更新时间:2020-08-01 10:26:44
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】正误判断
1.在氧气中加热时,金属钠剧烈燃烧,生成淡黄色的固体Na2O2。(_______)
2.金属钠着火时,可用泡沫灭火器或干燥的沙土灭火。(_______)
3.钠表面自然形成的氧化层能够保护内层金属不被空气氧化。(_______)
4.金属钠具有强还原性,可与TiCl4溶液反应制取金属Ti。(_______)
5.根据反应Na+KCl NaCl+K↑,知Na的金属性强于K。(_______)
NaCl+K↑,知Na的金属性强于K。(_______)
6.实验完毕后剩余的金属钠不能随意丢弃,应放回原试剂瓶。(_______)
7.ⅠA族元素又称碱金属元素。(_______)
8.钠、氧化钠、碳酸钠的焰色反应均显黄色。(_______)
1.在氧气中加热时,金属钠剧烈燃烧,生成淡黄色的固体Na2O2。(_______)
2.金属钠着火时,可用泡沫灭火器或干燥的沙土灭火。(_______)
3.钠表面自然形成的氧化层能够保护内层金属不被空气氧化。(_______)
4.金属钠具有强还原性,可与TiCl4溶液反应制取金属Ti。(_______)
5.根据反应Na+KCl
 NaCl+K↑,知Na的金属性强于K。(_______)
NaCl+K↑,知Na的金属性强于K。(_______)6.实验完毕后剩余的金属钠不能随意丢弃,应放回原试剂瓶。(_______)
7.ⅠA族元素又称碱金属元素。(_______)
8.钠、氧化钠、碳酸钠的焰色反应均显黄色。(_______)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】在一固定容积的密闭容器中,进行如下反应:C(s)+H2O(g)  CO(g)+H2(g)
CO(g)+H2(g)
(1)若容器体积为2L,反应l0s氢气质量增加0.4g,则该时间内一氧化碳的反应速率为_______ mol/(L.s)。若增加炭的量,则正反应速率_______ 。(选填“增大”、“减小”、不变)若增大压强,化学平衡向____ 移动。(选填“正向”、“逆向”或“不”)
(2)该反应达到平衡状态的标志是______ 。(选填编号)
A.压强不变 B.v正(H2)=V正(H2O) C.c(CO)不变 D.c(H2O)=c(CO)
(3)若升高温度,平衡向正向移动,则正反应是_______ 反应。(选填“吸热”或“放热”)
 CO(g)+H2(g)
CO(g)+H2(g)(1)若容器体积为2L,反应l0s氢气质量增加0.4g,则该时间内一氧化碳的反应速率为
(2)该反应达到平衡状态的标志是
A.压强不变 B.v正(H2)=V正(H2O) C.c(CO)不变 D.c(H2O)=c(CO)
(3)若升高温度,平衡向正向移动,则正反应是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】Deacon直接氧化法可将HCl转化为Cl2,提高效益,减少污染,反应原理为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。
(1)在一刚性容器中,当进料浓度比c(HCl):c(O2)=4:1时,实验测得HCl平衡转化率随温度变化的α(HCl)—T曲线如图:

①一定温度下,下列选项表明该反应一定达到平衡状态的是_______ (填标号)。
A.HCl与O2的物质的量之比不改变
B.HCl与Cl2的物质的量之比不改变
C. 容器内的压强不再改变
D. 断裂n mol H-Cl键的同时形成n mol H-O键
E. 混合气体的平均相对分子质量不变
②在相同容器中若进料浓度比c(HCl):c(O2)=1:1时,所得α(HCl)—T曲线在曲线AB的_______ 方(填“上”或“下”)。
③温度不变时,进一步提高HCl的转化率的方法是_______ 、_______ (写出2种)。
(2)若在一定温度的刚性容器中投入原料HCl和O2的混合物发生反应,测得反应过程中c(Cl2)的数据如下:
2.0~6.0 min内以HCl表示的反应速率为_______ 。
(3)利用Au/Ag3PO4光催化去除氮氧化物(O2将氮氧化物氧化为NO ),研究表明,不同Au的负载量与氮氧化物的去除效果、催化去除速率常数(用k表示,其他条件不变时,速率常数越大,速率越大)大小的关系分别如图1、图2表示。已知:催化剂的活性与其表面的单位面积活性位点数有关。
),研究表明,不同Au的负载量与氮氧化物的去除效果、催化去除速率常数(用k表示,其他条件不变时,速率常数越大,速率越大)大小的关系分别如图1、图2表示。已知:催化剂的活性与其表面的单位面积活性位点数有关。
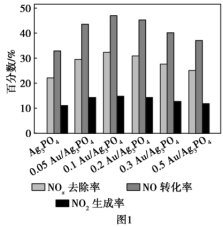
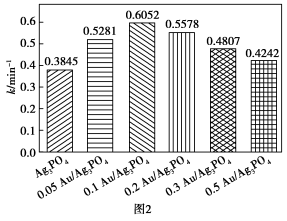
①综合图1、图2可知催化效果最佳的是_______ (填催化剂)。
②图2中表面随着Au的负载量不断增加,反应速率常数先增大后减小,试分析反应速率常数减小的原因是_______
(1)在一刚性容器中,当进料浓度比c(HCl):c(O2)=4:1时,实验测得HCl平衡转化率随温度变化的α(HCl)—T曲线如图:

①一定温度下,下列选项表明该反应一定达到平衡状态的是
A.HCl与O2的物质的量之比不改变
B.HCl与Cl2的物质的量之比不改变
C. 容器内的压强不再改变
D. 断裂n mol H-Cl键的同时形成n mol H-O键
E. 混合气体的平均相对分子质量不变
②在相同容器中若进料浓度比c(HCl):c(O2)=1:1时,所得α(HCl)—T曲线在曲线AB的
③温度不变时,进一步提高HCl的转化率的方法是
(2)若在一定温度的刚性容器中投入原料HCl和O2的混合物发生反应,测得反应过程中c(Cl2)的数据如下:
| t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 10.0 |
| c(Cl2)/10-3 mol·L-1 | 0 | 1.8 | 3.7 | 5.4 | 7.2 | 8.3 |
2.0~6.0 min内以HCl表示的反应速率为
(3)利用Au/Ag3PO4光催化去除氮氧化物(O2将氮氧化物氧化为NO
 ),研究表明,不同Au的负载量与氮氧化物的去除效果、催化去除速率常数(用k表示,其他条件不变时,速率常数越大,速率越大)大小的关系分别如图1、图2表示。已知:催化剂的活性与其表面的单位面积活性位点数有关。
),研究表明,不同Au的负载量与氮氧化物的去除效果、催化去除速率常数(用k表示,其他条件不变时,速率常数越大,速率越大)大小的关系分别如图1、图2表示。已知:催化剂的活性与其表面的单位面积活性位点数有关。

①综合图1、图2可知催化效果最佳的是
②图2中表面随着Au的负载量不断增加,反应速率常数先增大后减小,试分析反应速率常数减小的原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】反应SO2(g)+NO2(g)  SO3(g)+NO(g),若在一定温度下,将物质的量浓度均为2 mol·L-1的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%。则在该温度下:
SO3(g)+NO(g),若在一定温度下,将物质的量浓度均为2 mol·L-1的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%。则在该温度下:
(1)该反应达到平衡状态的标志是___________
A.SO3(g)的生成速率等于SO2(g)的消耗速率
B.混合物的物质的量不再发生变化
C.混合气体的平均摩尔质量不再发生变化
D.混合气体的压强不再发生变化
E.各组分的物质的量分数不再发生变化
(2)此反应在该温度下的平衡常数为___________ 。
(3)在上述温度下,若SO2(g)的初始浓度增大到3 mol·L-1,NO2(g)的初始浓度仍为2 mol·L-1,达到化学平衡状态时,计算下列各物质的平衡浓度及SO2和NO2的平衡转化率。
①c(SO3) =___________ mol·L-1,c(SO2)=___________ mol·L-1。
②SO2的转化率为___________ , NO2的转化率为___________ 。
(4)反应SO2(g)+NO2(g) NO(g)+SO3(g)在一定条件下建立平衡,再加入一定量的O2,下列说法正确的是 ___________ 。
NO(g)+SO3(g)在一定条件下建立平衡,再加入一定量的O2,下列说法正确的是 ___________ 。
①平衡左移,容器内压强不一定增大 ②平衡右移,平衡时容器内压强不一定增大 ③平衡不一定移动,容器内压强一定增大 ④平衡右移,SO2转化率提高
 SO3(g)+NO(g),若在一定温度下,将物质的量浓度均为2 mol·L-1的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%。则在该温度下:
SO3(g)+NO(g),若在一定温度下,将物质的量浓度均为2 mol·L-1的SO2(g)和NO2(g)注入一密闭容器中,当达到平衡状态时,测得容器中SO2(g)的转化率为50%。则在该温度下:(1)该反应达到平衡状态的标志是
A.SO3(g)的生成速率等于SO2(g)的消耗速率
B.混合物的物质的量不再发生变化
C.混合气体的平均摩尔质量不再发生变化
D.混合气体的压强不再发生变化
E.各组分的物质的量分数不再发生变化
(2)此反应在该温度下的平衡常数为
(3)在上述温度下,若SO2(g)的初始浓度增大到3 mol·L-1,NO2(g)的初始浓度仍为2 mol·L-1,达到化学平衡状态时,计算下列各物质的平衡浓度及SO2和NO2的平衡转化率。
①c(SO3) =
②SO2的转化率为
(4)反应SO2(g)+NO2(g)
 NO(g)+SO3(g)在一定条件下建立平衡,再加入一定量的O2,下列说法正确的是 ___________ 。
NO(g)+SO3(g)在一定条件下建立平衡,再加入一定量的O2,下列说法正确的是 ___________ 。①平衡左移,容器内压强不一定增大 ②平衡右移,平衡时容器内压强不一定增大 ③平衡不一定移动,容器内压强一定增大 ④平衡右移,SO2转化率提高
| A.①② | B.②③ | C.③④ | D.②④ |
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
回答下列问题:
(1) 830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1,则6s时c(A)=________ mol·L-1, C的物质的量为______ mol;此时,正反应速率_____________ (填“大于”、“小于”或“等于”)逆反应速率。
(2)在恒容密闭容器中判断该反应是否达到平衡的依据为________ (填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c. c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(3)1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为
A(g)+B(g)的平衡常数的值为___________________ 。
(4)绝热容器不与外界交换能量,在恒容绝热条件下,进行2M(g)+N(g) 2P(g)+Q(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高,简述该反应的平衡常数与温度的变化关系:
2P(g)+Q(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高,简述该反应的平衡常数与温度的变化关系:______________________________________________________________ 。
 C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:| 温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1) 830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1,则6s时c(A)=
(2)在恒容密闭容器中判断该反应是否达到平衡的依据为
a.压强不随时间改变 b.气体的密度不随时间改变
c. c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(3)1200℃时反应C(g)+D(g)
 A(g)+B(g)的平衡常数的值为
A(g)+B(g)的平衡常数的值为(4)绝热容器不与外界交换能量,在恒容绝热条件下,进行2M(g)+N(g)
 2P(g)+Q(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高,简述该反应的平衡常数与温度的变化关系:
2P(g)+Q(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高,简述该反应的平衡常数与温度的变化关系:| 物 质 | M | N | P | Q |
| 起始投料/mol | 2 | 1 | 2 | 0 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】向某体积固定的密闭容器中加入0.3molA、0.1molC和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的压强没有变化。请回答:

(1)若 ,则
,则 内反应速率
内反应速率
___________ ,A的转化率为___________ ;
(2)写出反应的化学方程式:___________ ;
(3)B的起始的物质的量是___________ mol;
(4)判断反应达到平衡状态的标志是___________。

(1)若
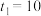 ,则
,则 内反应速率
内反应速率
(2)写出反应的化学方程式:
(3)B的起始的物质的量是
(4)判断反应达到平衡状态的标志是___________。
A. | B.混合气体的密度保持不变 |
| C.混合气体的平均分子量不变 | D.气体B的浓度保持不变 |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】“丁烯裂解法”是一种重要的丙烯生产法,生产过程中会有生成乙烯的副反应发生。反应如下:
主反应: ;
;
副反应: 。
。
测得上述两反应的平衡体系中,各组分的质量分数(w%)随温度(T)和压强(p)变化的趋势分别如图1和图2所示:

(1)平衡体系中的丙烯和乙烯的质量比[ ]是工业生产丙烯时选择反应条件的重要指标之一,从产物的纯度考虑,该数值越高越好,从图1和图2中表现的趋势来看,下列反应条件最适宜的是_______(填字母序号)。
]是工业生产丙烯时选择反应条件的重要指标之一,从产物的纯度考虑,该数值越高越好,从图1和图2中表现的趋势来看,下列反应条件最适宜的是_______(填字母序号)。
(2)有研究者结合图1数据并综合考虑各种因素,认为450℃的反应温度比300℃或700℃更合适,从反应原理角度分析其理由可能是_______ 。
(3)图2中,随压强增大,平衡体系中丙烯的质量分数呈上升趋势,从平衡角度解释其原因是_______ 。
(4)353K时,在刚性容器中充入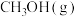 ,发生反应:
,发生反应: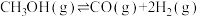 。体系的总压强p随时间t的变化如表所示。
。体系的总压强p随时间t的变化如表所示。
①若升高反应温度至373K,则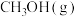 分解后体系压强
分解后体系压强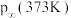
_______ 121.2kPa(填“大于”“小于”或“等于”),原因是_______ 。
②353K时,当该反应达到平衡后,继续充入少量CO(g),反应经过一段时候后重新达到平衡,此时与旧平衡相比,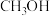 的体积分数
的体积分数_______ (增大、减小或不变)。
主反应:
 ;
;副反应:
 。
。测得上述两反应的平衡体系中,各组分的质量分数(w%)随温度(T)和压强(p)变化的趋势分别如图1和图2所示:

(1)平衡体系中的丙烯和乙烯的质量比[
 ]是工业生产丙烯时选择反应条件的重要指标之一,从产物的纯度考虑,该数值越高越好,从图1和图2中表现的趋势来看,下列反应条件最适宜的是_______(填字母序号)。
]是工业生产丙烯时选择反应条件的重要指标之一,从产物的纯度考虑,该数值越高越好,从图1和图2中表现的趋势来看,下列反应条件最适宜的是_______(填字母序号)。| A.300℃ 0.1MPa | B.700℃ 0.1MPa |
| C.300℃ 0.5MPa | D.700℃ 0.5MPa |
(3)图2中,随压强增大,平衡体系中丙烯的质量分数呈上升趋势,从平衡角度解释其原因是
(4)353K时,在刚性容器中充入
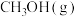 ,发生反应:
,发生反应: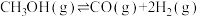 。体系的总压强p随时间t的变化如表所示。
。体系的总压强p随时间t的变化如表所示。| t/min | 0 | 5 | 10 | 15 | 20 |  |
| p/kPa | 101.2 | 107.4 | 112.6 | 116.4 | 118.6 | 121.2 |
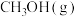 分解后体系压强
分解后体系压强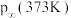
②353K时,当该反应达到平衡后,继续充入少量CO(g),反应经过一段时候后重新达到平衡,此时与旧平衡相比,
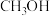 的体积分数
的体积分数
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】硫酸是一种重要的基础化工产品,接触法制硫酸生产中的关键工序是 的催化氧化:
的催化氧化: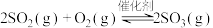
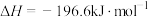 。回答下列问题。
。回答下列问题。
(1)某温度下,在体积为 的刚性密闭容器中投入
的刚性密闭容器中投入 和
和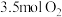 ,下图是
,下图是 和
和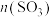 随时间的变化曲线。
随时间的变化曲线。

①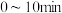 ,
,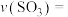
___________ 。
②反应达到平衡时,平衡常数
___________  。(保留3位有效数字)
。(保留3位有效数字)
③下列情况不能说明反应达到化学平衡状态的是___________ 。
A. B.混合气体的相对分子质量不再变化
B.混合气体的相对分子质量不再变化
C.体系的压强不再发生改变 D.混合气体的密度保持不变
(2)下表列出了在不同温度和压强下,反应达到平衡时 的转化率。
的转化率。
①仅从表中数据可得出最优的条件是___________ 。
②在实际生产中,选定的温度为400~500℃和常压(0.1MPa),原因是___________ 。
(3)当 、
、 和
和 起始的物质的量分数分别为7.5%、10.5%和82%时,在
起始的物质的量分数分别为7.5%、10.5%和82%时,在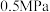 、
、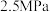 和
和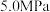 压强下,
压强下, 平衡转化率
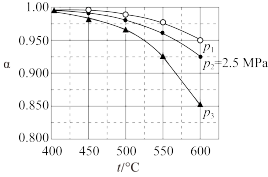
平衡转化率 随温度的变化如下图所示。反应在
随温度的变化如下图所示。反应在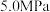 、550℃时的
、550℃时的
___________ ,影响 的因素有温度、压强和
的因素有温度、压强和___________ 。
 的催化氧化:
的催化氧化: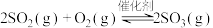
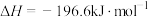 。回答下列问题。
。回答下列问题。(1)某温度下,在体积为
 的刚性密闭容器中投入
的刚性密闭容器中投入 和
和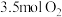 ,下图是
,下图是 和
和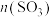 随时间的变化曲线。
随时间的变化曲线。
①
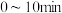 ,
,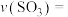
②反应达到平衡时,平衡常数

 。(保留3位有效数字)
。(保留3位有效数字)③下列情况不能说明反应达到化学平衡状态的是
A.
 B.混合气体的相对分子质量不再变化
B.混合气体的相对分子质量不再变化C.体系的压强不再发生改变 D.混合气体的密度保持不变
(2)下表列出了在不同温度和压强下,反应达到平衡时
 的转化率。
的转化率。| 温度/℃ | 平衡时 的转化率/% 的转化率/% | ||||
 | 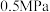 |  |  | 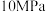 | |
| 450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
②在实际生产中,选定的温度为400~500℃和常压(0.1MPa),原因是
(3)当
 、
、 和
和 起始的物质的量分数分别为7.5%、10.5%和82%时,在
起始的物质的量分数分别为7.5%、10.5%和82%时,在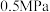 、
、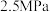 和
和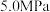 压强下,
压强下, 平衡转化率
平衡转化率 随温度的变化如下图所示。反应在
随温度的变化如下图所示。反应在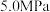 、550℃时的
、550℃时的
 的因素有温度、压强和
的因素有温度、压强和
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】工业上用硫铁矿为主要原料抽取硫酸,主要设备有沸腾米,接触室和吸引塔。
(1)硫铁矿在进入沸腾炉前需要粉碎,其目的是_____________________ 。
(2)为了充分利用反应放出的热量,接触室中应安装_______ (填设备名称);吸引塔中填充许多瓷管,其作用是______________________________________________ 。
(3)吸收塔排放的尾气中含有少量的SO ,防止污染大气、充分利用原料,在排放前必须进行尾气处理并设法进行综合利用。
,防止污染大气、充分利用原料,在排放前必须进行尾气处理并设法进行综合利用。
传统的方法是:尾气中的SO 通常用足量氨水吸收,然后再用稀硫酸处理,写出上述过程中的化学反应方程式:
通常用足量氨水吸收,然后再用稀硫酸处理,写出上述过程中的化学反应方程式:________________________________ ,其优点是________________ 。
创新方法是:将尾气中的SO 用Na
用Na SO
SO 溶液吸收,然后再加热所得溶液,写出上述过程中的化学反应方程式:
溶液吸收,然后再加热所得溶液,写出上述过程中的化学反应方程式:________________________________ ,创新方法与传统方法相比,其优点是_______________ 。
(4)在硫酸的工业制法中,下列生产操作及说法生产操作的主要原因二者都正确的是__ (填序号)
(5)某硫酸厂若要生产8吨98%的浓硫酸至少需要标准状况下的空气_____ m ( O
( O 空气中的体积分数按20%计算)。
空气中的体积分数按20%计算)。
(1)硫铁矿在进入沸腾炉前需要粉碎,其目的是
(2)为了充分利用反应放出的热量,接触室中应安装
(3)吸收塔排放的尾气中含有少量的SO
 ,防止污染大气、充分利用原料,在排放前必须进行尾气处理并设法进行综合利用。
,防止污染大气、充分利用原料,在排放前必须进行尾气处理并设法进行综合利用。传统的方法是:尾气中的SO
 通常用足量氨水吸收,然后再用稀硫酸处理,写出上述过程中的化学反应方程式:
通常用足量氨水吸收,然后再用稀硫酸处理,写出上述过程中的化学反应方程式:创新方法是:将尾气中的SO
 用Na
用Na SO
SO 溶液吸收,然后再加热所得溶液,写出上述过程中的化学反应方程式:
溶液吸收,然后再加热所得溶液,写出上述过程中的化学反应方程式:(4)在硫酸的工业制法中,下列生产操作及说法生产操作的主要原因二者都正确的是
A.从沸腾炉出来的炉气需净化,因为炉气中的SO 与杂质反应 与杂质反应 |
B.硫酸生产中常采用高压条件,目的是提高SO 的转化率 的转化率 |
C.SO 被氧化为SO 被氧化为SO 时需要使用催化剂,这样可以提高SO 时需要使用催化剂,这样可以提高SO 的转化率 的转化率 |
D.SO 用98.3%浓硫酸吸收,目的是防止形成酸雾,有利于SO 用98.3%浓硫酸吸收,目的是防止形成酸雾,有利于SO 吸收完全 吸收完全 |
(5)某硫酸厂若要生产8吨98%的浓硫酸至少需要标准状况下的空气
 ( O
( O 空气中的体积分数按20%计算)。
空气中的体积分数按20%计算)。
您最近一年使用:0次



