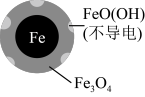
用零价铁(Fe)去除水体中的硝酸盐( )已成为环境修复研究的热点之一。
)已成为环境修复研究的热点之一。
(1)Fe还原水体中 的反应原理如图所示。
的反应原理如图所示。

①作负极的物质化学式为___________ 。
②正极的电极反应式是_____________ 。
(2)将足量铁粉投入水体中,经24小时测定 的去除率和pH,结果如下:
的去除率和pH,结果如下:
pH=4.5时, 的去除率低。其原因是
的去除率低。其原因是_________________ 。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高 的去除率。对Fe2+的作用提出两种假设:
的去除率。对Fe2+的作用提出两种假设:
I.Fe2+直接还原 ;
;
II.Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图所示,可得到的结论是_________ 。
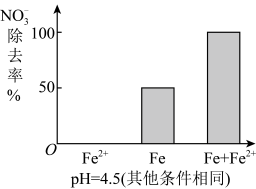
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4,该反应的离子方程式为_________ ,解释加入Fe2+提高 去除率的原因:
去除率的原因:___________ 。
 )已成为环境修复研究的热点之一。
)已成为环境修复研究的热点之一。(1)Fe还原水体中
 的反应原理如图所示。
的反应原理如图所示。
①作负极的物质化学式为
②正极的电极反应式是
(2)将足量铁粉投入水体中,经24小时测定
 的去除率和pH,结果如下:
的去除率和pH,结果如下:初始pH | pH=2.5 | pH=4.5 |
| 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
 的去除率低。其原因是
的去除率低。其原因是(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高
 的去除率。对Fe2+的作用提出两种假设:
的去除率。对Fe2+的作用提出两种假设:I.Fe2+直接还原
 ;
;II.Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图所示,可得到的结论是
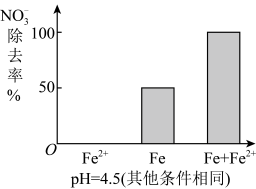
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4,该反应的离子方程式为
 去除率的原因:
去除率的原因:
2020高三·全国·专题练习 查看更多[5]
(已下线)第12讲 氮及其化合物-2021年高考化学一轮复习名师精讲练河南省南阳市六校2022-2023学年高二上学期第一次月考化学试题 (已下线)江苏省南京市、盐城市2021-2022学年高三第一次模拟考试(原理综合题)(已下线)江苏省南京市、盐城市2021-2022学年高三第一次模拟考试(反应原理-氧化还原反应)(已下线)江苏省南京市、盐城市2021-2022学年高三第一次模拟考试(原理综合题)
更新时间:2020-08-10 10:54:51
|
相似题推荐
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐1】利用下图可以从不同角度研究含氮物质的性质及其转化关系。图中甲~辛均含氮元素。回答下列问题:

(1)下列给出的图中物质之间的转化可以一步实现的是__________ 。
A.甲→丁 B.乙→丁 C.丁→戊 D.戊→丙
(2)下列说法正确的是____________ 。
A.丙和丁在一定条件下都能生成戊,属于酸性氧化物
B.“甲→乙→丙→丁→戊”就是工业制戊的转化过程
C.己和辛在一定条件下都可与固体NaOH作用生成乙,其生成乙的原理相同
D.如果庚和辛为同种物质,则可由乙和戊反应制得
(3)氯碱工业生产中常用乙检查氯气管道是否泄漏,其现象为______________________ 。已知反应过程中还有甲生成,该反应的化学方程式为______________________________ 。
(4)已知铁与过量戊的溶液反应,其反应的化学方程式为:Fe+戊→丙+丁+庚+H2O(方程式未配平)。若产物中丙和丁的物质的量之比为1:3,则铁与戊的物质的量之比为_________ 。若检验庚中铁元素的价态,可选用的试剂为_________ ,反应的离子方程式为___________ 。

(1)下列给出的图中物质之间的转化可以一步实现的是
A.甲→丁 B.乙→丁 C.丁→戊 D.戊→丙
(2)下列说法正确的是
A.丙和丁在一定条件下都能生成戊,属于酸性氧化物
B.“甲→乙→丙→丁→戊”就是工业制戊的转化过程
C.己和辛在一定条件下都可与固体NaOH作用生成乙,其生成乙的原理相同
D.如果庚和辛为同种物质,则可由乙和戊反应制得
(3)氯碱工业生产中常用乙检查氯气管道是否泄漏,其现象为
(4)已知铁与过量戊的溶液反应,其反应的化学方程式为:Fe+戊→丙+丁+庚+H2O(方程式未配平)。若产物中丙和丁的物质的量之比为1:3,则铁与戊的物质的量之比为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】某化学兴趣小组利用铜跟浓硫酸反应,探究SO2的部分性质,实验装置如图所示。
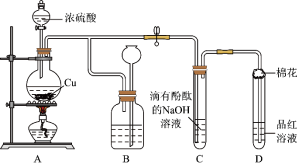
(1)装置A中发生的化学反应的化学方程式为________________________________ 。
(2)装置B的作用是贮存多余的气体,B中广口瓶内应盛放的液体是________ (填序号);
①水 ②饱和的NaHSO3溶液 ③NaOH溶液 ④酸性KMnO4
(3)装置C和D中产生的现象相同,但原因却不同。C中是由于SO2与溶液中的NaOH反应使碱性减弱,而D中则是由于SO2具有____________ 性。
(4)装置D中试管口塞一团棉花,棉花中应浸有一种液体,其作用是____________ 。
(5)若实验中用一定质量的铜片和25.0 mL 18.0 mol·L-1的浓硫酸在加热条件充分反应,最终铜片与硫酸均有剩余。假定反应前后溶液的体积不变,设剩余硫酸的浓度为d mol·L-1,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾____________ mol(用含d的代数式表示)。
(6)SO2气体为无色气体,有强烈刺激性气味,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2可以使用的药品和装置如图所示:
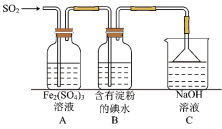
在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下实验:
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案不合理的是_________ ,(填①或②)不合理的原因是____________ 。
(7)在上述装置中能表明SO2的还原性强于I2的现象是____________ 。

(1)装置A中发生的化学反应的化学方程式为
(2)装置B的作用是贮存多余的气体,B中广口瓶内应盛放的液体是
①水 ②饱和的NaHSO3溶液 ③NaOH溶液 ④酸性KMnO4
(3)装置C和D中产生的现象相同,但原因却不同。C中是由于SO2与溶液中的NaOH反应使碱性减弱,而D中则是由于SO2具有
(4)装置D中试管口塞一团棉花,棉花中应浸有一种液体,其作用是
(5)若实验中用一定质量的铜片和25.0 mL 18.0 mol·L-1的浓硫酸在加热条件充分反应,最终铜片与硫酸均有剩余。假定反应前后溶液的体积不变,设剩余硫酸的浓度为d mol·L-1,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾
(6)SO2气体为无色气体,有强烈刺激性气味,是大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2可以使用的药品和装置如图所示:

在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下实验:
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案不合理的是
(7)在上述装置中能表明SO2的还原性强于I2的现象是
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
【推荐3】Ⅰ.现有某固体混合物,可能由Fe3O4、Fe、K2CO3、K2SO3、SiO2、Na2SO4、BaCl2中的若干种物质组成,设计部分实验方案探究该固体混合物的成分(如图),所加试剂均过量。

回答下列问题:
(1)气体A中一定含有___________ (写化学式),白色沉淀B为___________ 。
(2)该固体混合物中一定含有___________ ,可能含有___________ 。
(3)写出气体A通入KMnO4(H+)后,气体体积缩小所发生反应的离子方程式___________ 。
(4)写出白色沉淀B放置在空气中发生反应的化学方程式___________ 。
Ⅱ.某溶液中只可能含有K+、NH 、Fe2+、Al3+、Cl-、SO
、Fe2+、Al3+、Cl-、SO 、CO
、CO 、AlO
、AlO 中的若干种离子,离子浓度均为0.1mol/L。某同学进行了如下实验:
中的若干种离子,离子浓度均为0.1mol/L。某同学进行了如下实验:
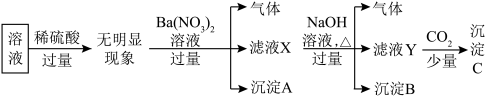
回答下列问题:
(5)原溶液中一定不存在含的离子是___________ 。
(6)沉淀C的成分是___________ 。
(7)写出加入过量Ba(NO3)2时产生气体的离子方程式___________ ,检验产物中的阳离子所用试剂为___________ ,现象___________ 。
(8)是否需要通过焰色试验来确定K+的存在?___________ (填“是”或“否”)。

回答下列问题:
(1)气体A中一定含有
(2)该固体混合物中一定含有
(3)写出气体A通入KMnO4(H+)后,气体体积缩小所发生反应的离子方程式
(4)写出白色沉淀B放置在空气中发生反应的化学方程式
Ⅱ.某溶液中只可能含有K+、NH
 、Fe2+、Al3+、Cl-、SO
、Fe2+、Al3+、Cl-、SO 、CO
、CO 、AlO
、AlO 中的若干种离子,离子浓度均为0.1mol/L。某同学进行了如下实验:
中的若干种离子,离子浓度均为0.1mol/L。某同学进行了如下实验:
回答下列问题:
(5)原溶液中一定不存在含的离子是
(6)沉淀C的成分是
(7)写出加入过量Ba(NO3)2时产生气体的离子方程式
(8)是否需要通过焰色试验来确定K+的存在?
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】 过度排放会引起气候、环境等问题。在Cu/ZnO催化剂下,
过度排放会引起气候、环境等问题。在Cu/ZnO催化剂下, 和
和 可发生反应生成
可发生反应生成 和CO,热化学方程式如下:
和CO,热化学方程式如下:
Ⅰ.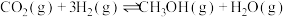
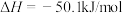
Ⅱ.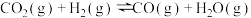
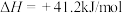
(1)已知: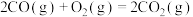
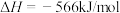

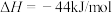
写出表示氢气燃烧热的热化学方程式___________ 。
(2)在一定温度下,向体积固定的密闭容器中通入 和
和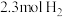 ,起始压强为0.33MPa,发生反应Ⅰ和Ⅱ。平衡时,总压为0.25MPa,
,起始压强为0.33MPa,发生反应Ⅰ和Ⅱ。平衡时,总压为0.25MPa, 的转化率为50%,则反应Ⅰ的平衡常数
的转化率为50%,则反应Ⅰ的平衡常数
___________  (以分压表示,分压=总压×物质的量分数)
(以分压表示,分压=总压×物质的量分数)
(3)不同压强下,维持投料比相同,实验测定 的平衡转化率随温度的变化关系如图1所示。在恒压密闭容器中,维持投料比相同,将
的平衡转化率随温度的变化关系如图1所示。在恒压密闭容器中,维持投料比相同,将 和
和 按一定的流速通过反应器,二氧化碳的转化率
按一定的流速通过反应器,二氧化碳的转化率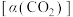 和甲醇的选择性 [
和甲醇的选择性 [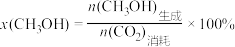 ]随温度变化关系如图2所示。图示温度范围催化剂的活性受温度影响不大。
]随温度变化关系如图2所示。图示温度范围催化剂的活性受温度影响不大。

①下列说法不正确 的是___________ 。
A.图1中,
B.图1中550℃后以反应Ⅱ为主,反应Ⅱ前后气体分子数相等,压强改变对平衡基本没有影响
C.图2中236℃后,升温使反应Ⅰ平衡逆向移动的程度大于反应Ⅱ平衡正向移动程度,使 转化率和
转化率和 选择性都下降
选择性都下降
D.改用活性更好的催化剂能使图2中各温度下 转化率都增大
转化率都增大
②假设只发生反应Ⅰ,一定温度下氢气和二氧化碳的物质的量之比为n:1,相应平衡体系中甲醇的物质的量分数为y,请在图3中绘制y随n变化的示意图。___________

(4)在密闭容器中,维持其他条件不变,在不同的压强下发生反应Ⅰ和Ⅱ,二氧化碳的平衡转化率和甲醇的选择性随压强变化关系如下表所示。 随压强增大而
随压强增大而___________ (填“增大”“减小”或“不变”),从化学平衡移动角度解释原因___________ 。
 过度排放会引起气候、环境等问题。在Cu/ZnO催化剂下,
过度排放会引起气候、环境等问题。在Cu/ZnO催化剂下, 和
和 可发生反应生成
可发生反应生成 和CO,热化学方程式如下:
和CO,热化学方程式如下:Ⅰ.
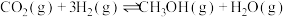
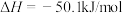
Ⅱ.
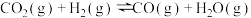
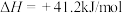
(1)已知:
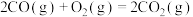
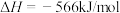

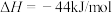
写出表示氢气燃烧热的热化学方程式
(2)在一定温度下,向体积固定的密闭容器中通入
 和
和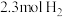 ,起始压强为0.33MPa,发生反应Ⅰ和Ⅱ。平衡时,总压为0.25MPa,
,起始压强为0.33MPa,发生反应Ⅰ和Ⅱ。平衡时,总压为0.25MPa, 的转化率为50%,则反应Ⅰ的平衡常数
的转化率为50%,则反应Ⅰ的平衡常数
 (以分压表示,分压=总压×物质的量分数)
(以分压表示,分压=总压×物质的量分数)(3)不同压强下,维持投料比相同,实验测定
 的平衡转化率随温度的变化关系如图1所示。在恒压密闭容器中,维持投料比相同,将
的平衡转化率随温度的变化关系如图1所示。在恒压密闭容器中,维持投料比相同,将 和
和 按一定的流速通过反应器,二氧化碳的转化率
按一定的流速通过反应器,二氧化碳的转化率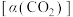 和甲醇的选择性 [
和甲醇的选择性 [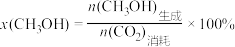 ]随温度变化关系如图2所示。图示温度范围催化剂的活性受温度影响不大。
]随温度变化关系如图2所示。图示温度范围催化剂的活性受温度影响不大。
①下列说法
A.图1中,

B.图1中550℃后以反应Ⅱ为主,反应Ⅱ前后气体分子数相等,压强改变对平衡基本没有影响
C.图2中236℃后,升温使反应Ⅰ平衡逆向移动的程度大于反应Ⅱ平衡正向移动程度,使
 转化率和
转化率和 选择性都下降
选择性都下降D.改用活性更好的催化剂能使图2中各温度下
 转化率都增大
转化率都增大②假设只发生反应Ⅰ,一定温度下氢气和二氧化碳的物质的量之比为n:1,相应平衡体系中甲醇的物质的量分数为y,请在图3中绘制y随n变化的示意图。

(4)在密闭容器中,维持其他条件不变,在不同的压强下发生反应Ⅰ和Ⅱ,二氧化碳的平衡转化率和甲醇的选择性随压强变化关系如下表所示。
 随压强增大而
随压强增大而| 压强P(MPa) | 1 | 2 | 3 | 4 | 5 | 6 |
 的平衡转化率% 的平衡转化率% | 8.1 | 15.3 | 22.2 | 29.5 | 36.1 | 43.2 |
 的选择性% 的选择性% | 49.5 | 80.1 | 90.0 | 94.5 | 97.1 | 98.6 |
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】碳及化合物在生产生活中用比较广泛。回答下列问题:
(1)已知:①H2(g)+ O2(g)=H2O(1)△H1=-285.8kJ·mol-1
O2(g)=H2O(1)△H1=-285.8kJ·mol-1
②CH3OH(1)+ O2(g)=CO2(g)+2H2O(1) △H2=-725.5kJ·mol-1
O2(g)=CO2(g)+2H2O(1) △H2=-725.5kJ·mol-1
则CO2(g)+3H2(g)=CH2OH(1)+H2O(1)的反应热 △H=____________ 。
(2)某研究小组用CO合成甲醇:CO(g)+2H2(g) CH3OH(g)△H<0,将三组混合气体分别通入到三个2L恒容密闭容器中进行反应,得到如下三组实验数据:
CH3OH(g)△H<0,将三组混合气体分别通入到三个2L恒容密闭容器中进行反应,得到如下三组实验数据:
实验1条件下平衡常数K=__________ ,a、b之间可能的关系为_____________ 。
已知反应CO(g)+2H2(g) CH3OH(g)中CO的转化率(a)与温度(T)、压强(p)的关系如右图所示:
CH3OH(g)中CO的转化率(a)与温度(T)、压强(p)的关系如右图所示:
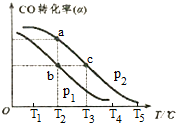
①p1______ p2(填“<”“>”“=”)。先升高温度、后增大压强,能否实现b点到c点的转化?__________ (填“能”或“不能”),原因是_____________________________________________ 。
②a、c两点的反应速率为v1________ v2(填“<”“>”“=”)。
③在不改变反应物用量情况下,为提高CO的转化率可采取的措施是_____________ (答出三条措施)。
(1)已知:①H2(g)+
 O2(g)=H2O(1)△H1=-285.8kJ·mol-1
O2(g)=H2O(1)△H1=-285.8kJ·mol-1②CH3OH(1)+
 O2(g)=CO2(g)+2H2O(1) △H2=-725.5kJ·mol-1
O2(g)=CO2(g)+2H2O(1) △H2=-725.5kJ·mol-1则CO2(g)+3H2(g)=CH2OH(1)+H2O(1)的反应热 △H=
(2)某研究小组用CO合成甲醇:CO(g)+2H2(g)
 CH3OH(g)△H<0,将三组混合气体分别通入到三个2L恒容密闭容器中进行反应,得到如下三组实验数据:
CH3OH(g)△H<0,将三组混合气体分别通入到三个2L恒容密闭容器中进行反应,得到如下三组实验数据:| 实验组 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | 达到平衡所需的时间/min | ||||
| CO | H2 | CH3OH | CO | H2 | CH3OH | |||
| 1 | 650 | 2.0 | 6.0 | 0 | 1.0 | 5 | ||
| 2 | 900 | 2.0 | 6.0 | 0 | 1.2 | 2 | ||
| 3 | 650 | 1.0 | 4.0 | 2.0 | a | b | c | t |
实验1条件下平衡常数K=
已知反应CO(g)+2H2(g)
 CH3OH(g)中CO的转化率(a)与温度(T)、压强(p)的关系如右图所示:
CH3OH(g)中CO的转化率(a)与温度(T)、压强(p)的关系如右图所示:
①p1
②a、c两点的反应速率为v1
③在不改变反应物用量情况下,为提高CO的转化率可采取的措施是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】以 为代表的温室气体大量排放易导致极端天气的出现,减少碳排放,推进碳中和,提升
为代表的温室气体大量排放易导致极端天气的出现,减少碳排放,推进碳中和,提升 的综合利用技术,降低空气中
的综合利用技术,降低空气中 的含量显得刻不容缓。目前
的含量显得刻不容缓。目前 的综合利用技术常用的有如下三种:
的综合利用技术常用的有如下三种:
一、光催化技术
(1)中国广州分析测试中心研究团队在温和条件下用 合成
合成 ,方程式为:
,方程式为: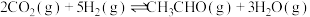
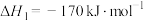
已知生成乙醛的净反应速率为 (
( 、
、 分别表示正、逆反应速率常数)。若在某一温度下
分别表示正、逆反应速率常数)。若在某一温度下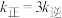 ,则此温度下,上述反应的平衡常数
,则此温度下,上述反应的平衡常数
__________ 。
二、电化学技术
(2)研究证明 也可在熔融碳酸钠中通过电解生成
也可在熔融碳酸钠中通过电解生成 ,收集
,收集 可进行其他有机类合成,化废为宝。则生成
可进行其他有机类合成,化废为宝。则生成 的电极反应式是
的电极反应式是____________________ 。
三、化学催化技术
恒温、体积不变的密闭容器中,加入一定量的 和
和 ,在催化剂下同时发生反应Ⅰ、Ⅱ。
,在催化剂下同时发生反应Ⅰ、Ⅱ。
反应Ⅰ
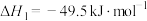
反应Ⅱ
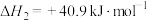
回答下列问题:
(3)下列说法不正确 的是__________。
(4)其他条件相同,仅改变容器体积,实验测得 的平衡产率随着压强的增加而减少,可能原因是
的平衡产率随着压强的增加而减少,可能原因是________________ 。
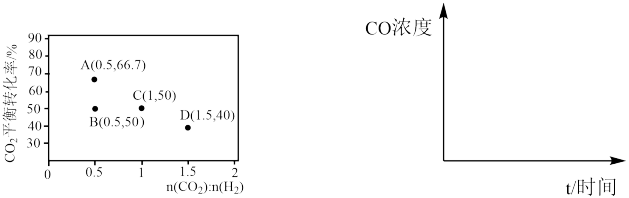
(5)在一定条件下,选择合适的催化剂只进行反应Ⅱ,调整 和
和 初始投料比,测得在一定投料比和一定温度下,
初始投料比,测得在一定投料比和一定温度下, 的平衡转化率如图所示(各点对应的反应温度可能相同,也可能不同)。
的平衡转化率如图所示(各点对应的反应温度可能相同,也可能不同)。
①C、D二点对应的反应温度 、
、 的关系是
的关系是__________ 。
②A、B两点的起始浓度相同,请分别在如图定性画出CO浓度随时间的变化关系,请在曲线上标明 和
和
_______ 。
 为代表的温室气体大量排放易导致极端天气的出现,减少碳排放,推进碳中和,提升
为代表的温室气体大量排放易导致极端天气的出现,减少碳排放,推进碳中和,提升 的综合利用技术,降低空气中
的综合利用技术,降低空气中 的含量显得刻不容缓。目前
的含量显得刻不容缓。目前 的综合利用技术常用的有如下三种:
的综合利用技术常用的有如下三种:一、光催化技术
(1)中国广州分析测试中心研究团队在温和条件下用
 合成
合成 ,方程式为:
,方程式为:
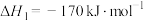
已知生成乙醛的净反应速率为
 (
( 、
、 分别表示正、逆反应速率常数)。若在某一温度下
分别表示正、逆反应速率常数)。若在某一温度下 ,则此温度下,上述反应的平衡常数
,则此温度下,上述反应的平衡常数
二、电化学技术
(2)研究证明
 也可在熔融碳酸钠中通过电解生成
也可在熔融碳酸钠中通过电解生成 ,收集
,收集 可进行其他有机类合成,化废为宝。则生成
可进行其他有机类合成,化废为宝。则生成 的电极反应式是
的电极反应式是三、化学催化技术
恒温、体积不变的密闭容器中,加入一定量的
 和
和 ,在催化剂下同时发生反应Ⅰ、Ⅱ。
,在催化剂下同时发生反应Ⅰ、Ⅱ。反应Ⅰ

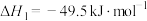
反应Ⅱ

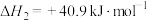
回答下列问题:
(3)下列说法
A.反应Ⅰ的活化能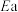 大于反应Ⅱ 大于反应Ⅱ | B.容器内压强不变时可以判断反应达到平衡 |
C.该温度下,反应Ⅱ的 大于零 大于零 | D.使用性能更佳的催化剂可以提高 平衡转化率 平衡转化率 |
 的平衡产率随着压强的增加而减少,可能原因是
的平衡产率随着压强的增加而减少,可能原因是(5)在一定条件下,选择合适的催化剂只进行反应Ⅱ,调整
 和
和 初始投料比,测得在一定投料比和一定温度下,
初始投料比,测得在一定投料比和一定温度下, 的平衡转化率如图所示(各点对应的反应温度可能相同,也可能不同)。
的平衡转化率如图所示(各点对应的反应温度可能相同,也可能不同)。①C、D二点对应的反应温度
 、
、 的关系是
的关系是②A、B两点的起始浓度相同,请分别在如图定性画出CO浓度随时间的变化关系,请在曲线上标明
 和
和

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】砷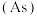 是第四周期ⅤA族元素,可以形成
是第四周期ⅤA族元素,可以形成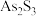 、
、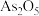 、
、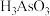 、
、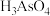 等 化合物,有着广泛的用途
等 化合物,有着广泛的用途 回答下列问题:
回答下列问题:
(1)写出砷的原子序数______________
(2)工业上常将含砷废渣 主要成分为
主要成分为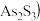 制成浆状,通入
制成浆状,通入 氧化,生成
氧化,生成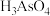 和单质硫
和单质硫 写出发生反应的化学方程式
写出发生反应的化学方程式 _____________________________________________  该反应需要在加压下进行,原因是
该反应需要在加压下进行,原因是 _______________________________________
(3)已知: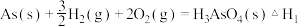
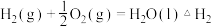
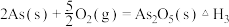
则反应 的
的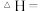
________________________
(4)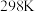 时,将
时,将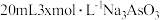 、
、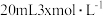
 和20mL NaOH溶液混合,发生反应:
和20mL NaOH溶液混合,发生反应: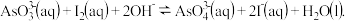 溶液中
溶液中 与反应时间
与反应时间 的关系如图所示.
的关系如图所示.
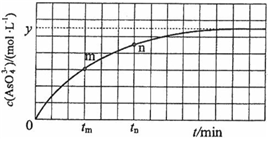
①下列可判断反应达到平衡的是______  填标号
填标号 .
.
 溶液的pH不再变化
溶液的pH不再变化 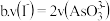
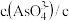
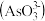 不再变化
不再变化 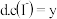
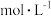
②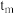 时,
时,
______  填“大于”“小于”或“等于”
填“大于”“小于”或“等于”
③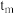 时,
时,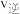
______  时
时 填“大于”“小于”或“等于”
填“大于”“小于”或“等于” ,理由是
,理由是 ____________________
④若平衡时溶液的 ,则该反应的平衡常数K为
,则该反应的平衡常数K为 ______________
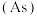 是第四周期ⅤA族元素,可以形成
是第四周期ⅤA族元素,可以形成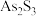 、
、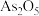 、
、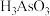 、
、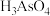 等 化合物,有着广泛的用途
等 化合物,有着广泛的用途 回答下列问题:
回答下列问题:(1)写出砷的原子序数
(2)工业上常将含砷废渣
 主要成分为
主要成分为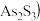 制成浆状,通入
制成浆状,通入 氧化,生成
氧化,生成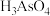 和单质硫
和单质硫 写出发生反应的化学方程式
写出发生反应的化学方程式  该反应需要在加压下进行,原因是
该反应需要在加压下进行,原因是 (3)已知:
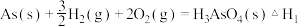
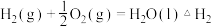
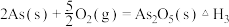
则反应
 的
的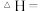
(4)
 时,将
时,将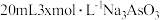 、
、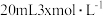
 和20mL NaOH溶液混合,发生反应:
和20mL NaOH溶液混合,发生反应: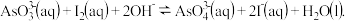 溶液中
溶液中 与反应时间
与反应时间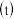 的关系如图所示.
的关系如图所示.
①下列可判断反应达到平衡的是
 填标号
填标号 .
. 溶液的pH不再变化
溶液的pH不再变化 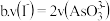
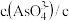
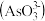 不再变化
不再变化 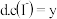
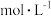
②
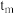 时,
时,
 填“大于”“小于”或“等于”
填“大于”“小于”或“等于”
③
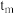 时,
时,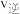
 时
时 填“大于”“小于”或“等于”
填“大于”“小于”或“等于” ,理由是
,理由是 ④若平衡时溶液的
 ,则该反应的平衡常数K为
,则该反应的平衡常数K为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
真题
解题方法
【推荐2】工业上以氟磷灰石[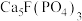 ,含
,含 等杂质]为原料生产磷酸和石膏,工艺流程如下:
等杂质]为原料生产磷酸和石膏,工艺流程如下:
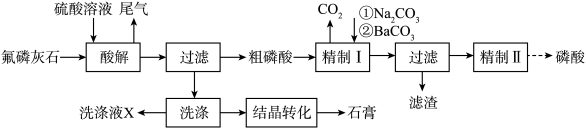
回答下列问题:
(1)酸解时有 产生。氢氟酸与
产生。氢氟酸与 反应生成二元强酸
反应生成二元强酸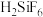 ,离子方程式为
,离子方程式为_______ 。
(2)部分盐的溶度积常数见下表。精制Ⅰ中,按物质的量之比 加入
加入 脱氟,充分反应后,
脱氟,充分反应后,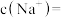
_______  ;再分批加入一定量的
;再分批加入一定量的 ,首先转化为沉淀的离子是
,首先转化为沉淀的离子是_______ 。
(3) 浓度(以
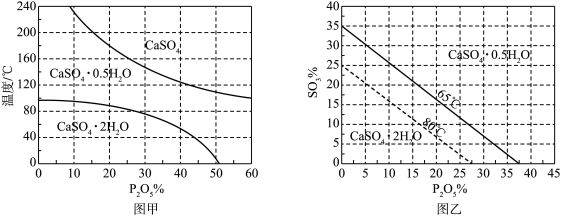
浓度(以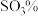 计)在一定范围时,石膏存在形式与温度、
计)在一定范围时,石膏存在形式与温度、 浓度(以
浓度(以 计)的关系如图甲所示。酸解后,在所得
计)的关系如图甲所示。酸解后,在所得 、
、 为45的混合体系中,石膏存在形式为
为45的混合体系中,石膏存在形式为_______ (填化学式);洗涤时使用一定浓度的硫酸溶液而不使用水,原因是_______ ,回收利用洗涤液X的操作单元是_______ ;一定温度下,石膏存在形式与溶液中 和
和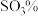 的关系如图乙所示,下列条件能实现酸解所得石膏结晶转化的是
的关系如图乙所示,下列条件能实现酸解所得石膏结晶转化的是_______ (填标号)。
A. 、
、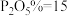 、
、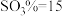 B.
B. 、
、 、
、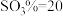
C. 、
、 、
、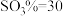 D.
D. 、
、 、
、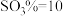
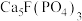 ,含
,含 等杂质]为原料生产磷酸和石膏,工艺流程如下:
等杂质]为原料生产磷酸和石膏,工艺流程如下:
回答下列问题:
(1)酸解时有
 产生。氢氟酸与
产生。氢氟酸与 反应生成二元强酸
反应生成二元强酸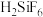 ,离子方程式为
,离子方程式为(2)部分盐的溶度积常数见下表。精制Ⅰ中,按物质的量之比
 加入
加入 脱氟,充分反应后,
脱氟,充分反应后,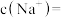
 ;再分批加入一定量的
;再分批加入一定量的 ,首先转化为沉淀的离子是
,首先转化为沉淀的离子是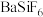 | 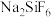 |  |  | |
 |  |  |  | 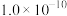 |
 浓度(以
浓度(以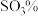 计)在一定范围时,石膏存在形式与温度、
计)在一定范围时,石膏存在形式与温度、 浓度(以
浓度(以 计)的关系如图甲所示。酸解后,在所得
计)的关系如图甲所示。酸解后,在所得 、
、 为45的混合体系中,石膏存在形式为
为45的混合体系中,石膏存在形式为 和
和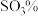 的关系如图乙所示,下列条件能实现酸解所得石膏结晶转化的是
的关系如图乙所示,下列条件能实现酸解所得石膏结晶转化的是
A.
 、
、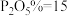 、
、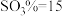 B.
B. 、
、 、
、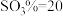
C.
 、
、 、
、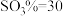 D.
D. 、
、 、
、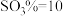
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】硫酸工厂尾气中常常含有较多的SO2,常采用如下方法进行处理。
Ⅰ.氨水吸收法。匀速向氨水中通入SO2,下列措施能提高尾气中SO2去除率的是___________ (填字母)。
a.增大氨水浓度
b.升高反应温度
c.使尾气与氨水充分接触
d.通入空气使HSO3-转化为SO
Ⅱ.O3氧化法。已知:3O2(g)⇌2O3(g) ΔH1=+287.2 kJ·mol-1
SO2(g)+0.5O2(g)⇌SO3(g) ΔH2=-98 kJ·mol-1
则SO2(g)+O3(g)⇌SO3(g)+O2(g) ΔH3=___________ KJ·mol-1。
Ⅲ.CO还原法。
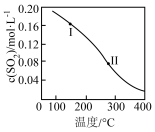
(1)SO2与CO反应的热化学方程式为2CO(g)+SO2(g)⇌S(l)+2CO2(g),ΔH=akJ·mol-1.在体积为1.0L的恒容密闭容器中加入0.4molCO和0.2molSO2.平衡时SO2的物质的量浓度随温度的变化如图所示(图中Ⅰ、Ⅱ点均处于曲线上)。则平衡常数K(状态Ⅰ)_________ K(状态Ⅱ)(填“大于”、“小于”或“等于”,下同)。逆反应速率v逆:v逆(状态Ⅰ)_________ v逆(状态Ⅱ)
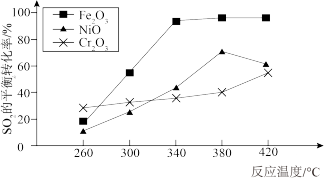
(2)其他条件相同,催化剂不同时,反应相同时间SO2的转化率随反应温度的变化如图所示,260℃条件下选择_____ (填“Fe2O3”、“NiO”或“Cr2O3”)作催化剂时反应速率最快。不考虑价格因素,与NiO相比,选择Fe2O3作催化剂的优势是______ 。
Ⅰ.氨水吸收法。匀速向氨水中通入SO2,下列措施能提高尾气中SO2去除率的是
a.增大氨水浓度
b.升高反应温度
c.使尾气与氨水充分接触
d.通入空气使HSO3-转化为SO

Ⅱ.O3氧化法。已知:3O2(g)⇌2O3(g) ΔH1=+287.2 kJ·mol-1
SO2(g)+0.5O2(g)⇌SO3(g) ΔH2=-98 kJ·mol-1
则SO2(g)+O3(g)⇌SO3(g)+O2(g) ΔH3=
Ⅲ.CO还原法。
(1)SO2与CO反应的热化学方程式为2CO(g)+SO2(g)⇌S(l)+2CO2(g),ΔH=akJ·mol-1.在体积为1.0L的恒容密闭容器中加入0.4molCO和0.2molSO2.平衡时SO2的物质的量浓度随温度的变化如图所示(图中Ⅰ、Ⅱ点均处于曲线上)。则平衡常数K(状态Ⅰ)

(2)其他条件相同,催化剂不同时,反应相同时间SO2的转化率随反应温度的变化如图所示,260℃条件下选择

您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐1】某学习小组探究 溶液与
溶液与 溶液在某种条件下的反应。
溶液在某种条件下的反应。
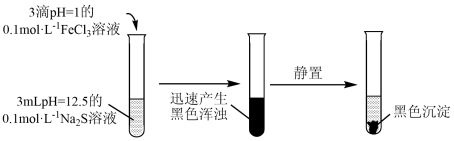
已知:FeS、 均为黑色固体,难溶于水。
均为黑色固体,难溶于水。
(1) 只能大量存在于碱性溶液环境的原因是
只能大量存在于碱性溶液环境的原因是___________ (用化学用语回答)。
(2)小组同学们对试管b中黑色沉淀的提出猜想
猜想1:黑色沉淀是FeS
猜想2:黑色沉淀是
①若猜想1成立,甲同学推测还应该有S生成。甲同学推测所依据的离子方程式___________ 。经检验后确认黑色沉淀中无S单质,猜想1不成立。
②乙同学根据 溶液呈碱性,推测试管b中黑色沉淀除
溶液呈碱性,推测试管b中黑色沉淀除 外,还可能存在
外,还可能存在 ,进行如下实验,以便获得有效信息。
,进行如下实验,以便获得有效信息。
向 浊液中滴加pH=12.5的0.1mol/L
浊液中滴加pH=12.5的0.1mol/L  溶液,观察到红褐色沉淀很快转化为黑色。
溶液,观察到红褐色沉淀很快转化为黑色。
该实验现象能确定的结论是___________ ;不能确定的是___________ 。
(3)丙同学利用电化学原理继续进行探究并设计实验:
丙同学依据实验得出结论:pH=1的0.1mol/L  溶液与pH=12.5的0.1mol/L
溶液与pH=12.5的0.1mol/L  溶液
溶液___________ (填“能”或“不能”)发生氧化还原反应。
(4)综合以上研究,分析试管b中黑色沉淀是 而不是FeS的原因
而不是FeS的原因___________ 。
 溶液与
溶液与 溶液在某种条件下的反应。
溶液在某种条件下的反应。
已知:FeS、
 均为黑色固体,难溶于水。
均为黑色固体,难溶于水。(1)
 只能大量存在于碱性溶液环境的原因是
只能大量存在于碱性溶液环境的原因是(2)小组同学们对试管b中黑色沉淀的提出猜想
猜想1:黑色沉淀是FeS
猜想2:黑色沉淀是

①若猜想1成立,甲同学推测还应该有S生成。甲同学推测所依据的离子方程式
②乙同学根据
 溶液呈碱性,推测试管b中黑色沉淀除
溶液呈碱性,推测试管b中黑色沉淀除 外,还可能存在
外,还可能存在 ,进行如下实验,以便获得有效信息。
,进行如下实验,以便获得有效信息。向
 浊液中滴加pH=12.5的0.1mol/L
浊液中滴加pH=12.5的0.1mol/L  溶液,观察到红褐色沉淀很快转化为黑色。
溶液,观察到红褐色沉淀很快转化为黑色。该实验现象能确定的结论是
(3)丙同学利用电化学原理继续进行探究并设计实验:
| 装置 | 操作及现象 |
 | ①电流计指针有微弱偏转 ②2分钟后,取左侧烧杯溶液,滴加  溶液,有少量蓝色沉淀;2小时后,右侧烧杯有黄色浑浊产生,再取左侧烧杯溶液,滴加 溶液,有少量蓝色沉淀;2小时后,右侧烧杯有黄色浑浊产生,再取左侧烧杯溶液,滴加 溶液,有大量蓝色沉淀。 溶液,有大量蓝色沉淀。 |
 溶液与pH=12.5的0.1mol/L
溶液与pH=12.5的0.1mol/L  溶液
溶液(4)综合以上研究,分析试管b中黑色沉淀是
 而不是FeS的原因
而不是FeS的原因
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐2】某强酸性溶液 含有Al3+、NH4+、Fe2+、Fe3+、:CO32-、SiO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行实验,实验内容和相关数据(气体体积在标准状况下测定)如下
含有Al3+、NH4+、Fe2+、Fe3+、:CO32-、SiO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行实验,实验内容和相关数据(气体体积在标准状况下测定)如下

(1)步骤①中生成气体 的离子方程式:
的离子方程式:________________________ 。
(2)步骤②生成沉淀Ⅰ的离子方程式:________________________ 。
(3)一般用铁氰化钾溶液检验溶液中是否存在______ 离子,请写出涉及的离子方程式:__________________ ;请设计实验,检验溶液 中是否存在
中是否存在 :
:__________________ 。
(4) 溶液中
溶液中______ (填“含”或“不含”) ,
,
______ 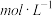 (若填不含,则不需计算)
(若填不含,则不需计算)
(5)通过上述实验,溶液中除 外,一定存在的离子是
外,一定存在的离子是____________ ;一定不存在的离子是____________ 。
(6)若测得 溶液中
溶液中 ,则
,则 溶液中
溶液中
______ 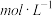 。
。
 含有Al3+、NH4+、Fe2+、Fe3+、:CO32-、SiO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行实验,实验内容和相关数据(气体体积在标准状况下测定)如下
含有Al3+、NH4+、Fe2+、Fe3+、:CO32-、SiO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行实验,实验内容和相关数据(气体体积在标准状况下测定)如下
(1)步骤①中生成气体
 的离子方程式:
的离子方程式:(2)步骤②生成沉淀Ⅰ的离子方程式:
(3)一般用铁氰化钾溶液检验溶液中是否存在
 中是否存在
中是否存在 :
:(4)
 溶液中
溶液中 ,
,
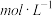 (若填不含,则不需计算)
(若填不含,则不需计算)(5)通过上述实验,溶液中除
 外,一定存在的离子是
外,一定存在的离子是(6)若测得
 溶液中
溶液中 ,则
,则 溶液中
溶液中
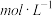 。
。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐3】铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。

①该电化腐蚀称为_______________ ,正极反应为________________
②图中A、B、C、D四个区域,生成铁锈最多的是_______ (填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:

①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为______________
②步骤II中发生反应:4Fe(NO3)2+O2+ (2n +4)H2O=2Fe2O3▪nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为___________
③上述生产流程中,能体现“绿色化学”思想的是_________________ (任写一项)。
(3)已知t℃时,反应FeO(s)+CO(g) Fe( s) +CO2(g)的平衡常数K= 0.25。
Fe( s) +CO2(g)的平衡常数K= 0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)=________________
②若在1L密闭容器中加入0.02 mol FeO(s),并通入x mol CO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x=______________ 。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。

①该电化腐蚀称为
②图中A、B、C、D四个区域,生成铁锈最多的是
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:

①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为
②步骤II中发生反应:4Fe(NO3)2+O2+ (2n +4)H2O=2Fe2O3▪nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为
③上述生产流程中,能体现“绿色化学”思想的是
(3)已知t℃时,反应FeO(s)+CO(g)
 Fe( s) +CO2(g)的平衡常数K= 0.25。
Fe( s) +CO2(g)的平衡常数K= 0.25。①t℃时,反应达到平衡时n(CO):n(CO2)=
②若在1L密闭容器中加入0.02 mol FeO(s),并通入x mol CO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x=
您最近一年使用:0次