以 为代表的温室气体大量排放易导致极端天气的出现,减少碳排放,推进碳中和,提升
为代表的温室气体大量排放易导致极端天气的出现,减少碳排放,推进碳中和,提升 的综合利用技术,降低空气中
的综合利用技术,降低空气中 的含量显得刻不容缓。目前
的含量显得刻不容缓。目前 的综合利用技术常用的有如下三种:
的综合利用技术常用的有如下三种:
一、光催化技术
(1)中国广州分析测试中心研究团队在温和条件下用 合成
合成 ,方程式为:
,方程式为: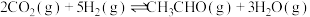
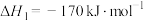
已知生成乙醛的净反应速率为 (
( 、
、 分别表示正、逆反应速率常数)。若在某一温度下
分别表示正、逆反应速率常数)。若在某一温度下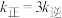 ,则此温度下,上述反应的平衡常数
,则此温度下,上述反应的平衡常数
__________ 。
二、电化学技术
(2)研究证明 也可在熔融碳酸钠中通过电解生成
也可在熔融碳酸钠中通过电解生成 ,收集
,收集 可进行其他有机类合成,化废为宝。则生成
可进行其他有机类合成,化废为宝。则生成 的电极反应式是
的电极反应式是____________________ 。
三、化学催化技术
恒温、体积不变的密闭容器中,加入一定量的 和
和 ,在催化剂下同时发生反应Ⅰ、Ⅱ。
,在催化剂下同时发生反应Ⅰ、Ⅱ。
反应Ⅰ
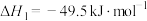
反应Ⅱ
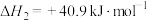
回答下列问题:
(3)下列说法不正确 的是__________。
(4)其他条件相同,仅改变容器体积,实验测得 的平衡产率随着压强的增加而减少,可能原因是
的平衡产率随着压强的增加而减少,可能原因是________________ 。
(5)在一定条件下,选择合适的催化剂只进行反应Ⅱ,调整 和
和 初始投料比,测得在一定投料比和一定温度下,
初始投料比,测得在一定投料比和一定温度下, 的平衡转化率如图所示(各点对应的反应温度可能相同,也可能不同)。
的平衡转化率如图所示(各点对应的反应温度可能相同,也可能不同)。
①C、D二点对应的反应温度 、
、 的关系是
的关系是__________ 。
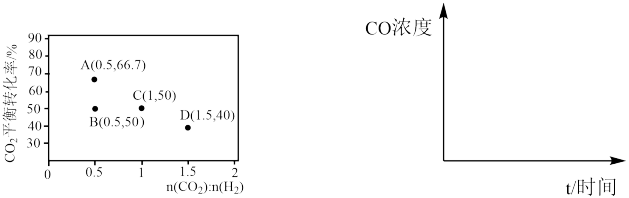
②A、B两点的起始浓度相同,请分别在如图定性画出CO浓度随时间的变化关系,请在曲线上标明 和
和
_______ 。
 为代表的温室气体大量排放易导致极端天气的出现,减少碳排放,推进碳中和,提升
为代表的温室气体大量排放易导致极端天气的出现,减少碳排放,推进碳中和,提升 的综合利用技术,降低空气中
的综合利用技术,降低空气中 的含量显得刻不容缓。目前
的含量显得刻不容缓。目前 的综合利用技术常用的有如下三种:
的综合利用技术常用的有如下三种:一、光催化技术
(1)中国广州分析测试中心研究团队在温和条件下用
 合成
合成 ,方程式为:
,方程式为: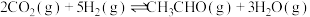
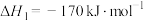
已知生成乙醛的净反应速率为
 (
( 、
、 分别表示正、逆反应速率常数)。若在某一温度下
分别表示正、逆反应速率常数)。若在某一温度下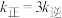 ,则此温度下,上述反应的平衡常数
,则此温度下,上述反应的平衡常数
二、电化学技术
(2)研究证明
 也可在熔融碳酸钠中通过电解生成
也可在熔融碳酸钠中通过电解生成 ,收集
,收集 可进行其他有机类合成,化废为宝。则生成
可进行其他有机类合成,化废为宝。则生成 的电极反应式是
的电极反应式是三、化学催化技术
恒温、体积不变的密闭容器中,加入一定量的
 和
和 ,在催化剂下同时发生反应Ⅰ、Ⅱ。
,在催化剂下同时发生反应Ⅰ、Ⅱ。反应Ⅰ

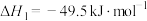
反应Ⅱ

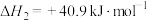
回答下列问题:
(3)下列说法
A.反应Ⅰ的活化能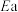 大于反应Ⅱ 大于反应Ⅱ | B.容器内压强不变时可以判断反应达到平衡 |
C.该温度下,反应Ⅱ的 大于零 大于零 | D.使用性能更佳的催化剂可以提高 平衡转化率 平衡转化率 |
 的平衡产率随着压强的增加而减少,可能原因是
的平衡产率随着压强的增加而减少,可能原因是(5)在一定条件下,选择合适的催化剂只进行反应Ⅱ,调整
 和
和 初始投料比,测得在一定投料比和一定温度下,
初始投料比,测得在一定投料比和一定温度下, 的平衡转化率如图所示(各点对应的反应温度可能相同,也可能不同)。
的平衡转化率如图所示(各点对应的反应温度可能相同,也可能不同)。①C、D二点对应的反应温度
 、
、 的关系是
的关系是②A、B两点的起始浓度相同,请分别在如图定性画出CO浓度随时间的变化关系,请在曲线上标明
 和
和

更新时间:2023-08-20 20:18:51
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】工业上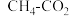 催化重整制合成气反应为:
催化重整制合成气反应为: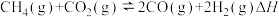
(l)标准摩尔生成焓指由元素最稳定的单质生成 纯化合物时的反应焓变。
纯化合物时的反应焓变。
已知几种物质的标准摩尔生成焓 如表所示:
如表所示:
计算反应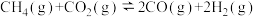 的
的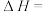
_______  。
。
(2)镍是 催化重整中最有效的催化剂之一,其催化活性受积炭影响非常大。
催化重整中最有效的催化剂之一,其催化活性受积炭影响非常大。
①甲烷转化率较高时,积炭主要由吸附在催化剂表面的 CO 歧化反应产生,产生积碳的化学方程式为_______ ;
②消炭是把碳单质转化为气态碳化合物,有关积炭和消炭的说法正确的是_______ (填标号)。
A.在一定的温度下,甲烷的裂解也会产生积炭
B.MgO 对 有吸附作用,镍催化剂添加 MgO 助剂有利于消炭
有吸附作用,镍催化剂添加 MgO 助剂有利于消炭
C.通入足量的 也可消除积炭
也可消除积炭
(3)在炭催化剂重整制合成气时, 和
和 的转化率受炭催化剂的颗粒大小、
的转化率受炭催化剂的颗粒大小、 与
与  流量比、温度、时间等因素的影响。(已知:目数越大表示颗粒越小。)
流量比、温度、时间等因素的影响。(已知:目数越大表示颗粒越小。)
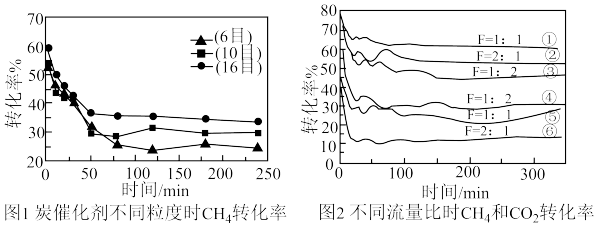
①图 1 可知要提高甲烷转化率可以适当_______ , 可能原因是_______ 。
②图 2 中,F 为 与
与 的流量比,①②③为
的流量比,①②③为 的转化率随时间变化曲线,④⑤⑥为
的转化率随时间变化曲线,④⑤⑥为  的转化率随时间变化的曲线。综合考虑
的转化率随时间变化的曲线。综合考虑 和
和 的转化率,
的转化率, 与
与 最理想的流量比F=
最理想的流量比F=_______ 。
(3) 转化为醋酸的厌氧微生物电解池装置如图所示,其阴极的电极反应式为
转化为醋酸的厌氧微生物电解池装置如图所示,其阴极的电极反应式为_______ 。

 催化重整制合成气反应为:
催化重整制合成气反应为: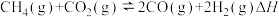
(l)标准摩尔生成焓指由元素最稳定的单质生成
 纯化合物时的反应焓变。
纯化合物时的反应焓变。已知几种物质的标准摩尔生成焓
 如表所示:
如表所示:| 物质 |  | CO(g) |  |  |
生成焓 | 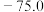 | 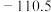 | 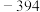 | 0 |
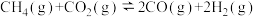 的
的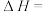
 。
。(2)镍是
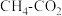 催化重整中最有效的催化剂之一,其催化活性受积炭影响非常大。
催化重整中最有效的催化剂之一,其催化活性受积炭影响非常大。①甲烷转化率较高时,积炭主要由吸附在催化剂表面的 CO 歧化反应产生,产生积碳的化学方程式为
②消炭是把碳单质转化为气态碳化合物,有关积炭和消炭的说法正确的是
A.在一定的温度下,甲烷的裂解也会产生积炭
B.MgO 对
 有吸附作用,镍催化剂添加 MgO 助剂有利于消炭
有吸附作用,镍催化剂添加 MgO 助剂有利于消炭C.通入足量的
 也可消除积炭
也可消除积炭(3)在炭催化剂重整制合成气时,
 和
和 的转化率受炭催化剂的颗粒大小、
的转化率受炭催化剂的颗粒大小、 与
与  流量比、温度、时间等因素的影响。(已知:目数越大表示颗粒越小。)
流量比、温度、时间等因素的影响。(已知:目数越大表示颗粒越小。)
①图 1 可知要提高甲烷转化率可以适当
②图 2 中,F 为
 与
与 的流量比,①②③为
的流量比,①②③为 的转化率随时间变化曲线,④⑤⑥为
的转化率随时间变化曲线,④⑤⑥为  的转化率随时间变化的曲线。综合考虑
的转化率随时间变化的曲线。综合考虑 和
和 的转化率,
的转化率, 与
与 最理想的流量比F=
最理想的流量比F=(3)
 转化为醋酸的厌氧微生物电解池装置如图所示,其阴极的电极反应式为
转化为醋酸的厌氧微生物电解池装置如图所示,其阴极的电极反应式为
您最近一年使用:0次
【推荐2】CO在工农业生产及科学研究中有着重要应用。
(1)CO催化脱氮:在一定温度下,向2L的恒容密闭容器中充入4.0molNO2和4.0molCO,在催化制作用下发生反应:2NO2(g)+4CO(g)⇌N2(g)+4CO2(g)△H=-127.8kJ/mol,测得相关数据如下:
①其他条件不变,若不使用催化剂,则0~5min内NO2的转化率将___ 。(填“变大”、“变小”或“不变”)
②下列表述能说明该反应已达到平衡状态的是___ 。(填序号)
A.CO的化学反应速率为N2的4倍
B.气体的颜色不再变化
C.化学平衡常数K不再变化
D.混合气体的密度不再变化
③有利于提高该反应中NO2平衡转化率的条件是___ 。(填序号)
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(2)CO与Ni发生羰化反应形成的络合物可作为催化烯烃反应的催化剂Ni的羰化反应为:Ni(s)+4CO(g)⇌Ni(CO)4(g)△H<0,T0温度下,将足量的Ni粉和3.7molCO加入到刚性密闭容器中,10min时反应达到平衡,测得体系的压强为原来的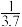 。则:
。则:
①0~10min内平均反应速率v(Ni)=___ g/min。
②研究表明,正反应速率v正=k正•x4(CO),逆反应速率v逆=k逆•x[Ni(CO)4](k正和k逆分别表示正反应和逆反应的速率常数,x为物质的量分数),计算T0温度下的 =
=___ 。
(3)CH4与CO2经催化反应可制得合成气:CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH
已知:反应1:CH4(g)=C(s)+2H2(g)ΔH1=+75kJ/mol
反应2:2CO(g)=C(s)+CO2(g)ΔH2=-172kJ/mol则该催化反应的ΔH=___ kJ/mol。
(4)电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用阴极电解产生的活性原子H将碱性溶液中的NO 还原为N2,工作原理如图所示。
还原为N2,工作原理如图所示。
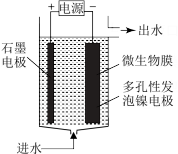
①写出活性原子与NO 反应的离子方程式
反应的离子方程式___ 。
②若阳极生成标准状况下2.24L气体,理论上可除去NO 的物质的量为
的物质的量为___ mol。
(1)CO催化脱氮:在一定温度下,向2L的恒容密闭容器中充入4.0molNO2和4.0molCO,在催化制作用下发生反应:2NO2(g)+4CO(g)⇌N2(g)+4CO2(g)△H=-127.8kJ/mol,测得相关数据如下:
| 时间 浓度 | 0min | 5min | 10min | 15min | 20min |
| c(NO2)/mol/L | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
| c(N2)/mol/L | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
②下列表述能说明该反应已达到平衡状态的是
A.CO的化学反应速率为N2的4倍
B.气体的颜色不再变化
C.化学平衡常数K不再变化
D.混合气体的密度不再变化
③有利于提高该反应中NO2平衡转化率的条件是
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(2)CO与Ni发生羰化反应形成的络合物可作为催化烯烃反应的催化剂Ni的羰化反应为:Ni(s)+4CO(g)⇌Ni(CO)4(g)△H<0,T0温度下,将足量的Ni粉和3.7molCO加入到刚性密闭容器中,10min时反应达到平衡,测得体系的压强为原来的
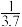 。则:
。则:①0~10min内平均反应速率v(Ni)=
②研究表明,正反应速率v正=k正•x4(CO),逆反应速率v逆=k逆•x[Ni(CO)4](k正和k逆分别表示正反应和逆反应的速率常数,x为物质的量分数),计算T0温度下的
 =
=(3)CH4与CO2经催化反应可制得合成气:CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH
已知:反应1:CH4(g)=C(s)+2H2(g)ΔH1=+75kJ/mol
反应2:2CO(g)=C(s)+CO2(g)ΔH2=-172kJ/mol则该催化反应的ΔH=
(4)电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用阴极电解产生的活性原子H将碱性溶液中的NO
 还原为N2,工作原理如图所示。
还原为N2,工作原理如图所示。
①写出活性原子与NO
 反应的离子方程式
反应的离子方程式②若阳极生成标准状况下2.24L气体,理论上可除去NO
 的物质的量为
的物质的量为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】硫酸的消耗量是衡量一个国家化学工业发展水平的标志。以黄铁矿(主要成分为FeS2)为原料生产H2SO4和Na2S2O5。

请回答下列问题:
(1)FeS2中铁元素的化合价为________ 。
(2)若要增大煅烧过程的反应速率,可采取的措施是________ (任写一条即可)。
(3)若要检验Na2S2O5是否变质生成了Na2SO4,所用的试剂是________ 。
(4)“氧化”时反应的方程式为,2SO2(g)+O2(g) 2SO3(g) △H=-196.6kJ•mol-1。
2SO3(g) △H=-196.6kJ•mol-1。
①在一定温度下,将2molSO2和1molO2放入容积为2L的密闭容器中反应,达到平衡时,测得容器内O2的物质的量浓度为0.2mol•L-1,则该反应的平衡常数为________ 。
②如表列出了在不同温度和压强下,反应达到平衡时SO2的转化率,从化学反应速率、化学平衡及生产成本、产量等角度综合分析,在实际生产中有关该反应适宜条件选择的说法不正确的有________ 。
a.SO2的转化率与温度成反比,故采用尽可能低的温度
b.该反应在450℃左右、0.1MPa(常压)下进行较为合适
c.SO2的转化率与压强成正比,故采用尽可能高的压强
d.为了提高的SO2的转化率,应使用合适的催化剂

请回答下列问题:
(1)FeS2中铁元素的化合价为
(2)若要增大煅烧过程的反应速率,可采取的措施是
(3)若要检验Na2S2O5是否变质生成了Na2SO4,所用的试剂是
(4)“氧化”时反应的方程式为,2SO2(g)+O2(g)
 2SO3(g) △H=-196.6kJ•mol-1。
2SO3(g) △H=-196.6kJ•mol-1。①在一定温度下,将2molSO2和1molO2放入容积为2L的密闭容器中反应,达到平衡时,测得容器内O2的物质的量浓度为0.2mol•L-1,则该反应的平衡常数为
②如表列出了在不同温度和压强下,反应达到平衡时SO2的转化率,从化学反应速率、化学平衡及生产成本、产量等角度综合分析,在实际生产中有关该反应适宜条件选择的说法不正确的有
| 温度/℃ | 平衡时的转化率 | ||||
| 0.1MPa | 0.5MPa | 1MPa | 5MPa | 10MPa | |
| 450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 550 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
b.该反应在450℃左右、0.1MPa(常压)下进行较为合适
c.SO2的转化率与压强成正比,故采用尽可能高的压强
d.为了提高的SO2的转化率,应使用合适的催化剂
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】甲醇的合成是现代化工领域研究的重点。合成甲醇时,合成气成分主要包括CO、CO2、H2、H2O等净化气体和CH4、N2、Ar等惰性气体以及H2S等有害气体。这些气体成分将对甲醇产品质量以及产量造成不同程度的影响。合成过程中的部分反应如下:
(i)CO(g)+2H2(g)=CH3OH(g) ∆H1=-90.1 kJ·mol-1
(ii)CO(g)+H2O(g)=CO2(g)+H2(g) ∆H2=-41.1 kJ·mol-1
(iii)CO(g)+3H2(g)=CH4(g)+H2O(g) ∆H3=-206 kJ·mol-1
(iv)2CH3OH(g)=CH3OCH3(g)+H2O(g) ∆H4=-24.5 kJ·mol-1
(1)反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g)的∆H5=_______ 。该反应的化学平衡常数表达式为_______ 。
下列关于CO2在合成甲醇反应中的主要作用描述,错误的是_______ 。
A.可以抑制反应(iv)的发生 B.可以提高碳元素的利用率
C.可以提高甲醇蒸气的纯度 D.有利于合成塔冷却降温过程的进行
(2)寻找合适的催化剂,一直是甲醇合成研究领域的重点。Saussey和Lavalley认为ZnO催化CO、H2合成CH3OH的机理如图所示。这种理论解释了合成气中少量的水提高了甲醇生成活性的事实,其理由为_______ 。Cu作催化剂合成甲醇时,杂质气体会发生反应H2S+Cu=CuS+H2,因为该反应是_______ (填“可逆”或“不可逆”)的,所以会导致催化剂永久性中毒。
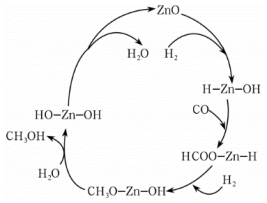
(3)2020年我国科学家在甲醇合成方面,进行了大量有价值的研究。
①某研究报告中指出,由于甲烷的生成,导致合成塔内温度极难控制,使合成成本增加,其原因为_______ 。
②提高合成塔内反应温度,合成反应速率虽然会增大,但其平衡常数会_______ (填“增大”或“减小”),故不同阶段会有不同的最佳温度。从理论上讲,反应初期和随着塔内甲醇浓度上升(中后期),合成塔内的最佳温度应有何不同:_______ 。实际生产中,在气压值为5.0 MPa,用铜催化剂进行催化时,随着反应进行合成塔内的最佳温度范围控制如图所示,这主要是为了保证催化剂有较高的_______ 。该合成粗甲醇的实际情况下,CO、CO2、H2三种气体的氢碳比值(气体的体积比)f应控制在5左右。已知f=(H2-CO2)/(CO+CO2),CO的体积分数应在12%以下,CO2的体积分数应在3%左右,则H2的体积分数应控制在_______ 左右。

(i)CO(g)+2H2(g)=CH3OH(g) ∆H1=-90.1 kJ·mol-1
(ii)CO(g)+H2O(g)=CO2(g)+H2(g) ∆H2=-41.1 kJ·mol-1
(iii)CO(g)+3H2(g)=CH4(g)+H2O(g) ∆H3=-206 kJ·mol-1
(iv)2CH3OH(g)=CH3OCH3(g)+H2O(g) ∆H4=-24.5 kJ·mol-1
(1)反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g)的∆H5=
下列关于CO2在合成甲醇反应中的主要作用描述,错误的是
A.可以抑制反应(iv)的发生 B.可以提高碳元素的利用率
C.可以提高甲醇蒸气的纯度 D.有利于合成塔冷却降温过程的进行
(2)寻找合适的催化剂,一直是甲醇合成研究领域的重点。Saussey和Lavalley认为ZnO催化CO、H2合成CH3OH的机理如图所示。这种理论解释了合成气中少量的水提高了甲醇生成活性的事实,其理由为

(3)2020年我国科学家在甲醇合成方面,进行了大量有价值的研究。
①某研究报告中指出,由于甲烷的生成,导致合成塔内温度极难控制,使合成成本增加,其原因为
②提高合成塔内反应温度,合成反应速率虽然会增大,但其平衡常数会

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】HCOOH是一种重要的化工原料。
(1)已知几种共价键的键能如下表。
根据上述键能估算:

___________  。
。
(2)HCOOH是一种储氢材料,其某种制备原理如图所示。反应1断裂的化学键有___________(填标号)。
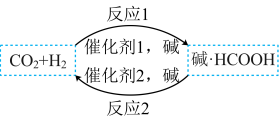
(3)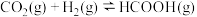 的速率公式为
的速率公式为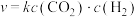 (k为速率常数,只与温度、催化剂有关)。已知经验公式为
(k为速率常数,只与温度、催化剂有关)。已知经验公式为 (其中,
(其中, 、k分别为活化能、速率常数,R、C为常数,T为温度)。在催化剂作用下,测得
、k分别为活化能、速率常数,R、C为常数,T为温度)。在催化剂作用下,测得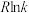 与温度(
与温度( )的关系如图所示。其他条件都相同时,催化效率较高的是
)的关系如图所示。其他条件都相同时,催化效率较高的是___________ (填“Cat1”或“Cat2”)。Cat2催化剂作用下,活化能 为
为___________  。
。

(4)在一定温度下,保持总压强为170kPa。在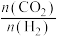 为1:1、1:2、1:3条件下发生反应
为1:1、1:2、1:3条件下发生反应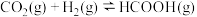 ,测得
,测得 的平衡转化率与
的平衡转化率与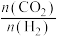 之间的关系如图。曲线c代表的投料比为
之间的关系如图。曲线c代表的投料比为___________ 。M点条件下,平衡常数 为
为___________  。(提示:用分压计算的平衡常数为
。(提示:用分压计算的平衡常数为 ,分压=总压×物质的量分数)
,分压=总压×物质的量分数)

(5)某种含银催化剂可以高效催化甲酸的合成,已知银的晶胞结构如图,其晶胞参数为anm,设 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
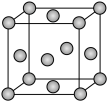
①Ag原子的配位数为___________ 。
②Ag原子的半径为___________ nm。
③该晶体的密度为___________  。
。
(1)已知几种共价键的键能如下表。
| 共价键 | 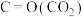 | H-H | H-C | C=O | C-O | O-H |
键能 | 803 | 436 | 413 | 745 | 351 | 463 |


 。
。(2)HCOOH是一种储氢材料,其某种制备原理如图所示。反应1断裂的化学键有___________(填标号)。

| A.极性键 | B.氢键 | C.非极性键 | D.σ键和π键 |
(3)
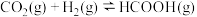 的速率公式为
的速率公式为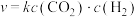 (k为速率常数,只与温度、催化剂有关)。已知经验公式为
(k为速率常数,只与温度、催化剂有关)。已知经验公式为 (其中,
(其中, 、k分别为活化能、速率常数,R、C为常数,T为温度)。在催化剂作用下,测得
、k分别为活化能、速率常数,R、C为常数,T为温度)。在催化剂作用下,测得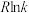 与温度(
与温度( )的关系如图所示。其他条件都相同时,催化效率较高的是
)的关系如图所示。其他条件都相同时,催化效率较高的是 为
为 。
。
(4)在一定温度下,保持总压强为170kPa。在
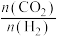 为1:1、1:2、1:3条件下发生反应
为1:1、1:2、1:3条件下发生反应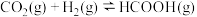 ,测得
,测得 的平衡转化率与
的平衡转化率与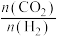 之间的关系如图。曲线c代表的投料比为
之间的关系如图。曲线c代表的投料比为 为
为 。(提示:用分压计算的平衡常数为
。(提示:用分压计算的平衡常数为 ,分压=总压×物质的量分数)
,分压=总压×物质的量分数)
(5)某种含银催化剂可以高效催化甲酸的合成,已知银的晶胞结构如图,其晶胞参数为anm,设
 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
①Ag原子的配位数为
②Ag原子的半径为
③该晶体的密度为
 。
。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】氮化硅(Si3N4)是一种新型陶瓷材料,它由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g)。
Si3N4(s)+6CO(g)。
(1)该反应的平衡常数表达式为K=_________ ;
(2)若知上述反应为放热反应,则其反应热△H___ 0(填“>”、“<”或“=”);升高温度,其平衡常数值___ (填“增大”、“减小”或“不变”);若已知CO生成速率为v(CO)=18mol•L﹣1•min﹣1,则N2消耗速率为v(N2)=_____ ;
(3)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图.图中t4时引起平衡移动的条件可能是___ ;图中表示平衡混合物中CO的含量最高的一段时间是_____ 。
 Si3N4(s)+6CO(g)。
Si3N4(s)+6CO(g)。(1)该反应的平衡常数表达式为K=
(2)若知上述反应为放热反应,则其反应热△H
(3)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图.图中t4时引起平衡移动的条件可能是

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】环氧丙醇是重要的有机合成中间体,其制备过程如下:
Ⅰ.制备环氧丙醇:
①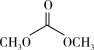 (l)+
(l)+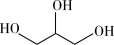 (l)→
(l)→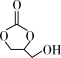 (l)+2CH3OH(l) ΔH<0
(l)+2CH3OH(l) ΔH<0
②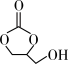 (l)→
(l)→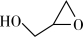 (l) + CO2(g) ΔH>0
(l) + CO2(g) ΔH>0
③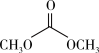 (l)+
(l)+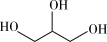 (l)→
(l)→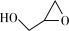 (l)+CO2(g)+2CH3OH(1) ΔH<0
(l)+CO2(g)+2CH3OH(1) ΔH<0
已知焓变是温度函数。上述三个反应的焓变与温度关系如图所示:
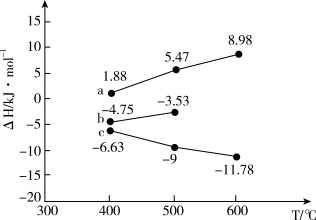
(1)400℃~600℃,图中a曲线表示的是反应_______ (填“①”“②”“③”)。
(2)600℃时反应③的ΔH=_______ kJ/mol
Ⅱ.用环氧丙醇可通过以下反应制得亚甲基丙二酸环氧丙醇酯
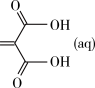 +
+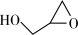 (aq)
(aq)
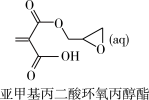 +H2O(l) ΔH=-26.65 kJ/mol
+H2O(l) ΔH=-26.65 kJ/mol
在催化剂作用下,浓度均为1mol/L的两种物质在反应器中反应4h,环氧丙醇的酯化率随温度变化如图所示(酯化率即参与酯化的醇的量与醇的总量的比值)
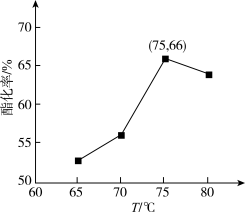
(3)若75℃时反应恰好平衡,此时平衡常数K1为_______ L/mol (三位有效数字)
(4)若温度升高到80℃,平衡常数K2_______ K1(填“>”“<”或“=”)
(5)温度高于75℃后,酯化率降低的原因可能是①_______ ;②_______ ;③_______ 。
(6)若要提高亚甲基丙二酸环氧丙醇酯的产率且提高生产效率,下列措施可行的是_______ 。
a.将温度升高到100℃
b.使用阻聚剂减少亚甲基丙二酸的聚合反应
c.增大亚甲基丙二酸的浓度
d.及时分离亚甲基丙二酸环氧丙醇酯
(7)改变催化剂会发生如下反应:
 +2
+2

 +2H2O(l)
+2H2O(l)
在特定的生产条件下,保持温度不变、环氧丙醇的浓度不变,向反应釜中加水稀释体系,亚甲基丙二酸的平衡转化率会_______ (填“增大”“减小”或“不变”)。
Ⅰ.制备环氧丙醇:
①
 (l)+
(l)+ (l)→
(l)→ (l)+2CH3OH(l) ΔH<0
(l)+2CH3OH(l) ΔH<0②
 (l)→
(l)→ (l) + CO2(g) ΔH>0
(l) + CO2(g) ΔH>0③
 (l)+
(l)+ (l)→
(l)→ (l)+CO2(g)+2CH3OH(1) ΔH<0
(l)+CO2(g)+2CH3OH(1) ΔH<0已知焓变是温度函数。上述三个反应的焓变与温度关系如图所示:

(1)400℃~600℃,图中a曲线表示的是反应
(2)600℃时反应③的ΔH=
Ⅱ.用环氧丙醇可通过以下反应制得亚甲基丙二酸环氧丙醇酯
 +
+ (aq)
(aq)
 +H2O(l) ΔH=-26.65 kJ/mol
+H2O(l) ΔH=-26.65 kJ/mol在催化剂作用下,浓度均为1mol/L的两种物质在反应器中反应4h,环氧丙醇的酯化率随温度变化如图所示(酯化率即参与酯化的醇的量与醇的总量的比值)

(3)若75℃时反应恰好平衡,此时平衡常数K1为
(4)若温度升高到80℃,平衡常数K2
(5)温度高于75℃后,酯化率降低的原因可能是①
(6)若要提高亚甲基丙二酸环氧丙醇酯的产率且提高生产效率,下列措施可行的是
a.将温度升高到100℃
b.使用阻聚剂减少亚甲基丙二酸的聚合反应
c.增大亚甲基丙二酸的浓度
d.及时分离亚甲基丙二酸环氧丙醇酯
(7)改变催化剂会发生如下反应:
 +2
+2

 +2H2O(l)
+2H2O(l)在特定的生产条件下,保持温度不变、环氧丙醇的浓度不变,向反应釜中加水稀释体系,亚甲基丙二酸的平衡转化率会
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】氮氧化物(主要为NO和NO2)是大气污染物,如何有效地消除氮氧化物的污染是目前科学家们研究的热点问题。
(1)用尿素[CO(NH2)2]吸收氮氧化物是一种可行的方法。
①尿素在高温条件下与NO2反应转化成无毒气体,该反应的化学方程式为___ 。用尿素溶液也可吸收氮氧化物,研究表明,当混合气体中 =1时,总氮还原率最高,随着,
=1时,总氮还原率最高,随着, 比值增大,总氮还原率降低的主要原因是
比值增大,总氮还原率降低的主要原因是___ 。
②在一个体积为1L的恒容密闭容器中充入1molCO2和1molNH3,在恒定温度下使其发生反应2NH3(g)+CO2(g) NH2CONH2(s)+H2O(g) △H<0并达到平衡,混合气体中氨气的体积分数随时间的变化如图所示。
NH2CONH2(s)+H2O(g) △H<0并达到平衡,混合气体中氨气的体积分数随时间的变化如图所示。
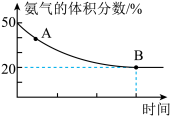
则A点时v正(CO2)___ (填“>”“<”或“=”)B点时v正(CO2),原因是___ 。B点时,NH3的转化率为___ 。
③下列有关反应2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g)的说法正确的是
CO(NH2)2(s)+H2O(g)的说法正确的是___ 。
A.分离出少量的尿素,NH3的转化率将增大
B.反应达到平衡时,降低反应体系的温度,CO2的浓度减小
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高尿素的产率
(2)已知O3氧化氮氧化物的主要反应的热化学方程式如下:
2NO(g)+O2(g)=2NO2(g) △H1=akJ·mol-1
NO(g)+O3(g)=NO2(g)+O2(g) △H2=bkJ·mol-1
6NO2(g)+O3(g)=3N2O5(g) △H3=ckJ·mol-1
则反应4NO2(g)+O2(g)=2N2O5(g)△H=___ (用含a、b、c的代数式表示)kJ·mol-1。
(3)氮氧化物也可用碱液吸收。若NO和NO2的混合气体被NaOH溶液完全吸收,只生成一种盐,则该盐的化学式为___ ;已知常温下Ka(HNO2)=5×10-4,则反应HNO2(aq)+NaOH(aq) NaNO2(aq)+H2O(l)的平衡常数K=
NaNO2(aq)+H2O(l)的平衡常数K=___ 。
(1)用尿素[CO(NH2)2]吸收氮氧化物是一种可行的方法。
①尿素在高温条件下与NO2反应转化成无毒气体,该反应的化学方程式为
 =1时,总氮还原率最高,随着,
=1时,总氮还原率最高,随着, 比值增大,总氮还原率降低的主要原因是
比值增大,总氮还原率降低的主要原因是②在一个体积为1L的恒容密闭容器中充入1molCO2和1molNH3,在恒定温度下使其发生反应2NH3(g)+CO2(g)
 NH2CONH2(s)+H2O(g) △H<0并达到平衡,混合气体中氨气的体积分数随时间的变化如图所示。
NH2CONH2(s)+H2O(g) △H<0并达到平衡,混合气体中氨气的体积分数随时间的变化如图所示。
则A点时v正(CO2)
③下列有关反应2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g)的说法正确的是
CO(NH2)2(s)+H2O(g)的说法正确的是A.分离出少量的尿素,NH3的转化率将增大
B.反应达到平衡时,降低反应体系的温度,CO2的浓度减小
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高尿素的产率
(2)已知O3氧化氮氧化物的主要反应的热化学方程式如下:
2NO(g)+O2(g)=2NO2(g) △H1=akJ·mol-1
NO(g)+O3(g)=NO2(g)+O2(g) △H2=bkJ·mol-1
6NO2(g)+O3(g)=3N2O5(g) △H3=ckJ·mol-1
则反应4NO2(g)+O2(g)=2N2O5(g)△H=
(3)氮氧化物也可用碱液吸收。若NO和NO2的混合气体被NaOH溶液完全吸收,只生成一种盐,则该盐的化学式为
 NaNO2(aq)+H2O(l)的平衡常数K=
NaNO2(aq)+H2O(l)的平衡常数K=
您最近一年使用:0次
【推荐3】二氧化碳催化加氢合成乙烯在环境保护、资源利用、战略需求等方面具有重要意义。 CO2和H2 在铁系催化剂作用下发生化学反应:
I.2CO2(g)+6H2(g) C2H4(g)+4H2O(g)ΔH1
C2H4(g)+4H2O(g)ΔH1
II.CO2(g)+H2(g) CO(g)+H2O(g)ΔH2>0
CO(g)+H2O(g)ΔH2>0
请回答下列问题:
(1)反应I能自发进行,则 ΔH1___ 0(填“<”或“>”或“=”);该反应自发进行的条件是______ 。
(2)在密闭容器中通入1mol CO2和3molH2,在铁系催化剂作用下进行反应,CO2的平衡转化率随温度和压强的变化如图所示。
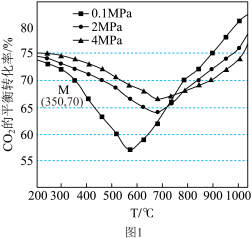
①下列说法正确的是____
A.由图1可知:0.1MPa下,200℃~550℃时以反应I为主,550℃以后以反应II为主
B.反应II化学方程式前后物质的化学计量数之和相等,所以反应II的ΔS等于零
C.恒温恒压下,容器内气体的密度不变时,说明反应已达平衡
D.其他条件不变,将CO2和H2的初始物质的量比改变为2:3,可提高CO2平衡转化率
②图1中点M(350,70)、此时乙烯的选择性为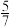 (选择性:转化的CO2中生成C2H4和CO的百分比)。计算该温度时:反应II的平衡常数Kc =
(选择性:转化的CO2中生成C2H4和CO的百分比)。计算该温度时:反应II的平衡常数Kc =_____ 。
③在图1中,温度大于800℃时,随着压强的增大,CO2的平衡转化率减小,请解释原因____ 。
(3)有研究表明,在铁系催化剂作用下反应I分两步进行:
i CO2(g)+H2(g) CO(g)+H2O(g)慢
CO(g)+H2O(g)慢
ii 2CO(g)+4H2(g) C2H4 (g)+2H2O(g)快
C2H4 (g)+2H2O(g)快
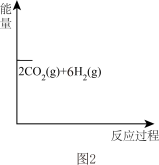
在图2中画出反应I分两步进行的“能量−反应过程图”。起点从[2CO2(g)+6H2(g)]开始____ 。
I.2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g)ΔH1
C2H4(g)+4H2O(g)ΔH1 II.CO2(g)+H2(g)
 CO(g)+H2O(g)ΔH2>0
CO(g)+H2O(g)ΔH2>0 请回答下列问题:
(1)反应I能自发进行,则 ΔH1
(2)在密闭容器中通入1mol CO2和3molH2,在铁系催化剂作用下进行反应,CO2的平衡转化率随温度和压强的变化如图所示。

①下列说法正确的是
A.由图1可知:0.1MPa下,200℃~550℃时以反应I为主,550℃以后以反应II为主
B.反应II化学方程式前后物质的化学计量数之和相等,所以反应II的ΔS等于零
C.恒温恒压下,容器内气体的密度不变时,说明反应已达平衡
D.其他条件不变,将CO2和H2的初始物质的量比改变为2:3,可提高CO2平衡转化率
②图1中点M(350,70)、此时乙烯的选择性为
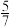 (选择性:转化的CO2中生成C2H4和CO的百分比)。计算该温度时:反应II的平衡常数Kc =
(选择性:转化的CO2中生成C2H4和CO的百分比)。计算该温度时:反应II的平衡常数Kc =③在图1中,温度大于800℃时,随着压强的增大,CO2的平衡转化率减小,请解释原因
(3)有研究表明,在铁系催化剂作用下反应I分两步进行:
i CO2(g)+H2(g)
 CO(g)+H2O(g)慢
CO(g)+H2O(g)慢 ii 2CO(g)+4H2(g)
 C2H4 (g)+2H2O(g)快
C2H4 (g)+2H2O(g)快在图2中画出反应I分两步进行的“能量−反应过程图”。起点从[2CO2(g)+6H2(g)]开始

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】 二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气相似,被誉为“21 世纪的清洁燃料”。制备原理如下:
(I)由天然气催化制备二甲醚:①2CH4(g)+O2(g) CH3OCH3(g)+H2O(g) △H1
CH3OCH3(g)+H2O(g) △H1
(II)由合成气制备二甲醚:②CO(g)+2H2(g) CH3OH(g) △H2
CH3OH(g) △H2
③2CH3OH(g) CH3OCH3(g)+H2O(g) △H3
CH3OCH3(g)+H2O(g) △H3
回答下列问题:
(1)若甲醇与二甲醚的燃烧热分别是△H=-760.5 kJ/mol和△H=-1453.0 kJ/mol;1 mol 液态水变为气态水要吸收44.0 kJ的热量。则△H3=__________ kJ/ mol。
(2)一定温度下,在容积固定的密闭容器中按I制备二甲醚,下列情况能说明反应①达到平衡状态的是_________ (填序号)。
A.混合气体的密度保持不变
B. CH4与O2的物质的量之比保持不变
C.混合气体的平均相对分子质量保持不变
D. CH4的生成速率等于与CH3OCH3消耗速率的2倍
(3)在恒容密闭容器中按原理( I )制备二甲醚,若起始时c(CH4)= 0.20 mol/L,c(O2)= 0.10 mol/L,平衡时CH4的平衡转化率为50%,则平衡时CH3OCH3的体积分数为__________ 。
(4)工业上按原理(II)制备二甲醚时,反应②合成甲醇时常以Cu2O作催化剂。研究表明,反应体系中少量CO2有利于维持催化剂Cu2O的量不变,请结合平衡移动原理分析其原因是_______________________________________________________ (写出相关的化学方程式并辅以必要的文字说明)。
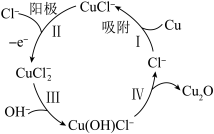
(5)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,阳极及其溶液中有关转化如图所示。则阳极的电极反应式为_____________ ;溶液中III、IV二步总反应的离子方程式为_________________________ 。
(6)有人模拟工业上按原理(II)制备二甲醚,在1000K时的2 L密闭容器中充入2 mol CO和6 mol H2,此时体系总压强是3.2×105kPa。达到平衡时c(H2)= 1.4 mo/L,c(CH3OCH3)=0.3 mol/L,则用平衡分压表示反应③的平衡常数Kp=_________ (分压=总压×物质的量分数)。
(I)由天然气催化制备二甲醚:①2CH4(g)+O2(g)
 CH3OCH3(g)+H2O(g) △H1
CH3OCH3(g)+H2O(g) △H1(II)由合成气制备二甲醚:②CO(g)+2H2(g)
 CH3OH(g) △H2
CH3OH(g) △H2③2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H3
CH3OCH3(g)+H2O(g) △H3回答下列问题:
(1)若甲醇与二甲醚的燃烧热分别是△H=-760.5 kJ/mol和△H=-1453.0 kJ/mol;1 mol 液态水变为气态水要吸收44.0 kJ的热量。则△H3=
(2)一定温度下,在容积固定的密闭容器中按I制备二甲醚,下列情况能说明反应①达到平衡状态的是
A.混合气体的密度保持不变
B. CH4与O2的物质的量之比保持不变
C.混合气体的平均相对分子质量保持不变
D. CH4的生成速率等于与CH3OCH3消耗速率的2倍
(3)在恒容密闭容器中按原理( I )制备二甲醚,若起始时c(CH4)= 0.20 mol/L,c(O2)= 0.10 mol/L,平衡时CH4的平衡转化率为50%,则平衡时CH3OCH3的体积分数为
(4)工业上按原理(II)制备二甲醚时,反应②合成甲醇时常以Cu2O作催化剂。研究表明,反应体系中少量CO2有利于维持催化剂Cu2O的量不变,请结合平衡移动原理分析其原因是
(5)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,阳极及其溶液中有关转化如图所示。则阳极的电极反应式为

(6)有人模拟工业上按原理(II)制备二甲醚,在1000K时的2 L密闭容器中充入2 mol CO和6 mol H2,此时体系总压强是3.2×105kPa。达到平衡时c(H2)= 1.4 mo/L,c(CH3OCH3)=0.3 mol/L,则用平衡分压表示反应③的平衡常数Kp=
您最近一年使用:0次
【推荐2】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
(1)已知:①2Cu(s)+1/2O2(g)=Cu2O(s);△H = -169kJ·mol-1
②C(s)+1/2O2(g)=CO(g);△H = -110.5kJ·mol-1
③ Cu(s)+1/2O2(g)=CuO(s);△H = -157kJ·mol-1
则方法a发生的热化学方程式是:_________________
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示:该电池的阳极反应式为___________ 钛极附近的pH值______ (增大、减小、不变)。

(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为______________ 。
(4)在相同的密闭容器中,用以上方法制得的三种Cu2O分别进行催化分解水的实验: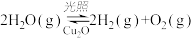 △H>0。水蒸气的浓度随时间t变化如下表所示。
△H>0。水蒸气的浓度随时间t变化如下表所示。
下列叙述正确的是_______ (填字母)。
A.实验的温度:T2<T1
B.实验②比实验①所用的催化剂催化效率高
C.实验①前20 min的平均反应速率 v(H2)=7×10-5 mol·L-1 min-1
| 方法a | 用炭粉在高温条件下还原CuO |
| 方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O; |
| 方法c | 电解法,反应为2Cu + H2O Cu2O + H2↑。 Cu2O + H2↑。 |
| 方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
②C(s)+1/2O2(g)=CO(g);△H = -110.5kJ·mol-1
③ Cu(s)+1/2O2(g)=CuO(s);△H = -157kJ·mol-1
则方法a发生的热化学方程式是:
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示:该电池的阳极反应式为

(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为
(4)在相同的密闭容器中,用以上方法制得的三种Cu2O分别进行催化分解水的实验:
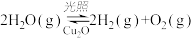 △H>0。水蒸气的浓度随时间t变化如下表所示。
△H>0。水蒸气的浓度随时间t变化如下表所示。| 序号 |  | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
A.实验的温度:T2<T1
B.实验②比实验①所用的催化剂催化效率高
C.实验①前20 min的平均反应速率 v(H2)=7×10-5 mol·L-1 min-1
您最近一年使用:0次
【推荐3】以菱锰矿(主要成分MnCO3,还含有FeCO3、CaCO3、SiO2、Al2O3、Fe2O3、MgCO3等杂质)为原料制备二氧化锰的工艺流程如图:

已知:Ksp(MnCO3)=1.8×10-11、Ksp[Fe(OH)3]=2.8×10-39、Ksp[Al(OH)3]=1.3×10-33、Ksp(MgF2)=7.0×10-11、Ksp(CaF2)=1.0×10-10、Ksp(MnF2)=5.0×10-3。
(1)酸浸时为了提高浸出效率,除升温外,还可以采取_______ 措施。
(2)“中和除杂1”是将铁、铝元素转化为沉淀除去,物质X最好选用_______(填编号)。
(3)“除杂2”除去的主要离子是_______ (填离子符号)。
(4)“产品2”为电解过程产生的气体副产物,该气体为_______ 。
(5)工业上采用如下图的电解法获得MnO2,Mn2+将在_______ 极(填“C”或“D”)发生反应生成MnO2,其电极反应式为_______ 。电解过程中穿过离子交换膜的离子和移动方向为_______ 。 
(6)电解后的废水经过处理后,依然存在Mn2+。向含有0.020mol·L-lMn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10-4mol·L-1时,Mn2+开始沉淀,则a=_______ 。(已知:H2S的电离常数K1=1.0×10-7,K2=-7.0×10-15;Ksp(MnS)=1.4×10-15]

已知:Ksp(MnCO3)=1.8×10-11、Ksp[Fe(OH)3]=2.8×10-39、Ksp[Al(OH)3]=1.3×10-33、Ksp(MgF2)=7.0×10-11、Ksp(CaF2)=1.0×10-10、Ksp(MnF2)=5.0×10-3。
(1)酸浸时为了提高浸出效率,除升温外,还可以采取
(2)“中和除杂1”是将铁、铝元素转化为沉淀除去,物质X最好选用_______(填编号)。
| A.CuO | B.CuCO3 | C.Fe(OH)3 | D.MnCO3 |
(4)“产品2”为电解过程产生的气体副产物,该气体为
(5)工业上采用如下图的电解法获得MnO2,Mn2+将在

(6)电解后的废水经过处理后,依然存在Mn2+。向含有0.020mol·L-lMn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10-4mol·L-1时,Mn2+开始沉淀,则a=
您最近一年使用:0次



