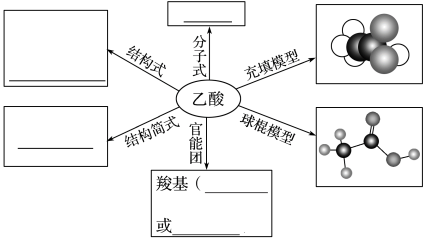
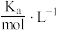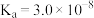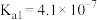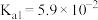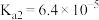日常生活中作为调味品的食醋含有3%~5%的乙酸。
(1)乙酸的分子式是______ ,含有的官能团为______ 。
(2)乙酸和乙醇发生反应。写出该反应的条件______ , 产物_____ 。
(3)乙酸是一种弱酸,写出它的电离方程式______ 。
(4)已知酸性:乙酸<盐酸,请设计实验方案证明_______ 。
(1)乙酸的分子式是
(2)乙酸和乙醇发生反应。写出该反应的条件
(3)乙酸是一种弱酸,写出它的电离方程式
(4)已知酸性:乙酸<盐酸,请设计实验方案证明
更新时间:2020-08-18 05:58:18
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】表是25℃时某些弱酸的电离平衡常数。
(1)pH相同的NaClO和 溶液,其溶液的物质的量浓度的大小关系是
溶液,其溶液的物质的量浓度的大小关系是
______ NaClO(填“ ”“
”“ ”或“
”或“ ”,下同),两溶液中:
”,下同),两溶液中:
______  。
。
(2)若
 溶液与
溶液与 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的
NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的 ,则
,则
______ 。
(3)取10mL 的
的 溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中
溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中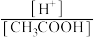 的比值将
的比值将______ (填“增大”“减小”或“无法确定”)。
(4)向碳酸钠溶液中滴加少量氯水的离子方程式______ 。
化学式 |
|
|
|
|
|
|
|
|
|
 溶液,其溶液的物质的量浓度的大小关系是
溶液,其溶液的物质的量浓度的大小关系是
 ”“
”“ ”或“
”或“ ”,下同),两溶液中:
”,下同),两溶液中:
 。
。(2)若

 溶液与
溶液与 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的
NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的 ,则
,则
(3)取10mL
 的
的 溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中
溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中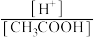 的比值将
的比值将(4)向碳酸钠溶液中滴加少量氯水的离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】25℃时,有关物质的电离平衡常数如下:
(1) CH3COOH溶液中,其电离平衡常数表达式为K =_____ ,常温下测得NaHSO3溶液的pH<7,其原因是_____ 。
(2) 常温下,将体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____ 后者(填“>”、“<”或“=”)。
(3) 下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为_____ 。
(4) 体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是_____ (填序号)。
(5) 已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为_____ 。
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(2) 常温下,将体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者
(3) 下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为
(4) 体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是
(5) 已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】在氢氟酸溶液中,存在如下电离平衡:HF⇌H++F-
(1)加入固体NaOH,电离平衡向______ 反应方向移动,c(H+)______ .
(2)加入固体NaF,电离平衡向______ 反应方向移动.
(3)升高温度,电离平衡向______ 反应方向移动.
(4)常温下,小苏打溶液呈______ 性,原因是_________________________ (用必要的离子方程式及文字解释表示).

(5)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示,则图中表示醋酸溶液中pH变化曲线的是______ (填“A”或“B”);设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2则m1______ m2(选填“>”、“=”“<”)
(1)加入固体NaOH,电离平衡向
(2)加入固体NaF,电离平衡向
(3)升高温度,电离平衡向
(4)常温下,小苏打溶液呈

(5)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示,则图中表示醋酸溶液中pH变化曲线的是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】表是25℃时某些弱酸的电离平衡常数。
(1)pH相同的NaClO和 溶液,其溶液的物质的量浓度的大小关系是
溶液,其溶液的物质的量浓度的大小关系是
______ NaClO(填“ ”“
”“ ”或“
”或“ ”,下同),两溶液中:
”,下同),两溶液中:
______  。
。
(2)若
 溶液与
溶液与 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的
NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的 ,则
,则
______ 。
(3)取10mL 的
的 溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中
溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中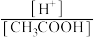 的比值将
的比值将______ (填“增大”“减小”或“无法确定”)。
(4)向碳酸钠溶液中滴加少量氯水的离子方程式______ 。
化学式 |
|
|
|
|
|
|
|
|
|
 溶液,其溶液的物质的量浓度的大小关系是
溶液,其溶液的物质的量浓度的大小关系是
 ”“
”“ ”或“
”或“ ”,下同),两溶液中:
”,下同),两溶液中:
 。
。(2)若

 溶液与
溶液与 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的
NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的 ,则
,则
(3)取10mL
 的
的 溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中
溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中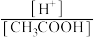 的比值将
的比值将(4)向碳酸钠溶液中滴加少量氯水的离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】在室温下,下列五种溶液:①0.1mol/LNH4Cl;②0.1mol/LCH3COONH4;③0.1mol/LNH4HSO4;④0.1mol/LNH3·H2O和0.1mol/LNH4Cl混合液;⑤0.1mol/LNH4Al(SO4)2。请根据要求填写下列空白:
(1)将等pH等体积的HCl和CH3COOH分别稀释m倍和n倍,稀释后两溶液的pH仍相等,则m_______ n(填“大于”、“等于”或“小于”)。
(2)①、②、③、⑤中c( )由大到小的顺序是:
)由大到小的顺序是:_______ (用①、②、③、⑤表示)。
(3)室温,溶液②的pH=7,该溶液中各离子浓度的大小关系是_______ 。
(4)若室温下,在溶液④中pH>7,则c(NH3·H2O)_______ c( )(填“大于”、“等于”或“小于”)。
)(填“大于”、“等于”或“小于”)。
(5)向③中滴加等体积等浓度NaOH溶液时,此时溶液呈_______ (填“酸性”“中性”或“碱性”),其离子浓度大小关系:c( )
)_______ c(Na+)_______ c( );c(
);c( )+c(H+)
)+c(H+)_______ c( )+c(OH-)。(以上均填“大于”、“等于”或“小于”)。
)+c(OH-)。(以上均填“大于”、“等于”或“小于”)。
(1)将等pH等体积的HCl和CH3COOH分别稀释m倍和n倍,稀释后两溶液的pH仍相等,则m
(2)①、②、③、⑤中c(
 )由大到小的顺序是:
)由大到小的顺序是:(3)室温,溶液②的pH=7,该溶液中各离子浓度的大小关系是
(4)若室温下,在溶液④中pH>7,则c(NH3·H2O)
 )(填“大于”、“等于”或“小于”)。
)(填“大于”、“等于”或“小于”)。(5)向③中滴加等体积等浓度NaOH溶液时,此时溶液呈
 )
) );c(
);c( )+c(H+)
)+c(H+) )+c(OH-)。(以上均填“大于”、“等于”或“小于”)。
)+c(OH-)。(以上均填“大于”、“等于”或“小于”)。
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】水的电离平衡曲线如图所示。若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态为B点。
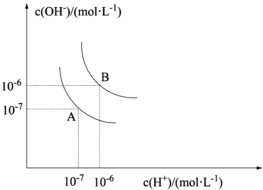
(1)在100℃时,Kw的表达式为_____ ,在此温度下,Kw的值为_____ mol2/L2.
(2)在室温下,将pH=9的Ba(OH)2溶液与pH=5的稀盐酸混合,欲使混合溶液pH=7,则Ba(OH)2溶液与盐酸的体积比为_____ ,物质的量浓度比为_____
(3)室温时将pH为3的硫酸溶液稀释5百万倍,稀释后溶液中,c( )和c(H+)之比约为
)和c(H+)之比约为_____ 。
Ⅱ.现有溶质为①CH3COOH,②HCl、③H2SO4的三种溶液,根据要求回答下列问题:
(4)写出①的电离方程式:_____ 。
(5)当它们pH相同时,其物质的量浓度最大的是_____ (填序号)。
(6)当它们的物质的量浓度相同时,其pH最小的是_____ (填序号)。
(7)在室温下,将c(H+)均为0.1mol/L的三种酸分别加水稀释至原来的10倍,c(H+)由大到小的顺序为_____ (填序号)。
(8)体积和物质的量浓度均相同的①②③三种酸溶液,分别与相同浓度的烧碱溶液恰好完全反应,所需烧碱溶液的体积比为_____ 。
(9)三种酸溶液的pH相同时,若消耗等量的Zn,则需三种酸溶液的体积大小关系为_____ (填序号)。

(1)在100℃时,Kw的表达式为
(2)在室温下,将pH=9的Ba(OH)2溶液与pH=5的稀盐酸混合,欲使混合溶液pH=7,则Ba(OH)2溶液与盐酸的体积比为
(3)室温时将pH为3的硫酸溶液稀释5百万倍,稀释后溶液中,c(
 )和c(H+)之比约为
)和c(H+)之比约为Ⅱ.现有溶质为①CH3COOH,②HCl、③H2SO4的三种溶液,根据要求回答下列问题:
(4)写出①的电离方程式:
(5)当它们pH相同时,其物质的量浓度最大的是
(6)当它们的物质的量浓度相同时,其pH最小的是
(7)在室温下,将c(H+)均为0.1mol/L的三种酸分别加水稀释至原来的10倍,c(H+)由大到小的顺序为
(8)体积和物质的量浓度均相同的①②③三种酸溶液,分别与相同浓度的烧碱溶液恰好完全反应,所需烧碱溶液的体积比为
(9)三种酸溶液的pH相同时,若消耗等量的Zn,则需三种酸溶液的体积大小关系为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】有下列3种有机化合物A:CH2=CH2、B:CH4、C:CH3COOH。
(1)写出化合物C中官能团的名称:_______ (填“羟基”或“羧基”)。
(2)3种化合物中能使溴的四氯化碳溶液褪色的是_______ (填“乙烯”或“甲烷”)。
(3)CH4与Cl2在光照下发生取代反应生成一氯甲烷的化学方程式:CH4 + Cl2 CH3Cl +
CH3Cl + _______
(1)写出化合物C中官能团的名称:
(2)3种化合物中能使溴的四氯化碳溶液褪色的是
(3)CH4与Cl2在光照下发生取代反应生成一氯甲烷的化学方程式:CH4 + Cl2
 CH3Cl +
CH3Cl +
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】Ⅰ、体育比赛中当运动员肌肉挫伤或扭伤时,队医常用药剂氯乙烷(CH3CH2Cl)(沸点为12.27 ℃)对受伤部位进行局部冷却麻醉处理,工业上制取氯乙烷有两种方案:
a.CH3CH3+Cl2 CH3CH2Cl+HCl b.CH2=CH2+HCl
CH3CH2Cl+HCl b.CH2=CH2+HCl CH3—CH2Cl
CH3—CH2Cl
(1)你认为制备氯乙烷的最好方案为___________ (填“a”或“b”)。
Ⅱ、乙醇和乙酸是生活中常见的有机物。
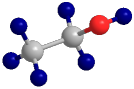
(2)如图所示为乙醇的___________ (“空间充填”或“球棍”)模型。
(3)乙醇中所含有的官能团的名称为___________ ,乙酸属于___________ (填“电解质”或“非电解质”)。
(4)用结构简式补全如图所示装置中乙醇和乙酸反应的化学方程式:CH3CH2OH+CH3COOH
___________ +H2O,该反应的类型为___________ 反应(填“取代”或“加成”),右侧小试管中应装有___________ 溶液(填“饱和Na2CO3”或“饱和NaOH”)。

a.CH3CH3+Cl2
 CH3CH2Cl+HCl b.CH2=CH2+HCl
CH3CH2Cl+HCl b.CH2=CH2+HCl CH3—CH2Cl
CH3—CH2Cl(1)你认为制备氯乙烷的最好方案为
Ⅱ、乙醇和乙酸是生活中常见的有机物。
(2)如图所示为乙醇的

(3)乙醇中所含有的官能团的名称为
(4)用结构简式补全如图所示装置中乙醇和乙酸反应的化学方程式:CH3CH2OH+CH3COOH


您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】x、y、z、w 四种物质均由下列六种基团中的两种组合而成。
-H、C6H5-、-OH、-CHO、-COOH、-CH3
(1)燃烧 0.1molx,产生 2.24 升二氧化碳(标准状况下),x 不能与碳酸钠反应,但能与金属钠反应,x 的结构简式是______________________________ 。
(2)y 不能与碳酸氢钠反应,但能与碳酸钠反应,在空气中会被氧化,它的一元取代物有三种结构,则 y 的结构简式是______________________________ 。
(3)z 呈弱酸性,z 稍受热就分解出气体,z 的结构简式是____________________ 。
(4)w 在室温下呈气态,w 分子中含有三种元素,w 的结构简式是__________ 。
(5)在一定条件下,x、y、z、w 两两之间能发生化学反应的化学方程式是:____________ 。
-H、C6H5-、-OH、-CHO、-COOH、-CH3
(1)燃烧 0.1molx,产生 2.24 升二氧化碳(标准状况下),x 不能与碳酸钠反应,但能与金属钠反应,x 的结构简式是
(2)y 不能与碳酸氢钠反应,但能与碳酸钠反应,在空气中会被氧化,它的一元取代物有三种结构,则 y 的结构简式是
(3)z 呈弱酸性,z 稍受热就分解出气体,z 的结构简式是
(4)w 在室温下呈气态,w 分子中含有三种元素,w 的结构简式是
(5)在一定条件下,x、y、z、w 两两之间能发生化学反应的化学方程式是:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】乙醇是生活中常见的有机物,可以发生下列转化:
请根据题意填空:
(1)交警查酒驾,通常让司机向盛有酸性重铬酸钾的测试仪吹气,若变色,说明司机饮了酒,该过程中乙醇最终被氧化为___________________ (填“CH3CHO”或“CH3COOH”);
(2)CH3CH2OH的官能团是____________ (填“羟基”或“羧基”);
(3)CH3COOH + CH3CH2OH CH3COOCH2CH3 + H2O,在该反应中浓硫酸的作用是吸水剂和
CH3COOCH2CH3 + H2O,在该反应中浓硫酸的作用是吸水剂和_____________ (填“催化剂”或“氧化剂”)。

请根据题意填空:
(1)交警查酒驾,通常让司机向盛有酸性重铬酸钾的测试仪吹气,若变色,说明司机饮了酒,该过程中乙醇最终被氧化为
(2)CH3CH2OH的官能团是
(3)CH3COOH + CH3CH2OH
 CH3COOCH2CH3 + H2O,在该反应中浓硫酸的作用是吸水剂和
CH3COOCH2CH3 + H2O,在该反应中浓硫酸的作用是吸水剂和
您最近一年使用:0次