25℃时,有关物质的电离平衡常数如下:
(1) CH3COOH溶液中,其电离平衡常数表达式为K =_____ ,常温下测得NaHSO3溶液的pH<7,其原因是_____ 。
(2) 常温下,将体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____ 后者(填“>”、“<”或“=”)。
(3) 下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为_____ 。
(4) 体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是_____ (填序号)。
(5) 已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为_____ 。
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(2) 常温下,将体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者
(3) 下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为
(4) 体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是
(5) 已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为
更新时间:2017-07-18 15:00:03
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】25 ℃时,电离平衡常数数值如下:
回答下列问题:
(1)下列四种离子结合质子的能力由大到小的顺序是___________ 。(填字母)
a. b.ClO-
b.ClO-
c.CH3COO- d.
(2)下列反应不能发生的是___________ 。
a. +2CH3COOH=2CH3COO-+CO2↑+H2O
+2CH3COOH=2CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c. +2HClO=CO2↑+H2O+2ClO-
+2HClO=CO2↑+H2O+2ClO-
d.2ClO-+CO2+H2O= +2HClO
+2HClO
(3)用蒸馏水稀释0.10 mol·L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是___________ 。
a.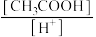 b.
b.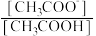
c. d.
d.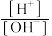
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1:4.3×10-7 K2:5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)下列四种离子结合质子的能力由大到小的顺序是
a.
 b.ClO-
b.ClO-c.CH3COO- d.

(2)下列反应不能发生的是
a.
 +2CH3COOH=2CH3COO-+CO2↑+H2O
+2CH3COOH=2CH3COO-+CO2↑+H2Ob.ClO-+CH3COOH=CH3COO-+HClO
c.
 +2HClO=CO2↑+H2O+2ClO-
+2HClO=CO2↑+H2O+2ClO-d.2ClO-+CO2+H2O=
 +2HClO
+2HClO(3)用蒸馏水稀释0.10 mol·L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是
a.
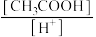 b.
b.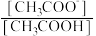
c.
 d.
d.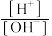
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示。请回答:
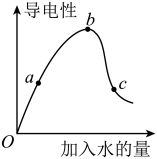
(1)O点为什么不导电_______ 。
(2)a、b、c三点c(H+)由大到小的顺序是_____ 。
(3)a、b、c三点中醋酸的电离程度最大的点是_____ 点。
(4)若使c点溶液中的c(CH3COO-)提高,可采取的措施是____ (填标号)。
A.加热B.加很稀的NaOH溶液C.加固体KOH D.加水E.加固体CH3COONa F.加锌粉

(1)O点为什么不导电
(2)a、b、c三点c(H+)由大到小的顺序是
(3)a、b、c三点中醋酸的电离程度最大的点是
(4)若使c点溶液中的c(CH3COO-)提高,可采取的措施是
A.加热B.加很稀的NaOH溶液C.加固体KOH D.加水E.加固体CH3COONa F.加锌粉
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】25℃时,部分物质的电离平衡常数如下表所示:
(1)H2CO3的电离方程式是______________ 。
(2)下列方法中可以使0.10mol/L醋酸溶液中CH3COOH电离程度增大的是_____________ (填字母序号)。
a.滴加少量浓盐酸b.微热溶液
c.加水稀释d.加入少量醋酸钠晶体
(3)25°C时,物质的量浓度与体积均相同的醋酸溶液A与盐酸B分别与足量锌片充分反应,下列说法正确的是_____________ (填字母序号)。
a.开始反应时的速率:A<B
b.放出等量氢气所需要的时间A=B
c.生成氢气的总体积:A>B
(4)25°C时下,物质的量浓度相等的CH3COOH溶液和H2CO3溶液pH大小关系是:CH3COOH______________ H2CO3(填“>”、“<”或“=”),你判断的依据是______________ 。
(5)向NaClO溶液中通入少量二氧化碳气体,发生反应的离子方程式是______________ ,结合所给数据说明理由______________ 。
(6)25℃时,物质的量浓度为0.10mol/L的氨水中,c(OH-)为______________ (列出表达式)。
| 化学式 | CH3COOH | H2CO3 | HClO | NH3.H2O |
| 电离平衡常数 | 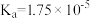 | 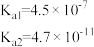 | 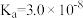 | 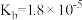 |
(2)下列方法中可以使0.10mol/L醋酸溶液中CH3COOH电离程度增大的是
a.滴加少量浓盐酸b.微热溶液
c.加水稀释d.加入少量醋酸钠晶体
(3)25°C时,物质的量浓度与体积均相同的醋酸溶液A与盐酸B分别与足量锌片充分反应,下列说法正确的是
a.开始反应时的速率:A<B
b.放出等量氢气所需要的时间A=B
c.生成氢气的总体积:A>B
(4)25°C时下,物质的量浓度相等的CH3COOH溶液和H2CO3溶液pH大小关系是:CH3COOH
(5)向NaClO溶液中通入少量二氧化碳气体,发生反应的离子方程式是
(6)25℃时,物质的量浓度为0.10mol/L的氨水中,c(OH-)为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐[已知: ,
, ]。
]。
(1)醋酸钠溶液呈碱性的原因是___________ (用离子方程式表示)。
(2)在 溶液中离子浓度由大到小的顺序为[用
溶液中离子浓度由大到小的顺序为[用 表示相应离子浓度]:
表示相应离子浓度]:_____ 。
(3) 时,
时, 的醋酸溶液的
的醋酸溶液的 约为
约为_____ (已知: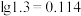 )。
)。
(4)下列对于醋酸溶液和醋酸钠溶液的说法正确的是_____(填字母,下同)。
(5)常温时,有以下3种溶液,其中 最小的是
最小的是_____ 。
A.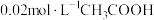 与
与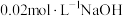 溶液等体积混合液
溶液等体积混合液
B.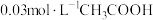 与
与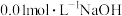 溶液等体积混合液
溶液等体积混合液
C. 的
的 与
与 的
的 溶液等体积混合液
溶液等体积混合液
 ,
, ]。
]。(1)醋酸钠溶液呈碱性的原因是
(2)在
 溶液中离子浓度由大到小的顺序为[用
溶液中离子浓度由大到小的顺序为[用 表示相应离子浓度]:
表示相应离子浓度]:(3)
 时,
时, 的醋酸溶液的
的醋酸溶液的 约为
约为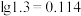 )。
)。(4)下列对于醋酸溶液和醋酸钠溶液的说法正确的是_____(填字母,下同)。
| A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小 |
| B.升高温度可以促进醋酸电离,也可以促进醋酸钠水解 |
| C.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离 |
| D.醋酸和醋酸钠的混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离 |
 最小的是
最小的是A.
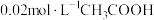 与
与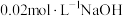 溶液等体积混合液
溶液等体积混合液B.
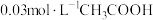 与
与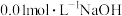 溶液等体积混合液
溶液等体积混合液C.
 的
的 与
与 的
的 溶液等体积混合液
溶液等体积混合液
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】现有室温下浓度均为1×10-3mol/L的几种溶液:①盐酸、②硫酸、③醋酸、④氯化铵、⑤氨水、⑥NaOH溶液,回答下列问题:
(1)将③、⑥混合后,若溶液呈中性,溶液中的离子浓度由大到小的顺序为____ 。
(2)将等体积的①、⑤混合,则溶液的pH____ 7(填>、=、<),用离子方程式说明其原因____ 。
(3)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的顺序为____ ,最终产生H2总量的关系为_____ 。
(4)向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,充分混合后,混合液的pH大小关系为①_____ ③(填>、=、<)。
(5)若将等体积的⑤、⑥溶液加热至相同温度后,溶液的pH⑤____ ⑥(填>、=、<)。
(1)将③、⑥混合后,若溶液呈中性,溶液中的离子浓度由大到小的顺序为
(2)将等体积的①、⑤混合,则溶液的pH
(3)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的顺序为
(4)向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,充分混合后,混合液的pH大小关系为①
(5)若将等体积的⑤、⑥溶液加热至相同温度后,溶液的pH⑤
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】Ⅰ.有下列物质的溶液:① ②
② ③
③ ④
④
(1)若四种溶液的物质的量浓度相同,其 的大小比较为
的大小比较为_______ (用序号表示,下同)。
(2)若四种溶液的 相同,其物质的量浓度的大小比较为
相同,其物质的量浓度的大小比较为_______ 。
Ⅱ.向菱镁矿(主要成分为,含少量 )中首先加入稀硫酸,过滤后,再加入
)中首先加入稀硫酸,过滤后,再加入 。然后加入
。然后加入 调节溶液的
调节溶液的 ,过滤,可制得纯净的溶液。
,过滤,可制得纯净的溶液。
(3)① 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为_______ 。
②加入 氧化时,发生反应的离子方程式为
氧化时,发生反应的离子方程式为_______ 。
③实验室中可用 溶液与
溶液与 溶液反应制取
溶液反应制取 ,写出该反应的离子方程式:
,写出该反应的离子方程式:_______ 。
 ②
② ③
③ ④
④
(1)若四种溶液的物质的量浓度相同,其
 的大小比较为
的大小比较为(2)若四种溶液的
 相同,其物质的量浓度的大小比较为
相同,其物质的量浓度的大小比较为Ⅱ.向菱镁矿(主要成分为,含少量
 )中首先加入稀硫酸,过滤后,再加入
)中首先加入稀硫酸,过滤后,再加入 。然后加入
。然后加入 调节溶液的
调节溶液的 ,过滤,可制得纯净的溶液。
,过滤,可制得纯净的溶液。(3)①
 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为②加入
 氧化时,发生反应的离子方程式为
氧化时,发生反应的离子方程式为③实验室中可用
 溶液与
溶液与 溶液反应制取
溶液反应制取 ,写出该反应的离子方程式:
,写出该反应的离子方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】市售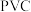 是由
是由 水解产生的一系列中间产物脱水聚合而成,其中稳定存在形态为聚十三铝
水解产生的一系列中间产物脱水聚合而成,其中稳定存在形态为聚十三铝 ,简称
,简称 。
。 含量的高低直接影响
含量的高低直接影响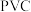 的净水效能。
的净水效能。
(1) 溶液中,
溶液中, 逐级水解能生成
逐级水解能生成 、
、 等单体。生成
等单体。生成 的离子方程式为
的离子方程式为___________ 。
(2)向 溶液中缓慢滴加一定量
溶液中缓慢滴加一定量 溶液,若只生成
溶液,若只生成 ,则理论上
,则理论上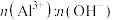 =
=___________ 提纯 胶体可采取的措施是
胶体可采取的措施是___________ 。
(3)为了发挥 净水的最佳效能,一般要将水的
净水的最佳效能,一般要将水的 调节在6.0~8.5.若在强酸或强碱环境下使用
调节在6.0~8.5.若在强酸或强碱环境下使用 ,净水效果不佳,结合铝元素的存在形式分析原因
,净水效果不佳,结合铝元素的存在形式分析原因___________ 。
 是由
是由 水解产生的一系列中间产物脱水聚合而成,其中稳定存在形态为聚十三铝
水解产生的一系列中间产物脱水聚合而成,其中稳定存在形态为聚十三铝 ,简称
,简称 。
。 含量的高低直接影响
含量的高低直接影响 的净水效能。
的净水效能。(1)
 溶液中,
溶液中, 逐级水解能生成
逐级水解能生成 、
、 等单体。生成
等单体。生成 的离子方程式为
的离子方程式为(2)向
 溶液中缓慢滴加一定量
溶液中缓慢滴加一定量 溶液,若只生成
溶液,若只生成 ,则理论上
,则理论上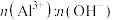 =
= 胶体可采取的措施是
胶体可采取的措施是(3)为了发挥
 净水的最佳效能,一般要将水的
净水的最佳效能,一般要将水的 调节在6.0~8.5.若在强酸或强碱环境下使用
调节在6.0~8.5.若在强酸或强碱环境下使用 ,净水效果不佳,结合铝元素的存在形式分析原因
,净水效果不佳,结合铝元素的存在形式分析原因
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】已知常温下几种弱酸的电离平衡常数,根据溶液中的离子反应,回答下列问题:
(1)该温度下 溶液呈
溶液呈_______ (填“酸性”、“碱性”、“中性”)。
(2)等浓度的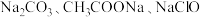 盐溶液的碱性由强到弱顺序为
盐溶液的碱性由强到弱顺序为_______ 。
(3)常温下, 盐酸与
盐酸与 的氨水等体积混合后所得溶液中存在的离子,其浓度由大到小顺序为
的氨水等体积混合后所得溶液中存在的离子,其浓度由大到小顺序为_______ 。
(4)该温度下 的水解反应的平衡常数
的水解反应的平衡常数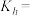
_______ 。
(5)写出少量 通入
通入 溶液中发生反应的离子方程式为
溶液中发生反应的离子方程式为_______ 。
 |  |  |  |
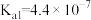 |  | 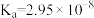 | 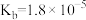 |
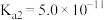 |
 溶液呈
溶液呈(2)等浓度的
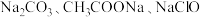 盐溶液的碱性由强到弱顺序为
盐溶液的碱性由强到弱顺序为(3)常温下,
 盐酸与
盐酸与 的氨水等体积混合后所得溶液中存在的离子,其浓度由大到小顺序为
的氨水等体积混合后所得溶液中存在的离子,其浓度由大到小顺序为(4)该温度下
 的水解反应的平衡常数
的水解反应的平衡常数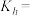
(5)写出少量
 通入
通入 溶液中发生反应的离子方程式为
溶液中发生反应的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】磷酸盐缓冲液(简称PBS)是生物学上常用于细胞培养的缓冲液,主要成分为磷酸二氢钠和磷酸氢二钠。 是一种三元酸,下图为某浓度
是一种三元酸,下图为某浓度 溶液中各种微粒的物质的量分数随pH的变化曲线。
溶液中各种微粒的物质的量分数随pH的变化曲线。___________ 作为指示剂,当溶液呈浅粉色时停止滴定,溶液中的溶质为___________ 和___________ (填化学式)。
(2)从图上可知,磷酸氢二钠溶液呈___________ 性(填“酸”、“碱”或“中”),原因是____________ ;当pH=4.3时溶液中只有一种溶质,此时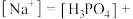
______________________________ 。
(3)PBS可用于维持疫苗贮存的酸碱度,试从化学平衡的角度解释其主要作用:________________ 。
 是一种三元酸,下图为某浓度
是一种三元酸,下图为某浓度 溶液中各种微粒的物质的量分数随pH的变化曲线。
溶液中各种微粒的物质的量分数随pH的变化曲线。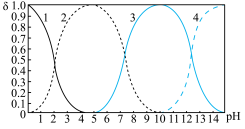
(2)从图上可知,磷酸氢二钠溶液呈
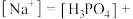
(3)PBS可用于维持疫苗贮存的酸碱度,试从化学平衡的角度解释其主要作用:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】磷的含氧酸具有重要的性质和应用。
(1) 是二元弱酸,某温度下,
是二元弱酸,某温度下, 的
的 溶液
溶液 ,即溶液中
,即溶液中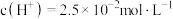 。求该温度下
。求该温度下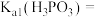
_______ 。( 的第二步电离忽略不计,结果用科学记数法表示,保留两位有效数字)
的第二步电离忽略不计,结果用科学记数法表示,保留两位有效数字)
(2) 是三元中强酸,
是三元中强酸, 时,
时, 与
与 溶液反应,反应混合物中含磷各微粒的分布分数(平衡时某微粒的浓度占微粒浓度之和的分数)与
溶液反应,反应混合物中含磷各微粒的分布分数(平衡时某微粒的浓度占微粒浓度之和的分数)与 的关系如图所示:
的关系如图所示:
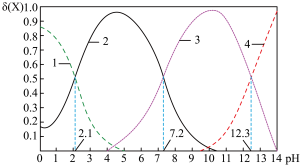
① 溶液显碱性,原因是
溶液显碱性,原因是________ ,若向溶液中加入足量的 溶液,溶液则显酸性,其原因是
溶液,溶液则显酸性,其原因是________ (用离子方程式表示)。
② 时,溶液中的
时,溶液中的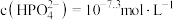 ,则
,则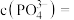
______  。
。
③ 时,溶液中由水电离出的
时,溶液中由水电离出的
______  。
。
④已知: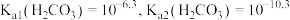 ,写出足量碳酸钠与
,写出足量碳酸钠与 反应的化学方程式:
反应的化学方程式:_______ 。
⑤以酚䣭为指示剂,当溶液由无色变为浅红色时,写出发生主要反应的离子方程:______ 。
⑥ 时,溶液中的电荷守恒关系为
时,溶液中的电荷守恒关系为_________ 。
(1)
 是二元弱酸,某温度下,
是二元弱酸,某温度下, 的
的 溶液
溶液 ,即溶液中
,即溶液中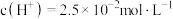 。求该温度下
。求该温度下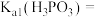
 的第二步电离忽略不计,结果用科学记数法表示,保留两位有效数字)
的第二步电离忽略不计,结果用科学记数法表示,保留两位有效数字)(2)
 是三元中强酸,
是三元中强酸, 时,
时, 与
与 溶液反应,反应混合物中含磷各微粒的分布分数(平衡时某微粒的浓度占微粒浓度之和的分数)与
溶液反应,反应混合物中含磷各微粒的分布分数(平衡时某微粒的浓度占微粒浓度之和的分数)与 的关系如图所示:
的关系如图所示:
①
 溶液显碱性,原因是
溶液显碱性,原因是 溶液,溶液则显酸性,其原因是
溶液,溶液则显酸性,其原因是②
 时,溶液中的
时,溶液中的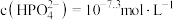 ,则
,则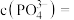
 。
。③
 时,溶液中由水电离出的
时,溶液中由水电离出的
 。
。④已知:
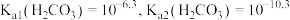 ,写出足量碳酸钠与
,写出足量碳酸钠与 反应的化学方程式:
反应的化学方程式:⑤以酚䣭为指示剂,当溶液由无色变为浅红色时,写出发生主要反应的离子方程:
⑥
 时,溶液中的电荷守恒关系为
时,溶液中的电荷守恒关系为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】亚砷酸(H3AsO3)可用于治疗急性早幼粒细胞白血病,可通过注射至血液的方式直接给药。医用的亚砷酸溶液可通过将As2O3溶于过量NaOH溶液后加稀硫酸配置。一般情况下,亚砷酸溶液中各种微粒的物质的量分数与pH的关系如图所示。
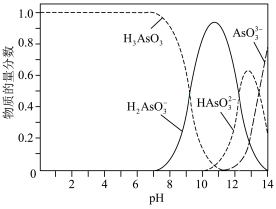
(1)写出As2O3溶于过量NaOH溶液的离子方程式:___________ 。
(2)将亚砷酸溶液注入一般情况下的血液后,砷元素的主要存在形式为___________ (填微粒化学符号)。
(3)该条件下,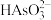 的电离平衡常数Ka3与
的电离平衡常数Ka3与 的水解平衡常数Kh1的大小关系为Ka3
的水解平衡常数Kh1的大小关系为Ka3 ____ Kh1(填“>”、“<”或“=”,下同)。对于0.1 mol/L Na2HAsO3溶液而言,c(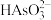 )
)______ c( )。
)。

(1)写出As2O3溶于过量NaOH溶液的离子方程式:
(2)将亚砷酸溶液注入一般情况下的血液后,砷元素的主要存在形式为
(3)该条件下,
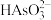 的电离平衡常数Ka3与
的电离平衡常数Ka3与 的水解平衡常数Kh1的大小关系为Ka3
的水解平衡常数Kh1的大小关系为Ka3 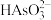 )
) )。
)。
您最近一年使用:0次



