在氢氟酸溶液中,存在如下电离平衡:HF⇌H++F-
(1)加入固体NaOH,电离平衡向______ 反应方向移动,c(H+)______ .
(2)加入固体NaF,电离平衡向______ 反应方向移动.
(3)升高温度,电离平衡向______ 反应方向移动.
(4)常温下,小苏打溶液呈______ 性,原因是_________________________ (用必要的离子方程式及文字解释表示).

(5)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示,则图中表示醋酸溶液中pH变化曲线的是______ (填“A”或“B”);设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2则m1______ m2(选填“>”、“=”“<”)
(1)加入固体NaOH,电离平衡向
(2)加入固体NaF,电离平衡向
(3)升高温度,电离平衡向
(4)常温下,小苏打溶液呈

(5)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示,则图中表示醋酸溶液中pH变化曲线的是
更新时间:2019-12-19 18:57:34
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】醋酸是我们生活中常见的一种酸。请回答下列问题:
(1)在 的
的 溶液中,要促进醋酸电离且使
溶液中,要促进醋酸电离且使 浓度增大,应采取的措施是_____
浓度增大,应采取的措施是_____
(2)常温下,有 c(H+) 相同、体积相同的 溶液和
溶液和 溶液,现采取以下措施:
溶液,现采取以下措施:
①分别加适量醋酸钠晶体后, 溶液中
溶液中
______  填“增大”、“减小”或“不变”,下同
填“增大”、“减小”或“不变”,下同 ,
, 溶液中
溶液中
______ 。
②分别加水稀释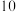 倍后,
倍后, 溶液中的
溶液中的
______  填“
填“ ”、“
”、“ ”或“
”或“ ”
” 溶液中的
溶液中的 。
。
③分别加等浓度的 溶液至恰好反应,所需
溶液至恰好反应,所需 溶液的体积:
溶液的体积: 溶液
溶液______  填“
填“ ”、“
”、“ ”或“
”或“ ”
” 溶液。
溶液。
④温度都升高 ,
, 溶液中
溶液中
______  填“
填“ ”、“
”、“ ”或“
”或“ ”
” 溶液中
溶液中 。
。
(3)将 的
的 溶液加水稀释,下列有关稀释后
溶液加水稀释,下列有关稀释后 溶液的说法正确的是______。
溶液的说法正确的是______。
(4)25℃时,醋酸、碳酸和亚硫酸的电离常数如表所示。
①碳酸第一步电离的电离常数表达式为______ 。
②在相同条件下,试比较 、
、 和
和 与H+的结合能力大小:
与H+的结合能力大小:____ 
___ 
____ 。
③书写亚硫酸与碳酸氢钠溶液反应的离子方程式______
(1)在
 的
的 溶液中,要促进醋酸电离且使
溶液中,要促进醋酸电离且使 浓度增大,应采取的措施是_____
浓度增大,应采取的措施是_____| A.升温 | B.加水 | C.加入 溶液 溶液 | D.加入稀盐酸 |
 溶液和
溶液和 溶液,现采取以下措施:
溶液,现采取以下措施:①分别加适量醋酸钠晶体后,
 溶液中
溶液中
 填“增大”、“减小”或“不变”,下同
填“增大”、“减小”或“不变”,下同 ,
, 溶液中
溶液中
②分别加水稀释
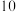 倍后,
倍后, 溶液中的
溶液中的
 填“
填“ ”、“
”、“ ”或“
”或“ ”
” 溶液中的
溶液中的 。
。③分别加等浓度的
 溶液至恰好反应,所需
溶液至恰好反应,所需 溶液的体积:
溶液的体积: 溶液
溶液 填“
填“ ”、“
”、“ ”或“
”或“ ”
” 溶液。
溶液。④温度都升高
 ,
, 溶液中
溶液中
 填“
填“ ”、“
”、“ ”或“
”或“ ”
” 溶液中
溶液中 。
。(3)将
 的
的 溶液加水稀释,下列有关稀释后
溶液加水稀释,下列有关稀释后 溶液的说法正确的是______。
溶液的说法正确的是______。| A.电离程度增大 | B.溶液中离子总数增多 |
| C.溶液导电性增强 | D.溶液中醋酸分子增多 |
| 酸 | 电离常数 |
| 醋酸 | 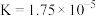 |
| 碳酸 | 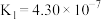 , ,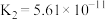 |
| 亚硫酸 | 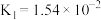 , ,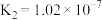 |
①碳酸第一步电离的电离常数表达式为
②在相同条件下,试比较
 、
、 和
和 与H+的结合能力大小:
与H+的结合能力大小:

③书写亚硫酸与碳酸氢钠溶液反应的离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】请用化学平衡的相关知识回答下列问题(忽略混合溶液体积的变化):
(1)常温下,氨水的 ,用离子方程式解释其原因:
,用离子方程式解释其原因:_______ 。
(2)25℃时,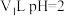 的盐酸和
的盐酸和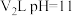 的
的 溶液混合后,混合溶液的
溶液混合后,混合溶液的 ,则
,则
_______ 。
(3)25℃时, 溶液和盐酸的物质的量浓度相同。
溶液和盐酸的物质的量浓度相同。
①加水稀释至相同的倍数,此时 溶液的
溶液的
_______ (填“大于”、“小于”或“等于")盐酸的 。
。
②加水稀释至相同的 ,此时加入
,此时加入 溶液中水的体积
溶液中水的体积_______ (填“大于”、“小于”或“等于”)加入盐酸中水的体积。
(4)常温下, 溶液中
溶液中
_______ (用含 和
和 的代数式表示)。
的代数式表示)。
(1)常温下,氨水的
 ,用离子方程式解释其原因:
,用离子方程式解释其原因:(2)25℃时,
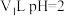 的盐酸和
的盐酸和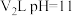 的
的 溶液混合后,混合溶液的
溶液混合后,混合溶液的 ,则
,则
(3)25℃时,
 溶液和盐酸的物质的量浓度相同。
溶液和盐酸的物质的量浓度相同。①加水稀释至相同的倍数,此时
 溶液的
溶液的
 。
。②加水稀释至相同的
 ,此时加入
,此时加入 溶液中水的体积
溶液中水的体积(4)常温下,
 溶液中
溶液中
 和
和 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】浓度均为0.01mol•L-1的盐酸(A)、醋酸溶液(B)、氢氧化钠溶液(C):
(1)写出B溶液中醋酸的电离方程式:______________ 。上述溶液稀释10倍后pH减小的是______________ (填字母)。
(2)取等体积的A、B两溶液分别加入过量的锌粉,反应开始时放出H2的速率依次为a1、a2,则a1______________ (填“>”“<”或“=”,下同)a2。反应结束时放出H2的物质的量为n1、n2,则n1______________ n2。
(3)完全中和体积与物质的量浓度均相同的两份C溶液时,需A、B两溶液的体积依次为V1、V2则V1______________ V2;若完全中和体积与pH均相同的A、B两溶液时消耗C溶液的体积分别为V(A)、V(B),则V(A)______________ V(B)。
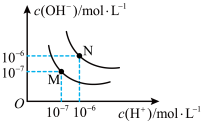
(4)图中M点表示25℃时水在电离平衡时的离子浓度N点表示T℃时水在电离平衡时的离子浓度。T℃时,3×10-3mol•L-1的氢氧化钠溶液与1×10-3mol•L-1盐酸等体积混合后溶液的pH=______________ 。
(1)写出B溶液中醋酸的电离方程式:
(2)取等体积的A、B两溶液分别加入过量的锌粉,反应开始时放出H2的速率依次为a1、a2,则a1
(3)完全中和体积与物质的量浓度均相同的两份C溶液时,需A、B两溶液的体积依次为V1、V2则V1
(4)图中M点表示25℃时水在电离平衡时的离子浓度N点表示T℃时水在电离平衡时的离子浓度。T℃时,3×10-3mol•L-1的氢氧化钠溶液与1×10-3mol•L-1盐酸等体积混合后溶液的pH=

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)pH=13的CH3COONa溶液加水稀释100倍后,pH________ 11(填“>”“=”或“<”)原因是_______________________ (用离子方程式和必要的文字说明);
(2)pH相等时,①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中c( )由大到小的顺序为
)由大到小的顺序为_______________ ;(填数字序号)
(3)等体积、等浓度的氢氧化钠与醋酸混合后溶液呈_____ 性,溶液中c(Na+)_____ c(CH3COO-) (填“>”“=”或“<”);pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈________ 性,溶液中c(Na+)________ c(CH3COO-)(填“>”“=”或“<”);
(4)将物质的量浓度相同的盐酸与氨水混合后,溶液中的c(NH4+)=c(Cl-),则混合后溶液呈________ 性,盐酸的体积________ 氨水的体积(填“>”“=”或“<”);
(5)向300mL1mol/L氢氧化钠溶液中通入4.48LCO2(标准状况),充分反应后,所得溶液中存在的物料守恒关系式为:_____________________________________
(2)pH相等时,①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中c(
 )由大到小的顺序为
)由大到小的顺序为(3)等体积、等浓度的氢氧化钠与醋酸混合后溶液呈
(4)将物质的量浓度相同的盐酸与氨水混合后,溶液中的c(NH4+)=c(Cl-),则混合后溶液呈
(5)向300mL1mol/L氢氧化钠溶液中通入4.48LCO2(标准状况),充分反应后,所得溶液中存在的物料守恒关系式为:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】已知:25 ℃时,CH3COOH和NH3·H2O的电离常数相等。
(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。将溶液加水稀释至100 mL,溶液pH数值范围为___________ ,溶液中
____ (填“增大”“减小”“不变”或“不能确定”)。
(2)25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=______ ;
(3)某温度下,向V1mL 0.1 mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=- lgc(OH-)。图中M、Q、N三点所示溶液中水的电离程度最大的点是___________ 。

(1)25 ℃时,取10 mL 0.1 mol·L-1醋酸溶液测得其pH=3。将溶液加水稀释至100 mL,溶液pH数值范围为

(2)25 ℃时,0.1 mol·L-1氨水(NH3·H2O溶液)的pH=
(3)某温度下,向V1mL 0.1 mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=- lgc(OH-)。图中M、Q、N三点所示溶液中水的电离程度最大的点是

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】请根据化学平衡影响因素的相关知识,分析温度、浓度等外界条件对电离平衡的影响?完成下表:
CH3COOH CH3COO-+H+
CH3COO-+H+
CH3COOH
 CH3COO-+H+
CH3COO-+H+ | 改变条件 | 平衡移动方向 | c(H+) | c(Ac-) | c(HAc) | 电离程度 |
| 加热 | |||||
| 加盐酸 | |||||
| 加NaOH(s) | |||||
| 加NaAc(s) | |||||
| 加CH3COOH | |||||
| 加水 |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】已知水的电离平衡曲线如图所示:

回答下列问题:
(1)图中C点水的离子积常数为__________ 。
(2)A、B、C、D四点KW的关系是_____ 。
(3)从A点到D点,可采取的措施是____ 。
a.升温 b.加入少量盐酸 c.降温 d.加入少量NaOH
(4)100℃时,pH=2的盐酸中水电离产生的H+浓度为_______ 。
(5)25℃时,将pH=12的NaOH溶液与pH=3的H2SO4溶液混合,若所得混合溶液pH=7,则NaOH溶液与H2SO4溶液的体积比为____ 。
(6)室温下,实验测得0.1mol·L-1醋酸溶液的pH=3,下列说法正确的是_________
a.醋酸是弱电解质 b.醋酸电离使溶液中c(H+)>c(OH-)
c.醋酸电离出的H+抑制水的电离 d.溶液中的H+全部来自醋酸

回答下列问题:
(1)图中C点水的离子积常数为
(2)A、B、C、D四点KW的关系是
(3)从A点到D点,可采取的措施是
a.升温 b.加入少量盐酸 c.降温 d.加入少量NaOH
(4)100℃时,pH=2的盐酸中水电离产生的H+浓度为
(5)25℃时,将pH=12的NaOH溶液与pH=3的H2SO4溶液混合,若所得混合溶液pH=7,则NaOH溶液与H2SO4溶液的体积比为
(6)室温下,实验测得0.1mol·L-1醋酸溶液的pH=3,下列说法正确的是
a.醋酸是弱电解质 b.醋酸电离使溶液中c(H+)>c(OH-)
c.醋酸电离出的H+抑制水的电离 d.溶液中的H+全部来自醋酸
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】分析外界条件对醋酸电离平衡的影响,填写下表(用“→”或“←”表示移动方向;用“↑”或“↓”表示物理量变化):
| CH3COOH稀溶液 | CH3COOH CH3COO-+H+ ΔH>0 CH3COO-+H+ ΔH>0 | ||||
| 条件改变 | 平衡移动方向 | c(H+) | n(H+) | 电离程度 | 导电能力 |
| 升高温度 | |||||
| 加H2O | |||||
| 通HCl | |||||
| 加少量NaOH(s) | |||||
| 加少量CH3COONa (s) | |||||
| 加少量CH3COOH | |||||
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】影响电离平的因素
(1)内因:_______________________
(2)外因:
温度:电离过程是_______ 过程,升高温度, 平衡向_______ 方向移动
浓度:加水稀释,电离程度_______ ;增加弱电解质浓度,电离向_____ 方向移动,但电离程度_____ 。
其他:加入同弱电解质电离所产生的离子相同的离子,电离平衡向____ 方向移动;加入能与弱电解质电离产生的离子反应的物质时,电离平衡向________ 方向移动。
(1)内因:
(2)外因:
温度:电离过程是
浓度:加水稀释,电离程度
其他:加入同弱电解质电离所产生的离子相同的离子,电离平衡向
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】Na2S2O3、Na2S、Na2SO3等含硫化合物在工业上有广泛的用途。
完成下列填空:
(1)若将Na2S2O3中的硫元素看作为+2价,下列反应中与Na2S2O3+H2SO4(稀) → Na2SO4+S↓+SO2↑+H2O属于同一类型的是_______ (填序号)。
a.2H2S+SO2→ 3S↓+2H2O
b.3NaClO 2NaCl+NaClO3
2NaCl+NaClO3
c.S+2H2SO4(浓) 3SO2↑+2H2O
3SO2↑+2H2O
d.4P+3NaOH+3H2O → 3NaH2PO2+PH3↑
(2)棉织物用氯气漂白后,加入Na2S2O3除去余氯时,发生如下反应:
____ S2O32―+____ Cl2+________ → ___ SO42―+___ Cl―+___ H+
完成并配平该反应方程式;若反应中生成0.2 mol SO42―,则转移电子___________ mol。
(3)下图是Na2SO3溶液中各离子浓度的相对大小关系示意图。其中,②是_______ ,④是______ (填微粒符号)。

(4)已知Na2S溶液显碱性,其主要原因是_________________ (用离子方程式解释)。往装有Na2S溶液的烧杯中加入足量的ZnCl2溶液,产生白色的ZnS沉淀;再向烧杯中滴加CuCl2溶液,沉淀转变为黑色。请用溶解平衡原理解释上述现象______________________________________ 。
完成下列填空:
(1)若将Na2S2O3中的硫元素看作为+2价,下列反应中与Na2S2O3+H2SO4(稀) → Na2SO4+S↓+SO2↑+H2O属于同一类型的是
a.2H2S+SO2→ 3S↓+2H2O
b.3NaClO
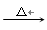 2NaCl+NaClO3
2NaCl+NaClO3c.S+2H2SO4(浓)
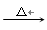 3SO2↑+2H2O
3SO2↑+2H2Od.4P+3NaOH+3H2O → 3NaH2PO2+PH3↑
(2)棉织物用氯气漂白后,加入Na2S2O3除去余氯时,发生如下反应:
完成并配平该反应方程式;若反应中生成0.2 mol SO42―,则转移电子
(3)下图是Na2SO3溶液中各离子浓度的相对大小关系示意图。其中,②是

(4)已知Na2S溶液显碱性,其主要原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】Ⅰ.水在25℃和95℃时电离平衡曲线如图。

(1)25℃时水的电离平衡曲线应为_______ (“A”或“B”)。25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为_______ 。
(2)95℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性;则a与b之间应满足的关系是_______ 。
(3)曲线A所对应的温度下,pH=2的HCl溶液和pH=11的某BOH溶液中,若水的电离程度分别用ɑ1、ɑ2表示,则ɑ1_______ ɑ2(填“大于”“小于”“等于”“无法确定”)
(4)在曲线B所对应的温度下,将0.02 mol/L的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH=_______ 。
(5)25℃时,0.10 mol·L-1的HA溶液中 =1010,该HA溶液的pH=
=1010,该HA溶液的pH=_______ 。
Ⅱ.醋酸钠一种常见的强碱弱酸盐
(6)醋酸钠在水溶液中水解的离子方程式_______ 。
(7)将物质的量浓度相同的盐酸与氨水混合后,溶液中的呈中性,则盐酸的体积_______ 氨水的体积(填“>”“<””或“=”)。
(8)pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后,CH3COONa溶液的pH_______ NaOH溶液的pH(填“>”“<””或“=”)。

(1)25℃时水的电离平衡曲线应为
(2)95℃时,若100体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性;则a与b之间应满足的关系是
(3)曲线A所对应的温度下,pH=2的HCl溶液和pH=11的某BOH溶液中,若水的电离程度分别用ɑ1、ɑ2表示,则ɑ1
(4)在曲线B所对应的温度下,将0.02 mol/L的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH=
(5)25℃时,0.10 mol·L-1的HA溶液中
 =1010,该HA溶液的pH=
=1010,该HA溶液的pH=Ⅱ.醋酸钠一种常见的强碱弱酸盐
(6)醋酸钠在水溶液中水解的离子方程式
(7)将物质的量浓度相同的盐酸与氨水混合后,溶液中的呈中性,则盐酸的体积
(8)pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后,CH3COONa溶液的pH
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】已知草酸为二元弱酸:


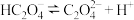

常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,所得溶液中 、
、 、
、 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:

(1)如果所得溶液溶质为 ,则该溶液显
,则该溶液显______ (填“酸性”、“碱性”或“中性”); 的电离程度
的电离程度______ 水解程度(填“大于”、“等于”或“小于”)
(2)如果所得溶液溶质为 ,则该溶液中各离子浓度由大到小顺序为
,则该溶液中各离子浓度由大到小顺序为_____________ 。由电荷守恒得出的等式为__________________ 。
(3)当所得溶液pH=2.7时,溶液中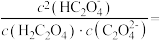
______ ;
(4)常温下,将体积相同,pH均等于10的 和KOH溶液,分别加水稀释m倍、n倍,稀释后溶液的pH都变成9,则m与n的大小关系为
和KOH溶液,分别加水稀释m倍、n倍,稀释后溶液的pH都变成9,则m与n的大小关系为______ 。


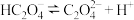

常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,所得溶液中
 、
、 、
、 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,回答下列问题:
(1)如果所得溶液溶质为
 ,则该溶液显
,则该溶液显 的电离程度
的电离程度(2)如果所得溶液溶质为
 ,则该溶液中各离子浓度由大到小顺序为
,则该溶液中各离子浓度由大到小顺序为(3)当所得溶液pH=2.7时,溶液中
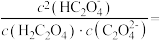
(4)常温下,将体积相同,pH均等于10的
 和KOH溶液,分别加水稀释m倍、n倍,稀释后溶液的pH都变成9,则m与n的大小关系为
和KOH溶液,分别加水稀释m倍、n倍,稀释后溶液的pH都变成9,则m与n的大小关系为
您最近一年使用:0次



