浓度均为0.01mol•L-1的盐酸(A)、醋酸溶液(B)、氢氧化钠溶液(C):
(1)写出B溶液中醋酸的电离方程式:______________ 。上述溶液稀释10倍后pH减小的是______________ (填字母)。
(2)取等体积的A、B两溶液分别加入过量的锌粉,反应开始时放出H2的速率依次为a1、a2,则a1______________ (填“>”“<”或“=”,下同)a2。反应结束时放出H2的物质的量为n1、n2,则n1______________ n2。
(3)完全中和体积与物质的量浓度均相同的两份C溶液时,需A、B两溶液的体积依次为V1、V2则V1______________ V2;若完全中和体积与pH均相同的A、B两溶液时消耗C溶液的体积分别为V(A)、V(B),则V(A)______________ V(B)。
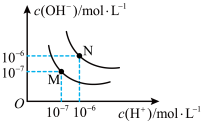
(4)图中M点表示25℃时水在电离平衡时的离子浓度N点表示T℃时水在电离平衡时的离子浓度。T℃时,3×10-3mol•L-1的氢氧化钠溶液与1×10-3mol•L-1盐酸等体积混合后溶液的pH=______________ 。
(1)写出B溶液中醋酸的电离方程式:
(2)取等体积的A、B两溶液分别加入过量的锌粉,反应开始时放出H2的速率依次为a1、a2,则a1
(3)完全中和体积与物质的量浓度均相同的两份C溶液时,需A、B两溶液的体积依次为V1、V2则V1
(4)图中M点表示25℃时水在电离平衡时的离子浓度N点表示T℃时水在电离平衡时的离子浓度。T℃时,3×10-3mol•L-1的氢氧化钠溶液与1×10-3mol•L-1盐酸等体积混合后溶液的pH=

更新时间:2020-05-17 20:49:42
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】(1)25℃时,0.05mol/LH2SO4溶液的pH=______ ,0.01mol/LNaOH溶液的pH=______ 。
(2)某温度下纯水的c(H+)=4.0×10-7mol/L,则此溶液中的c(OH-)=_______ ;若温度不变,滴入稀盐酸,使c(H+)=2.0×10-4mol/L,则此溶液中由水电离产生的c(H+)=_________ 。
(3)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s) Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)·c2(OH-)=2×10-20。某硫酸铜溶液里c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液使之pH>
Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)·c2(OH-)=2×10-20。某硫酸铜溶液里c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液使之pH>________
(2)某温度下纯水的c(H+)=4.0×10-7mol/L,则此溶液中的c(OH-)=
(3)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s)
 Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)·c2(OH-)=2×10-20。某硫酸铜溶液里c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液使之pH>
Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)·c2(OH-)=2×10-20。某硫酸铜溶液里c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液使之pH>
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:
(1)A点水的离子积为1×10-14,B点水的离子积为___ 。造成水的离子积变化的原因是________ 。
(2)下列说法正确的是___ 。
a.A、B、D三点处Kw的大小关系:B>A>D b.AB线上任意点的溶液均显中性
c.B点溶液的pH=6,显酸性d.图中温度T1>T2
(3)T2℃时,若向溶液中滴加盐酸,能否使体系处于B点位置?___ 为什么?___________ 。
(4)T2℃时,若盐酸中c(H+)=5×10-4mol·L-1,则由水电离产生的c(H+)=____ 。

(1)A点水的离子积为1×10-14,B点水的离子积为
(2)下列说法正确的是
a.A、B、D三点处Kw的大小关系:B>A>D b.AB线上任意点的溶液均显中性
c.B点溶液的pH=6,显酸性d.图中温度T1>T2
(3)T2℃时,若向溶液中滴加盐酸,能否使体系处于B点位置?
(4)T2℃时,若盐酸中c(H+)=5×10-4mol·L-1,则由水电离产生的c(H+)=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】已知水的电离平衡曲线如图所示,试回答下列问题:

(1)图中五点的Kw间的关系是___________ 。
(2)若从A点到D点,可采用的措施是________ 。
a. 升温 b. 加入少量的盐酸 c. 加入少量的NaOH
(3)点E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为________ 。
(4)点B对应的温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是___ 。

(1)图中五点的Kw间的关系是
(2)若从A点到D点,可采用的措施是
a. 升温 b. 加入少量的盐酸 c. 加入少量的NaOH
(3)点E对应的温度下,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为
(4)点B对应的温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】(1)下列溶液一定呈中性的是___________ 。
A.pH=7的溶液 B.c(H+)=10-7 mol·L-1的溶液
C.c(H+)/c(OH-)=10-14的溶液 D.氨水和氯化铵的混合液中c(H+)=c(OH-)
(2)已知T ℃时,Kw=1×10-13,则T ℃___________ 25 ℃(填“>”“<”或“=”)。在T ℃时将pH=12的NaOH溶液a L与pH=1的硫酸b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=11,则a∶b=___________ 。
(3)25 ℃时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取a L该盐酸与b L该氢氧化钠溶液反应,恰好完全中和,则两溶液的pH的关系式x+y为___________ (用a、b表示)。
A.pH=7的溶液 B.c(H+)=10-7 mol·L-1的溶液
C.c(H+)/c(OH-)=10-14的溶液 D.氨水和氯化铵的混合液中c(H+)=c(OH-)
(2)已知T ℃时,Kw=1×10-13,则T ℃
(3)25 ℃时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取a L该盐酸与b L该氢氧化钠溶液反应,恰好完全中和,则两溶液的pH的关系式x+y为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】某温度下纯水的pH=7,按要求回答下列问题:
(1)pH=7的溶液呈_______ (填“酸性”“中性”或“碱性”)。
(2)该温度下某溶液中由水电离出的c(OH-)=10-9mol/L的pH=_______ 。
(3)pH=3的H2SO4溶液与pH=6的HCl溶液的等体积混合,溶液的pH=_______ 。
(4)将pH=2的盐酸和pH=11的氢氧化钠溶液,以体积比1∶9混合后,溶液的pH=_______ 。
(1)pH=7的溶液呈
(2)该温度下某溶液中由水电离出的c(OH-)=10-9mol/L的pH=
(3)pH=3的H2SO4溶液与pH=6的HCl溶液的等体积混合,溶液的pH=
(4)将pH=2的盐酸和pH=11的氢氧化钠溶液,以体积比1∶9混合后,溶液的pH=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】下表是不同温度下水的离子积数据:
回答下列问题:
(1)若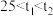 ,则a
,则a_____ (填“>”“<”或“=”)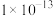 ,作此判断的理由是
,作此判断的理由是________ 。
(2)25℃时,某 溶液中
溶液中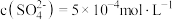 ,取该溶液1mL加水稀释至100mL,则稀释后溶液中
,取该溶液1mL加水稀释至100mL,则稀释后溶液中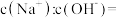
_______ 。
(3)在 ℃下pH=10的NaOH溶液中,由水电离产生的
℃下pH=10的NaOH溶液中,由水电离产生的 浓度为
浓度为_______ 。
(4) ℃下,将
℃下,将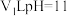 的苛性钠溶液与
的苛性钠溶液与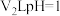 的稀硫酸混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则
的稀硫酸混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则
_______ 。
(5)常温下, 的下列溶液中,pH由大到小的顺序是
的下列溶液中,pH由大到小的顺序是________ (填序号)。
a.NaHSO4 b.CH3COONa c.CH3COONH4 d.CH3COOH
[已知:K(CH3COOH)=1.7×10-5,K(NH3·H2O)=1.7×10-5]
| 温度/℃ | 25 |  |  |
水的离子积 |  | a | 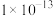 |
(1)若
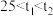 ,则a
,则a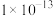 ,作此判断的理由是
,作此判断的理由是(2)25℃时,某
 溶液中
溶液中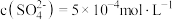 ,取该溶液1mL加水稀释至100mL,则稀释后溶液中
,取该溶液1mL加水稀释至100mL,则稀释后溶液中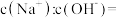
(3)在
 ℃下pH=10的NaOH溶液中,由水电离产生的
℃下pH=10的NaOH溶液中,由水电离产生的 浓度为
浓度为(4)
 ℃下,将
℃下,将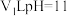 的苛性钠溶液与
的苛性钠溶液与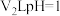 的稀硫酸混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则
的稀硫酸混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则
(5)常温下,
 的下列溶液中,pH由大到小的顺序是
的下列溶液中,pH由大到小的顺序是a.NaHSO4 b.CH3COONa c.CH3COONH4 d.CH3COOH
[已知:K(CH3COOH)=1.7×10-5,K(NH3·H2O)=1.7×10-5]
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】强弱电解质在水中的行为是不同的。
(1)醋酸在水中的电离方程式为_______ ;醋酸电离平衡常数表达式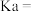
_______ 。
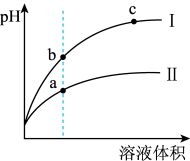
(2)室温下,用 溶液分别滴定
溶液分别滴定 的醋酸和盐酸溶液,滴定曲线如图所示。
的醋酸和盐酸溶液,滴定曲线如图所示。
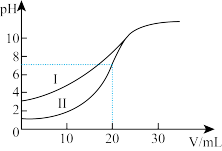
①Ⅱ表示滴定_______ 的曲线(填“盐酸”或“醋酸”)。
②当滴定到 时,消耗
时,消耗 溶液的体积大的是
溶液的体积大的是_______ (填“盐酸”或“醋酸”)。
③当 时,醋酸溶液中各离子的物质的量浓度由大到小的顺序是
时,醋酸溶液中各离子的物质的量浓度由大到小的顺序是_______ 。
④在上述滴定过程中,需要使用的玻璃仪器是_______ (填序号)。
A.碱式滴定管 B.锥形瓶 C.容量瓶 D.玻璃棒
(1)醋酸在水中的电离方程式为
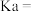
(2)室温下,用
 溶液分别滴定
溶液分别滴定 的醋酸和盐酸溶液,滴定曲线如图所示。
的醋酸和盐酸溶液,滴定曲线如图所示。
①Ⅱ表示滴定
②当滴定到
 时,消耗
时,消耗 溶液的体积大的是
溶液的体积大的是③当
 时,醋酸溶液中各离子的物质的量浓度由大到小的顺序是
时,醋酸溶液中各离子的物质的量浓度由大到小的顺序是④在上述滴定过程中,需要使用的玻璃仪器是
A.碱式滴定管 B.锥形瓶 C.容量瓶 D.玻璃棒
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】一定温度下,有a.盐酸、b.硫酸、c.醋酸三种酸:(用>或=表示) 如:a>b=c
①当其物质的量浓度相同时,c(H+)由大到小的关系是_________ 。
②同体积、同物质的量浓度的三种酸溶液,中和相同物质的量浓度的NaOH的体积由大到小的关系是___________________ ;
③当pH相同、体积相同时,分别加入足量锌,相同状况下产生的气体体积由大到小的关系是_______ ;
④当pH相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的氢气(相同状况)则反应所需时间的长短关系是____________ ;
⑤如果三种酸的浓度相同时,则由水电离出的氢离子浓度由大到小的关系为___________ 。
①当其物质的量浓度相同时,c(H+)由大到小的关系是
②同体积、同物质的量浓度的三种酸溶液,中和相同物质的量浓度的NaOH的体积由大到小的关系是
③当pH相同、体积相同时,分别加入足量锌,相同状况下产生的气体体积由大到小的关系是
④当pH相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的氢气(相同状况)则反应所需时间的长短关系是
⑤如果三种酸的浓度相同时,则由水电离出的氢离子浓度由大到小的关系为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】NaCN超标的电镀废水可用两段氧化法处理:
a.NaCN与NaClO反应,生成NaOCN和NaCl
b.NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
已知HCN(Ki=6.3×10-10)有剧毒;HCN、HOCN中N元素的化合价相同。
完成下列填空:
(1)第一次氧化时,溶液的pH应调节为___________ (选填“酸性”、“碱性”或“中性”);原因是___________ 。
(2)写出第二次氧化时发生反应的离子方程式。___________
(3)(CN)2与Cl2的化学性质相似。(CN)2与NaOH溶液反应生成___________ 、___________ 和H2O。
a.NaCN与NaClO反应,生成NaOCN和NaCl
b.NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
已知HCN(Ki=6.3×10-10)有剧毒;HCN、HOCN中N元素的化合价相同。
完成下列填空:
(1)第一次氧化时,溶液的pH应调节为
(2)写出第二次氧化时发生反应的离子方程式。
(3)(CN)2与Cl2的化学性质相似。(CN)2与NaOH溶液反应生成
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】常温下有四种溶液NaOH、 NH3·H2O、 HCl 、CH3COOH。
(1)相同pH的CH3COOH溶液和HCl溶液加水稀释,其 pH变化情况如图,其中表示HCl溶液的是曲线
pH变化情况如图,其中表示HCl溶液的是曲线________ ,a、b两点中,导电能力更强的是________ 。
(2)NH3·H2O溶液和HCl溶液混合,已知体积V(NH3·H2O)>V(HCl),当溶液中c(NH3·H2O)=c(NH )时,溶液的pH=
)时,溶液的pH=_______ 。[已知:Kb(NH3·H2O)=1.77×10-5,lg 1.77=0.25]
(1)相同pH的CH3COOH溶液和HCl溶液加水稀释,其
 pH变化情况如图,其中表示HCl溶液的是曲线
pH变化情况如图,其中表示HCl溶液的是曲线
(2)NH3·H2O溶液和HCl溶液混合,已知体积V(NH3·H2O)>V(HCl),当溶液中c(NH3·H2O)=c(NH
 )时,溶液的pH=
)时,溶液的pH=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】现有 、
、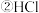 两种溶液,选择填空:
两种溶液,选择填空:
A.
(1)当它们pH相同时,其物质的量浓度______ .
(2)当它们的物质的量浓度相同时,其pH的关系是______ .
(3)中和等体积、等物质的量浓度的烧碱溶液,需同物质的量浓度的两种酸溶液的体积关系为______ .
(4)体积和物质的量浓度相同的 、
、 两溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为
两溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为______ .
(5)当它们pH相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为______ .
(6)将pH相同的两种酸均稀释10倍后,pH关系为______ .
 、
、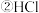 两种溶液,选择填空:
两种溶液,选择填空:A.

(1)当它们pH相同时,其物质的量浓度
(2)当它们的物质的量浓度相同时,其pH的关系是
(3)中和等体积、等物质的量浓度的烧碱溶液,需同物质的量浓度的两种酸溶液的体积关系为
(4)体积和物质的量浓度相同的
 、
、 两溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为
两溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为(5)当它们pH相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为
(6)将pH相同的两种酸均稀释10倍后,pH关系为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】常温下,现有5种溶液:
①pH=1的稀硫酸② 稀硫酸③pH=1的盐酸④pH=1的氢氟酸⑤
稀硫酸③pH=1的盐酸④pH=1的氢氟酸⑤ 氢氟酸溶液
氢氟酸溶液
常温下,氢氟酸的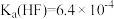 。
。
(1)若锌片形状相同,在相同条件下与上述5种溶液反应,开始产生氢气的速率最快的是______ 。(填写序号)
(2)等体积的上述5种溶液分别与足量的锌粒完全反应,在相同条件下产生氢气体积最大的是___________ 。(填写序号)
(3)等体积的①、②、③、⑤溶液与等浓度的氢氧化钠溶液恰好完全中和,消耗NaOH溶液体积最大的是___________ 。(填写序号)
(4)③中水电离出的 为
为___________  。
。
(5)25℃时,⑤中 约为
约为___________  。
。
①pH=1的稀硫酸②
 稀硫酸③pH=1的盐酸④pH=1的氢氟酸⑤
稀硫酸③pH=1的盐酸④pH=1的氢氟酸⑤ 氢氟酸溶液
氢氟酸溶液常温下,氢氟酸的
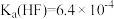 。
。(1)若锌片形状相同,在相同条件下与上述5种溶液反应,开始产生氢气的速率最快的是
(2)等体积的上述5种溶液分别与足量的锌粒完全反应,在相同条件下产生氢气体积最大的是
(3)等体积的①、②、③、⑤溶液与等浓度的氢氧化钠溶液恰好完全中和,消耗NaOH溶液体积最大的是
(4)③中水电离出的
 为
为 。
。(5)25℃时,⑤中
 约为
约为 。
。
您最近一年使用:0次



