锰酸锂(LiMn2O4)可作为锂离子电池的正极材料,在工业上可利用软锰矿浆(主要成分为MnO2,含少量Fe2O3、FeO、Al2O3、SiO2等杂质)吸收含硫烟气(主要成分SO2)制备锰酸锂,生产流程如下:
已知:①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强。
②在此流程中部分金属阳离子生成氢氧化物沉淀的pH如下表:
(1)软锰矿水磨浆化处理的作用是________ 。
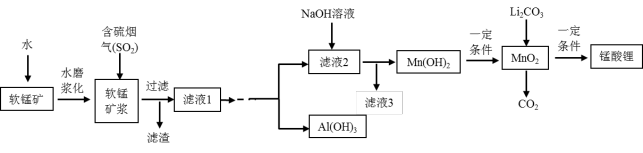
(2)SO2的吸收率与温度及烟气流速的关系如图,为提高含硫烟气中SO2的吸收率,可以采取的措施_______ (举一例)。
(3)滤液1中所含金属阳离子有Mn2+、________ (填离子符号)。
(4)在实际生产中,Li2CO3与MnO2按物质的量之比1∶4混合均匀加热制取LiMn2O4,反应过程如下:
①升温到515℃时,Li2CO3开始分解产生CO2,同时生成固体A,此时比预计Li2CO3的分解温度(723℃)低得多,可能原因是________ ;
②升温到566℃时,MnO2开始分解产生另一种气体X,X恰好与①中产生的CO2物质的量相等,同时得到固体B。请写出此过程反应的化学方程式________ ;
③升温到720℃时,第三阶段反应开始,固体质量逐渐增加,当质量不再增加时,得到高纯度的锰酸锂。请写出该阶段反应的化学方程式_______ 。
(5)请补充完整由“滤液1”得到“滤液2”同时回收Al(OH)3的实验方案[Al(OH)3在pH≥12时溶解]:边搅拌边向滤液1中______ 。(实验中须用到的试剂有:NaOH溶液、H2O2、CO2)

已知:①软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强。
②在此流程中部分金属阳离子生成氢氧化物沉淀的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
(1)软锰矿水磨浆化处理的作用是
(2)SO2的吸收率与温度及烟气流速的关系如图,为提高含硫烟气中SO2的吸收率,可以采取的措施

(3)滤液1中所含金属阳离子有Mn2+、
(4)在实际生产中,Li2CO3与MnO2按物质的量之比1∶4混合均匀加热制取LiMn2O4,反应过程如下:
①升温到515℃时,Li2CO3开始分解产生CO2,同时生成固体A,此时比预计Li2CO3的分解温度(723℃)低得多,可能原因是
②升温到566℃时,MnO2开始分解产生另一种气体X,X恰好与①中产生的CO2物质的量相等,同时得到固体B。请写出此过程反应的化学方程式
③升温到720℃时,第三阶段反应开始,固体质量逐渐增加,当质量不再增加时,得到高纯度的锰酸锂。请写出该阶段反应的化学方程式
(5)请补充完整由“滤液1”得到“滤液2”同时回收Al(OH)3的实验方案[Al(OH)3在pH≥12时溶解]:边搅拌边向滤液1中
更新时间:2020-08-21 10:17:30
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
名校
【推荐1】一种从废弃SCR催化剂(主要含78%TiO2、V2O5及SiO2、Al2O3等)中回收钛、钒的工艺流程如图所示:

(1)Ti在周期表中的位置是_____________ ,价层电子排布式是________________ 。
(2)已知V2O5的化学性质与氧化铝相似,则“碱浸”过程中发生反应的离子方程式Al2O3+ 2OH-= 2AlO +H2O、
+H2O、__________ 、___________ 。
(3)沉淀X的主要成分是H2SiO3、_________ (填化学式)。
(4)在焙烧NH4VO3时,气体产物经过与_______ (填化学式)反应后,可以在生产流程中循环利用。
(5)反型钙钛矿电池使用具有光催化活性的TiO2(通过氮掺杂生成TiO2-aNb,反应如图)以及掺杂的有机空穴传输层,光照下的输出稳定性更好,更具发展潜力。
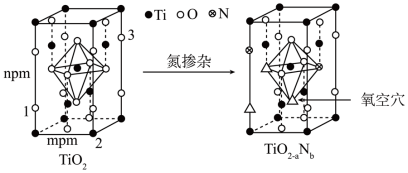
已知原子1、2的分数坐标为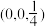 和
和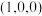 ,则原子3的坐标分别为
,则原子3的坐标分别为______ ,设阿伏加德罗常数的值为NA,TiO2的密度为_______ g·cm-3(列出计算式)。TiO2-aNb晶体中a=_______ 。

(1)Ti在周期表中的位置是
(2)已知V2O5的化学性质与氧化铝相似,则“碱浸”过程中发生反应的离子方程式Al2O3+ 2OH-= 2AlO
 +H2O、
+H2O、(3)沉淀X的主要成分是H2SiO3、
(4)在焙烧NH4VO3时,气体产物经过与
(5)反型钙钛矿电池使用具有光催化活性的TiO2(通过氮掺杂生成TiO2-aNb,反应如图)以及掺杂的有机空穴传输层,光照下的输出稳定性更好,更具发展潜力。

已知原子1、2的分数坐标为
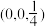 和
和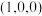 ,则原子3的坐标分别为
,则原子3的坐标分别为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】(11分)近年来,随着锂离子电池的广泛应用,废锂离子电池的回收处理至关重要。下面是利用废锂离子电池正极材料(有Al、LiCoO2、Ni、Mn、Fe等)回收钴、镍、锂的流程图。
已知:P204[二(2−乙基己基)磷酸酯]常用于萃取锰,P507(2−乙基己基膦酸−2−乙基己酯)和Cyanex272[二(2,4,4)−三甲基戊基次磷酸]常用于萃取钴、镍。
回答下列问题:
(1)在硫酸存在的条件下,正极材料粉末中LiCoO2与H2O2反应能生成使带火星木条复燃的气体,请写出反应的化学方程式__________________________________ 。
(2)一些金属难溶氢氧化物的溶解度(用阳离子的饱和浓度表示)与pH的关系图如下:
加入NaOH溶液调pH=5可除去图中的________ (填金属离子符号)杂质;写出除去金属离子的离子方程式________________________ (一种即可)。
(3)已知P507萃取金属离子的原理为nHR(Org)+Mn+(aq) MRn(Org)+nH+(aq),且随着萃取过程中pH降低,萃取效率下降。萃取前先用NaOH对萃取剂进行皂化处理,皂化萃取剂萃取金属离子的反应为nNaR(Org)+Mn+(aq)
MRn(Org)+nH+(aq),且随着萃取过程中pH降低,萃取效率下降。萃取前先用NaOH对萃取剂进行皂化处理,皂化萃取剂萃取金属离子的反应为nNaR(Org)+Mn+(aq) MRn(Org)+nNa+(aq)。对萃取剂进行皂化处理的原因为
MRn(Org)+nNa+(aq)。对萃取剂进行皂化处理的原因为________________ 。
(4)控制水相pH=5.2,温度25℃,分别用P507、Cyanex272作萃取剂,萃取剂浓度对萃取分离钴、镍的影响实验结果如图所示。
由图可知,钴、镍的萃取率随萃取剂浓度增大而_________ (填“增大”或“减小”);两种萃取剂中___________ (填“P507”或“Cyanex272”)的分离效果比较好,若选P507为萃取剂,则最适宜的萃取剂浓度大约为__________ mol·L−1;若选Cyanex272萃取剂,则最适宜的萃取剂浓度大约为___________ mol·L−1。
(5)室温下,用NaOH溶液调节钴萃余液的pH=12,搅拌一段时间后,静置,离心分离得到淡绿色氢氧化镍固体,镍沉淀率可达99.62%。已知Ksp[Ni(OH)2]=5.25×10−16,则沉镍母液中Ni2+的浓度为2.1×10−11 mol·L−1时,pH=______ (lg5=0.7)。

已知:P204[二(2−乙基己基)磷酸酯]常用于萃取锰,P507(2−乙基己基膦酸−2−乙基己酯)和Cyanex272[二(2,4,4)−三甲基戊基次磷酸]常用于萃取钴、镍。
回答下列问题:
(1)在硫酸存在的条件下,正极材料粉末中LiCoO2与H2O2反应能生成使带火星木条复燃的气体,请写出反应的化学方程式
(2)一些金属难溶氢氧化物的溶解度(用阳离子的饱和浓度表示)与pH的关系图如下:

加入NaOH溶液调pH=5可除去图中的
(3)已知P507萃取金属离子的原理为nHR(Org)+Mn+(aq)
 MRn(Org)+nH+(aq),且随着萃取过程中pH降低,萃取效率下降。萃取前先用NaOH对萃取剂进行皂化处理,皂化萃取剂萃取金属离子的反应为nNaR(Org)+Mn+(aq)
MRn(Org)+nH+(aq),且随着萃取过程中pH降低,萃取效率下降。萃取前先用NaOH对萃取剂进行皂化处理,皂化萃取剂萃取金属离子的反应为nNaR(Org)+Mn+(aq) MRn(Org)+nNa+(aq)。对萃取剂进行皂化处理的原因为
MRn(Org)+nNa+(aq)。对萃取剂进行皂化处理的原因为(4)控制水相pH=5.2,温度25℃,分别用P507、Cyanex272作萃取剂,萃取剂浓度对萃取分离钴、镍的影响实验结果如图所示。

■—Co(Cyanex272);●—Ni(Cyanex272);▲—Co(P507);▼—Ni(P507)
由图可知,钴、镍的萃取率随萃取剂浓度增大而
(5)室温下,用NaOH溶液调节钴萃余液的pH=12,搅拌一段时间后,静置,离心分离得到淡绿色氢氧化镍固体,镍沉淀率可达99.62%。已知Ksp[Ni(OH)2]=5.25×10−16,则沉镍母液中Ni2+的浓度为2.1×10−11 mol·L−1时,pH=
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】用含钴废料(含CoCO3、少量NiCO3与铁屑)制备CoCl2·6H2O的工艺流程如下:

已知:除镍过程中溶液pH对Co的回收率影响如下图所示,部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表所示。

(1)酸浸工艺中用“稀HCl”替代了传统的“盐酸与硝酸的混酸”,其优点为__________________ 。
(2)除镍时应调节pH=______________ ,此步骤中Ni2+是否形成Ni(OH)2沉淀?___________________ 。
(3)除铁过程的步骤:_______________ ,过滤得CoCl2溶液。(可供选用的试剂:30% H2O2、1.0mol·L-1KMnO4、NaOH固体、CoCO3固体)
(4)除铁后加入盐酸调pH的作用是____________________ 。
(5)工业上采用减压蒸干的方法制备CoCl2·6H2O,减压蒸干的目的是___________________ 。

已知:除镍过程中溶液pH对Co的回收率影响如下图所示,部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表所示。

| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.5 | 4.1 |
| Fe2+ | 7.5 | 9.7 |
| Co2+ | 6.6 | 9.4 |
(2)除镍时应调节pH=
(3)除铁过程的步骤:
(4)除铁后加入盐酸调pH的作用是
(5)工业上采用减压蒸干的方法制备CoCl2·6H2O,减压蒸干的目的是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐1】工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计了如下实验分别测定氮化铝(AlN)样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理:①Al4C3与硫酸反应可生成CH4。
②AlN溶于强酸产生铵盐,溶于强碱生成氨气。
写出Al4C3与硫酸反应的化学方程__________________________ 。
(2)实验装置(如图所示):

(3)实验过程:
①连接实验装置,检验装置的气密性。称得D装置的质量为yg,滴定管的读数为amL
②称取xgAlN样品置于装置B瓶中;塞好胶塞,关闭活塞K2、K3,打开活塞K1,通过分液漏斗加入稀硫酸,与装置B瓶内物质充分反应。
③待反应进行完全后,关闭活塞K1,打开活塞K3 ,通过分液漏斗加入过量NaOH ,与装置B瓶内物质充分反应。
④_______________ (填入该步应进行的操作)。
⑤记录滴定管的读数为bmL,称得D装置的质量为zg。
(4)数据分析:(已知:该实验条件下的气体摩尔体积为Vm L·mol-1)
①Al4C3的质量分数为_____________________ 。
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积___________ (填“偏大”、“偏小”或“无影响”下同)。若分液漏斗和吸滤瓶间没有用橡胶管连通,则所测气体的体积___________ 。
③AlN的质量分数为__________________ 。
(1)实验原理:①Al4C3与硫酸反应可生成CH4。
②AlN溶于强酸产生铵盐,溶于强碱生成氨气。
写出Al4C3与硫酸反应的化学方程
(2)实验装置(如图所示):

(3)实验过程:
①连接实验装置,检验装置的气密性。称得D装置的质量为yg,滴定管的读数为amL
②称取xgAlN样品置于装置B瓶中;塞好胶塞,关闭活塞K2、K3,打开活塞K1,通过分液漏斗加入稀硫酸,与装置B瓶内物质充分反应。
③待反应进行完全后,关闭活塞K1,打开活塞K3 ,通过分液漏斗加入过量NaOH ,与装置B瓶内物质充分反应。
④
⑤记录滴定管的读数为bmL,称得D装置的质量为zg。
(4)数据分析:(已知:该实验条件下的气体摩尔体积为Vm L·mol-1)
①Al4C3的质量分数为
②若读取滴定管中气体的体积时,液面左高右低,则所测气体的体积
③AlN的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】用碳在高温下还原二氧化硅制粗硅(含Fe、Al、B、P等杂质),粗硅与氯气反应生成四氯化硅反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。

已知:
①四氯化硅遇水极易水解;
②硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
③有关物质的物理常数见表:
(1)写出装置A中发生反应的化学方程式___________ 。
(2)装置A中g管的作用是___________ ,装置C中的试剂是___________ ,装置F的作用是___________ 。
(3)常用强碱溶液吸收尾气,反应的离子方程式为___________ 。
(4)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除Fe元素外可能还含有的元素是P、___________ 、___________ (元素符号)。
(5)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成 ,再用
,再用 标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是
标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是___________ 。

已知:
①四氯化硅遇水极易水解;
②硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
③有关物质的物理常数见表:
| 物质 |  |  |  |  |  |
| 沸点/℃ | 57.7 | 12.8 | — | 31.5 | — |
| 熔点/℃ | -70.0 | -107.2 | — | — | — |
| 升华温度/℃ | — | — | 180 | 300 | 162 |
(2)装置A中g管的作用是
(3)常用强碱溶液吸收尾气,反应的离子方程式为
(4)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除Fe元素外可能还含有的元素是P、
(5)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成
 ,再用
,再用 标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是
标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是
您最近一年使用:0次
【推荐3】电镀含铬废水的处理方法较多。
I.某工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强。为回收利用,通常采用如下流程处理:
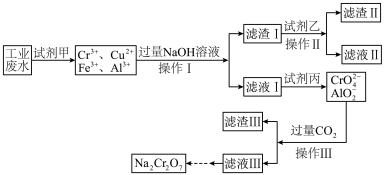
已知:
a.Cr(OH)3→NaCrO2→Na2CrO4→Na2Cr2O7
b.Cu(OH)2能溶于氨水:Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O
请回答:
(1)操作I的名称为___________ ,上述操作I、Ⅱ、Ⅲ相同,进行该实验操作所需要的主要玻璃仪器除烧杯、漏斗外,还有___________ 。
(2)滤渣I的主要成分为___________ (写化学式),试剂乙的名称为___________ 。
(3)加入试剂甲的目的是___________ 。
(4)废水处理流程中生成滤渣Ⅲ的离子方程式为___________ 。
Ⅱ.酸性条件下,六价铬主要以Cr2O 形式存在。工业上用以下方法处理含Cr2O
形式存在。工业上用以下方法处理含Cr2O 的废水:
的废水:
①往废水中加入适量的NaCl,搅拌均匀;
②用Fe为电极进行电解,经过一段时间,最后有Cr(OH)3和Fe(OH)3沉淀产生;
③过滤回收沉淀,废水达到排放标准。
(5)电解时能否用Cu电极来代替Fe电极___________ (填“能”或“不能”),理由是___________ 。
(6)已知某含Cr2O 的酸性工业废水中铬元素的含量为104.5mg·L-1,处理后铬元素最高允许排放浓度为0.5mg·L-1.处理该废水1000m3并达到排放标准至少消耗铁的质量为
的酸性工业废水中铬元素的含量为104.5mg·L-1,处理后铬元素最高允许排放浓度为0.5mg·L-1.处理该废水1000m3并达到排放标准至少消耗铁的质量为___________ kg。
I.某工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强。为回收利用,通常采用如下流程处理:

已知:
a.Cr(OH)3→NaCrO2→Na2CrO4→Na2Cr2O7
b.Cu(OH)2能溶于氨水:Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O
请回答:
(1)操作I的名称为
(2)滤渣I的主要成分为
(3)加入试剂甲的目的是
(4)废水处理流程中生成滤渣Ⅲ的离子方程式为
Ⅱ.酸性条件下,六价铬主要以Cr2O
 形式存在。工业上用以下方法处理含Cr2O
形式存在。工业上用以下方法处理含Cr2O 的废水:
的废水:①往废水中加入适量的NaCl,搅拌均匀;
②用Fe为电极进行电解,经过一段时间,最后有Cr(OH)3和Fe(OH)3沉淀产生;
③过滤回收沉淀,废水达到排放标准。
(5)电解时能否用Cu电极来代替Fe电极
(6)已知某含Cr2O
 的酸性工业废水中铬元素的含量为104.5mg·L-1,处理后铬元素最高允许排放浓度为0.5mg·L-1.处理该废水1000m3并达到排放标准至少消耗铁的质量为
的酸性工业废水中铬元素的含量为104.5mg·L-1,处理后铬元素最高允许排放浓度为0.5mg·L-1.处理该废水1000m3并达到排放标准至少消耗铁的质量为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐1】苯酚是重要的化工原料,有关苯酚的实验如下:
(Ⅰ)苯酚的制备
工业上用异丙苯氧化法合成苯酚,其生产流程如图:
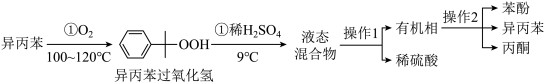
(1)异丙苯氧化过程①温度不能过高的原因是___________ 。
(2)检验有机相中是否含有水的试剂是___________ 。
(3)“操作1”的名称是___________ 。
(Ⅱ)苯酚的实验探究
探究铁盐种类和 对苯酚与
对苯酚与 显色反应的影响。
显色反应的影响。
查阅资料:ⅰ.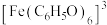 为紫色;
为紫色;
ⅱ. 对苯酚与
对苯酚与 的显色反应无影响;
的显色反应无影响;
ⅲ.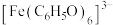 对特定波长光的吸收程度(用吸光度A表示)与
对特定波长光的吸收程度(用吸光度A表示)与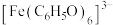 的浓度在一定范围内成正比
的浓度在一定范围内成正比
ⅳ.苯酚与 的显色原理:
的显色原理:
提出猜想:猜想1: 对苯酚与
对苯酚与 的显色反应有影响
的显色反应有影响
猜想2: 对苯酚与
对苯酚与 的显色反应有影响。
的显色反应有影响。
猜想3: 对苯酚与
对苯酚与 的显色反应有影响。
的显色反应有影响。
进行实验:常温下,用盐酸调节配制得到 分别为a和b的
分别为a和b的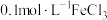 溶液(a>b),用硫酸调节配制得到
溶液(a>b),用硫酸调节配制得到 分别为a和b的
分别为a和b的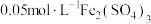 溶液。取5mL苯酚溶液于试管中,按实验1~4分别再加入0.1mL含
溶液。取5mL苯酚溶液于试管中,按实验1~4分别再加入0.1mL含 的试剂,显色10min后用紫外-可见分光光度计测定该溶液的吸光度(本实验
的试剂,显色10min后用紫外-可见分光光度计测定该溶液的吸光度(本实验 改变对
改变对 水解程度的影响可忽略)。
水解程度的影响可忽略)。
结果讨论:实验结果为 。
。
(4)①根据实验结果,小组同学认为此结果不足以证明猜想3成立的理由是___________ 。
②为进一步验证猜想,小组同学设计了实验5和6,补充下表中相关内容。(限选试剂: 溶液、
溶液、 溶液、
溶液、 固体、
固体、 固体)
固体)
③小组同学得出实验结果为: ,
,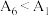 ,由此得出此结论是
,由此得出此结论是___________ 。
④根据实验1~6的结果,小组同学得出猜想3成立,且 对
对 与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是
与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是___________ 。
(Ⅰ)苯酚的制备
工业上用异丙苯氧化法合成苯酚,其生产流程如图:

(1)异丙苯氧化过程①温度不能过高的原因是
(2)检验有机相中是否含有水的试剂是
(3)“操作1”的名称是
(Ⅱ)苯酚的实验探究
探究铁盐种类和
 对苯酚与
对苯酚与 显色反应的影响。
显色反应的影响。查阅资料:ⅰ.
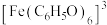 为紫色;
为紫色;ⅱ.
 对苯酚与
对苯酚与 的显色反应无影响;
的显色反应无影响;ⅲ.
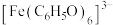 对特定波长光的吸收程度(用吸光度A表示)与
对特定波长光的吸收程度(用吸光度A表示)与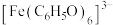 的浓度在一定范围内成正比
的浓度在一定范围内成正比ⅳ.苯酚与
 的显色原理:
的显色原理:
提出猜想:猜想1:
 对苯酚与
对苯酚与 的显色反应有影响
的显色反应有影响猜想2:
 对苯酚与
对苯酚与 的显色反应有影响。
的显色反应有影响。猜想3:
 对苯酚与
对苯酚与 的显色反应有影响。
的显色反应有影响。进行实验:常温下,用盐酸调节配制得到
 分别为a和b的
分别为a和b的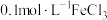 溶液(a>b),用硫酸调节配制得到
溶液(a>b),用硫酸调节配制得到 分别为a和b的
分别为a和b的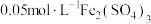 溶液。取5mL苯酚溶液于试管中,按实验1~4分别再加入0.1mL含
溶液。取5mL苯酚溶液于试管中,按实验1~4分别再加入0.1mL含 的试剂,显色10min后用紫外-可见分光光度计测定该溶液的吸光度(本实验
的试剂,显色10min后用紫外-可见分光光度计测定该溶液的吸光度(本实验 改变对
改变对 水解程度的影响可忽略)。
水解程度的影响可忽略)。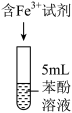 | 序号 | 含 的试剂 的试剂 | 吸光度 | |
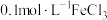 溶液 溶液 | 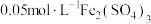 溶液 溶液 | |||
| 1 |  | / |  | |
| 2 |  | / |  | |
| 3 | / |  |  | |
| 4 | / |  |  | |
 。
。(4)①根据实验结果,小组同学认为此结果不足以证明猜想3成立的理由是
②为进一步验证猜想,小组同学设计了实验5和6,补充下表中相关内容。(限选试剂:
 溶液、
溶液、 溶液、
溶液、 固体、
固体、 固体)
固体) | 序号 | 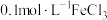 溶液 溶液 | 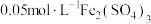 溶液 溶液 | 再加试剂 | 吸光度 |
| 5 | / |  |  固体 固体 | 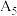 | |
| 6 |  | / | 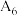 |
 ,
,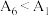 ,由此得出此结论是
,由此得出此结论是④根据实验1~6的结果,小组同学得出猜想3成立,且
 对
对 与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是
与苯酚的显色反应有抑制作用,从化学平衡角度解释其原因是
您最近一年使用:0次
【推荐2】化学小组同学用铜与过量浓硝酸反应制备 气体,实验后发现溶液呈绿色,对其原因进行如下探究。
气体,实验后发现溶液呈绿色,对其原因进行如下探究。
(1)甲同学提出猜想:浓硝酸中溶解了生成的 呈黄色,黄色与蓝色叠加显绿色。
呈黄色,黄色与蓝色叠加显绿色。
实验:向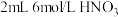 中通入稳定的
中通入稳定的 气流,溶液变黄。取该溶液与蓝色
气流,溶液变黄。取该溶液与蓝色 溶液混合,观察到溶液显绿色,验证了猜想。
溶液混合,观察到溶液显绿色,验证了猜想。
甲同学进一步探究硝酸溶液中何种粒子与 作用显黄色。
作用显黄色。
①写出铜和浓硝酸反应产生 的化学方程式
的化学方程式___________ 。
②实验1中溶液a是___________ 。
③依据上述实验推知,浓硝酸中溶液 呈黄色是溶液中
呈黄色是溶液中___________ 与 作用的结果。
作用的结果。
(2)资料:ⅰ.铜与浓硝酸反应过程中可生成 ,
, 易分解产生无色气体
易分解产生无色气体
ⅱ. 是一种弱酸。
是一种弱酸。 电离出
电离出 ,
, 与
与 发生如下反应:
发生如下反应: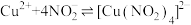 (绿色)
(绿色)
乙同学依据资料提出猜想:铜与浓硝酸反应过程中生成 ,使溶液呈绿色。
,使溶液呈绿色。
实验4: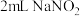 溶液与
溶液与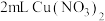 溶液混合,溶液呈绿色,加入
溶液混合,溶液呈绿色,加入 浓硝酸后,溶液变蓝。
浓硝酸后,溶液变蓝。
丙同学对加入浓硝酸后溶液变蓝的原因提出猜想并进行实验验证。
猜想1:加入浓硝酸后发生反应: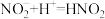 ,
, 浓度下降,绿色消失。
浓度下降,绿色消失。
猜想2:酸性条件下 分解,
分解, 浓度下降,绿色消失。
浓度下降,绿色消失。
①补全 分解的化学方程式:□
分解的化学方程式:□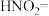 □
□ □___________+□___________
□___________+□______________________
②用离子方程式表示加入 溶液的作用
溶液的作用___________ 。
③丙同学依据实验推知猜想___________ (填“1”或“2”)成立。
(3)综合上述实验得出:过量浓硝酸与铜反应后溶液呈绿色的主要原因是___________ 。
 气体,实验后发现溶液呈绿色,对其原因进行如下探究。
气体,实验后发现溶液呈绿色,对其原因进行如下探究。(1)甲同学提出猜想:浓硝酸中溶解了生成的
 呈黄色,黄色与蓝色叠加显绿色。
呈黄色,黄色与蓝色叠加显绿色。实验:向
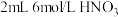 中通入稳定的
中通入稳定的 气流,溶液变黄。取该溶液与蓝色
气流,溶液变黄。取该溶液与蓝色 溶液混合,观察到溶液显绿色,验证了猜想。
溶液混合,观察到溶液显绿色,验证了猜想。甲同学进一步探究硝酸溶液中何种粒子与
 作用显黄色。
作用显黄色。| 实验装置 | 操作 | 编号 | 溶液a | 现象 |
| 向溶液a中通入稳定的 气流8s 气流8s | 实验1 | ___________ | 溶液基本无色 |
| 实验2 | 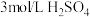 | 立即变黄 | ||
| 实验3 | 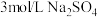 | 溶液基本无色 |
 的化学方程式
的化学方程式②实验1中溶液a是
③依据上述实验推知,浓硝酸中溶液
 呈黄色是溶液中
呈黄色是溶液中 作用的结果。
作用的结果。(2)资料:ⅰ.铜与浓硝酸反应过程中可生成
 ,
, 易分解产生无色气体
易分解产生无色气体ⅱ.
 是一种弱酸。
是一种弱酸。 电离出
电离出 ,
, 与
与 发生如下反应:
发生如下反应: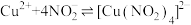 (绿色)
(绿色)乙同学依据资料提出猜想:铜与浓硝酸反应过程中生成
 ,使溶液呈绿色。
,使溶液呈绿色。实验4:
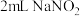 溶液与
溶液与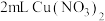 溶液混合,溶液呈绿色,加入
溶液混合,溶液呈绿色,加入 浓硝酸后,溶液变蓝。
浓硝酸后,溶液变蓝。丙同学对加入浓硝酸后溶液变蓝的原因提出猜想并进行实验验证。
猜想1:加入浓硝酸后发生反应:
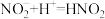 ,
, 浓度下降,绿色消失。
浓度下降,绿色消失。猜想2:酸性条件下
 分解,
分解, 浓度下降,绿色消失。
浓度下降,绿色消失。| 将实验4中蓝色溶液分成两份 | 加入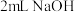 溶液,振荡 溶液,振荡 | 溶液变绿色 |
加入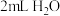 ,振荡 ,振荡 | 溶液仍为蓝色 |
 分解的化学方程式:□
分解的化学方程式:□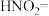 □
□ □___________+□___________
□___________+□___________②用离子方程式表示加入
 溶液的作用
溶液的作用③丙同学依据实验推知猜想
(3)综合上述实验得出:过量浓硝酸与铜反应后溶液呈绿色的主要原因是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】某小组同学探究Cu(OH)2和醛的反应产物。
已知:Cu2O + 2H+ =Cu2+ + Cu + H2O;[CuCl2]−(无色)易被氧化为[CuCl4]2−(黄色)。
(1)将25%的NaOH溶液、8%的CuSO4溶液和37%~40%的甲醛溶液按一定比例依次混合后加热(始终保持NaOH过量)。实验记录如下:
①实验I中的紫红色固体过滤、洗涤后,加入稀硫酸,振荡,溶液无明显变化,证明Cu(OH)2被还原为___________ ;甲醛的氧化产物可能是HCOONa或Na2CO3,通过实验排除了Na2CO3的可能,简述实验操作和现象___________ 。
②X射线衍射等技术确认实验II中砖红色固体主要是Cu2O,写出实验II中生成Cu2O的化学方程式___________ 。
③实验I和II中产生的气体是H2.查阅资料发现:在碱性条件下,Cu2O可以被甲醛还原为Cu并伴有H2产生,写出反应的离子方程式___________ 。
(2)在试管里加入 10 %的NaOH溶液2 mL,然后加入2% 的CuSO4溶液 0.4 mL,振荡后,加入0.5 mL乙醛溶液,加热后得到橙红色浊液,过滤、洗涤之后检验生成的橙红色固体。实验记录如下:
①实验III的目的___________ 。
②用离子方程式解释实验IV溶液中发生的变化:___________ 。
③结合以上实验,小组同学认为橙红色固体只有Cu2O,你认为是否合理并说明原因___________ 。
已知:Cu2O + 2H+ =Cu2+ + Cu + H2O;[CuCl2]−(无色)易被氧化为[CuCl4]2−(黄色)。
(1)将25%的NaOH溶液、8%的CuSO4溶液和37%~40%的甲醛溶液按一定比例依次混合后加热(始终保持NaOH过量)。实验记录如下:
| 实验 | 试剂用量 | 实验现象 |
| I | n(HCHO):n(CuSO4) > 20 | 生成紫红色固体,有大量气体产生 |
| II | n(HCHO):n(CuSO4) = 1 | 生成砖红色固体,有少量气体产生 |
②X射线衍射等技术确认实验II中砖红色固体主要是Cu2O,写出实验II中生成Cu2O的化学方程式
③实验I和II中产生的气体是H2.查阅资料发现:在碱性条件下,Cu2O可以被甲醛还原为Cu并伴有H2产生,写出反应的离子方程式
(2)在试管里加入 10 %的NaOH溶液2 mL,然后加入2% 的CuSO4溶液 0.4 mL,振荡后,加入0.5 mL乙醛溶液,加热后得到橙红色浊液,过滤、洗涤之后检验生成的橙红色固体。实验记录如下:
| 实验 | 实验操作 | 实验现象 |
| III | 铜粉中加入7 mol/L盐酸,振荡 | 铜粉未溶解,溶液呈无色 |
| IV | 氧化亚铜中加入7 mol/L盐酸,振荡; 再加入过量铜粉 | 固体全部溶解,溶液变为黄色; 黄色溶液变为无色 |
| V | 橙红色固体中加入7 mol/L盐酸,振荡 | 固体全部溶解,溶液变为黄色 |
②用离子方程式解释实验IV溶液中发生的变化:
③结合以上实验,小组同学认为橙红色固体只有Cu2O,你认为是否合理并说明原因
您最近一年使用:0次