硫氰酸盐在化学工业中应用广泛。
(1)组成硫氰酸根(SCN-)的三种元素的部分性质见下表:
碳元素的I1、I2均比氮小。但I3却比氮高,其原因是___________ 。
(2)晶体场理论认为,基态离子的d轨道存在未成对电子时,d电子发生d-d跃迁是金属阳离子在水溶液中显色的主要原因。下列硫氰酸盐的水溶液有颜色的是____ (填标号)。
A.KSCN B.Fe(SCN)3 C.Ni(SCN)2 D.Zn(SCN)2
(3)NH4SCN广泛应用于医药、印染等行业,隔绝空气加热后可分解生成NH3、CS2、H2S、N2及(CN)2。
①SCN-与上述_______ (填化学式)互为等电子体,中心原子C杂化方式为________ 。
②CN)2熔沸点高于N2的原因是_____________ 。
(4)硫氰酸钴可用于毒品检验。其水合物晶体的晶胞结构如下图所示(所有原子都不在晶胞的顶点或棱上)。____ (填标号)。
A.金属键 B.非极性键 C.氢键 D.极性键 E.配位键
②硫氰酸钴晶体属于正交晶系,晶胞参数分别为a nm、b nm、c nm,α=β=γ=90°。晶体的摩尔质量为M g·mol-1。则晶体密度=____ g·cm-3(列计算式)。
(1)组成硫氰酸根(SCN-)的三种元素的部分性质见下表:
| 元素 | C | N | W |
 (电负性) (电负性) | 2.55 | 3.04 | 2.58 |
I3(第三电离能)/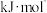 | 4620.5 | 4578.1 | 3357.0 |
(2)晶体场理论认为,基态离子的d轨道存在未成对电子时,d电子发生d-d跃迁是金属阳离子在水溶液中显色的主要原因。下列硫氰酸盐的水溶液有颜色的是
A.KSCN B.Fe(SCN)3 C.Ni(SCN)2 D.Zn(SCN)2
(3)NH4SCN广泛应用于医药、印染等行业,隔绝空气加热后可分解生成NH3、CS2、H2S、N2及(CN)2。
①SCN-与上述
②CN)2熔沸点高于N2的原因是
(4)硫氰酸钴可用于毒品检验。其水合物晶体的晶胞结构如下图所示(所有原子都不在晶胞的顶点或棱上)。

A.金属键 B.非极性键 C.氢键 D.极性键 E.配位键
②硫氰酸钴晶体属于正交晶系,晶胞参数分别为a nm、b nm、c nm,α=β=γ=90°。晶体的摩尔质量为M g·mol-1。则晶体密度=
更新时间:2020-10-07 10:02:22
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
【推荐1】过渡金属元素在工业生产、科学研究及人们的生活中应用广泛。回答下列问题:
(1)钪(Sc)在过渡元素中原子序数最小,其基态原子的核外电子排布式为_______ 。
(2)镍、铜的部分电离能如下表:
由表可知,Ni、Cu同级电离能的基本变化规律是_______ ,I6(Ni)> I6(Cu)的原因是_______ 。
(3)环烷酸铜是一种工业催化剂,其结构简式如下:

其中碳原子的杂化方式为_______ ,Cu2+的单电子数与成对电子数之比为_______ 。
(4)丁二酮肟(结构简式如图1)可用于检验Ni2+,检验Ni2+时生成的鲜红色沉淀的结构简式如图2。
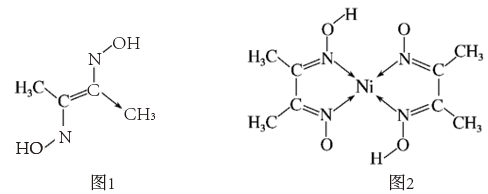
丁二酮肟中的C、N、O元素的电负性由大到小的顺序是_______ ,丁二酮肟晶体中的分子间作用力包括_______ 。图2物质中Ni2+的配位数为_______ 。
(5)Zn、P、Ge(锗)形成的化合物ZnGeP2是非线性光学晶体材料,ZnGeP2的晶胞结构如下:

以Ge为顶点的晶胞中,Zn原子在晶胞中的位置是_______ 。ZnGeP2晶体的密度是_______  (设NA为阿伏加德罗常数的值,用含a、NA的代数式表示)。
(设NA为阿伏加德罗常数的值,用含a、NA的代数式表示)。
(1)钪(Sc)在过渡元素中原子序数最小,其基态原子的核外电子排布式为
(2)镍、铜的部分电离能如下表:
| 元素 | 电离能I/( ) ) | |||
| I4 | I5 | I6 | I7 | |
| Ni | 5300 | 7339 | 10400 | 12800 |
| Cu | 5536 | 7700 | 9900 | 13400 |
由表可知,Ni、Cu同级电离能的基本变化规律是
(3)环烷酸铜是一种工业催化剂,其结构简式如下:

其中碳原子的杂化方式为
(4)丁二酮肟(结构简式如图1)可用于检验Ni2+,检验Ni2+时生成的鲜红色沉淀的结构简式如图2。

丁二酮肟中的C、N、O元素的电负性由大到小的顺序是
(5)Zn、P、Ge(锗)形成的化合物ZnGeP2是非线性光学晶体材料,ZnGeP2的晶胞结构如下:

以Ge为顶点的晶胞中,Zn原子在晶胞中的位置是
 (设NA为阿伏加德罗常数的值,用含a、NA的代数式表示)。
(设NA为阿伏加德罗常数的值,用含a、NA的代数式表示)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为______________ 。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______ Ⅰ1(Cu)(填“大于”或“小于”)。原因是_____________ 。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是________ ;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是______________ 。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为____ ,C原子的杂化形式为______ 。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______ 。

(1)Zn原子核外电子排布式为
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】铝在合金制造和铝离子电池等方面用途非常广泛,铝离子电池常用室温下的离子液体AlCl3/[EMIM]Cl作电解质。回答下列问题:
(1)基态Al原子核外价电子排布图为________ 。Mg、Al及Si的第一电离能从大到小的顺序为______ 。
(2)铝离子电池工作时,离子液体电解质中阴离子有AlCl 、Al2Cl
、Al2Cl ,阳离子为EMIM+(
,阳离子为EMIM+( )。
)。
①AlCl 的空间构型为
的空间构型为________ ;Al2Cl 中各原子最外层均达到8电子结构,则其结构式为
中各原子最外层均达到8电子结构,则其结构式为________ 。
②EMIM+中环上所有原子共面,则其中两个氮原子的杂化方式分别是________ 、________ ;分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则
),则 中的大π键应表示为
中的大π键应表示为_________ 。
③[EMIM]+[F(HF)3]-也是一种常见的离子液体,画出[F(HF)3]-的结构式:_________ 。
(3)一种金属间化合物的晶胞结构如下图所示:

以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为(0,0,0),B点原子的分数坐标为( ,
, ,
, ),则C点原子在z轴方向上的分数坐标z=
),则C点原子在z轴方向上的分数坐标z=________ (用含c、s的代数式表示);设Mg、Cu和Al原子半径分别为rMgpm、rCupm、rAlpm,则金属原子的空间占有率为_________ %(列出计算表达式)。
(1)基态Al原子核外价电子排布图为
(2)铝离子电池工作时,离子液体电解质中阴离子有AlCl
 、Al2Cl
、Al2Cl ,阳离子为EMIM+(
,阳离子为EMIM+( )。
)。①AlCl
 的空间构型为
的空间构型为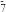 中各原子最外层均达到8电子结构,则其结构式为
中各原子最外层均达到8电子结构,则其结构式为②EMIM+中环上所有原子共面,则其中两个氮原子的杂化方式分别是
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),则
),则 中的大π键应表示为
中的大π键应表示为③[EMIM]+[F(HF)3]-也是一种常见的离子液体,画出[F(HF)3]-的结构式:
(3)一种金属间化合物的晶胞结构如下图所示:

以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为(0,0,0),B点原子的分数坐标为(
 ,
, ,
, ),则C点原子在z轴方向上的分数坐标z=
),则C点原子在z轴方向上的分数坐标z=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】在我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1molXY2含有54mol电子。
(1)该融雪剂的化学式______________ ;X与氢元素形成的化合物的电子式_____________ 。
(2)元素D、E原子的最外层电子数均为电子层数的2倍,D与Y相邻,则D离子的原子结构示意图是____________ ;D与E能形成一种非极性分子,该分子的结构式____________ ;写出与其互为等电子体的一种分子和阴离子________________ 、___________________ 。
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价键;W与Z能形成一种新型无机非金属材料,其化学式是____________ 。
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,写出该反应的化学方程式___________ 。
(1)该融雪剂的化学式
(2)元素D、E原子的最外层电子数均为电子层数的2倍,D与Y相邻,则D离子的原子结构示意图是
(3)元素W与Y同周期,其单质是原子晶体;元素Z的单质分子Z2中有3个共价键;W与Z能形成一种新型无机非金属材料,其化学式是
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,写出该反应的化学方程式
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】海底金属软泥是在海底覆盖着的一层红棕色沉积物,蕴藏着大量的金属资源,含有钨、铁、铬、锌、钴等。
(1)基态钴原子的价电子的轨道排布式为_______ ,基态Cr原子的未成对电子数为_______ 。
(2)K3CrO8的结构如图所示。

①下列有关K3CrO8的说法正确的是_______ (填标号)。
a.含离子键、σ键 b.含离子键、σ键和π键
c.氧原子与中心原子间形成配位键 d.铬显+10价
②已知电子亲和能(E)是基态的气态原子得到电子变为气态阴离子所放出的能量,O(g)+e-=O-(g) ∆H1=-140kJ/mol,O-(g)+e-=O2-(g) ∆H2=+884.3kJ/mol。氧的第一电子亲和能E1为_______ kJ/mol;△H2>0,其原因是_______ 。
(3)六羰基钨[W(CO)6]的熔点为 172℃,是一种重要的无机金属配合物,可溶于多数有机溶剂。三种组成元素的电负性由大到小的顺序为_______ (用元素符号表示)。 1 molW(CO)6 分子中含_______ mol σ 键,与 CO 互为等电子体的一种离子的化学式为_______ 。
(4)碳、铁之间可形成多种化合物,其中一种化合物的晶体结构(面心立方结构)如图所示:

则编号为①的原子的坐标为_______ ;设该晶体的晶胞参数为a pm,阿伏加德罗常数的值为NA,则该晶体的密度为_______ g•cm-3(列出计算式即可)。
(1)基态钴原子的价电子的轨道排布式为
(2)K3CrO8的结构如图所示。

①下列有关K3CrO8的说法正确的是
a.含离子键、σ键 b.含离子键、σ键和π键
c.氧原子与中心原子间形成配位键 d.铬显+10价
②已知电子亲和能(E)是基态的气态原子得到电子变为气态阴离子所放出的能量,O(g)+e-=O-(g) ∆H1=-140kJ/mol,O-(g)+e-=O2-(g) ∆H2=+884.3kJ/mol。氧的第一电子亲和能E1为
(3)六羰基钨[W(CO)6]的熔点为 172℃,是一种重要的无机金属配合物,可溶于多数有机溶剂。三种组成元素的电负性由大到小的顺序为
(4)碳、铁之间可形成多种化合物,其中一种化合物的晶体结构(面心立方结构)如图所示:

则编号为①的原子的坐标为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
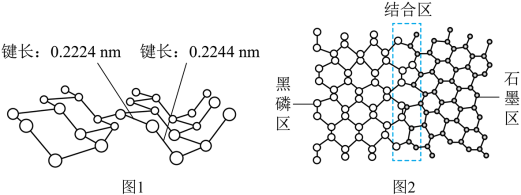
【推荐3】Ⅰ.磷及其化合物在电池、催化等领域有重要应用。黑磷与石墨类似,也具有层状结构(如图1)。为大幅度提高锂电池的充电速率,科学家最近研发了黑磷——石墨复合负极材料,其单层结构俯视图如图2所示。
回答下列问题:
(1)Li、C、P三种元素中,电负性最小的是___________ (用元素符号作答)。
(2)基态磷原子价电子排布式为___________ 。
(3)图2黑磷区中P原子的杂化方式为___________ , 石墨区中C原子的杂化方式为___________ 。
(4)氢化物PH3、CH4、NH3的沸点由高到低顺序为___________ 。
(5)根据图1和图2的信息,下列说法正确的有___________ (填字母)。
A.黑磷区中P-P键的键能不完全相同
B.复合材料单层中,P原子与C原子之间的作用力属范德华力
C.由石墨与黑磷制备该复合材料的过程,发生了化学反应
D.石墨与黑磷的交界结合区域中,P原子与C原子共平面
Ⅱ.(1)镍元素位于周期表第___________ 列,基态镍原子d轨道中成对电子与单电子的数量比为___________ 。
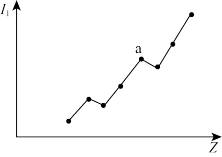
(2)第二周期元素的第一电离能(I1)随原子序数(Z)的变化情况如图。I1随Z的递增而呈增大趋势的原因是___________ ,原子核对外层电子的引力增大。导致I1在a点出现齿峰的原因是___________ 。
(3)下列分子或离子与CO2具有相同类型化学键和立体构型的是___________ (填标号)。
A. B.
B. C.O3 D.
C.O3 D.
(4)过渡金属与CO形成羰基配合物时,每个CO分子向中心原子提供2个电子,最终使中心原子的电子总数与同周期的稀有气体原子相同,称为有效原子序数规则。根据此规则推断,镍与CO形成的羰基配合物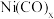 中,x=
中,x= ___________ 。

回答下列问题:
(1)Li、C、P三种元素中,电负性最小的是
(2)基态磷原子价电子排布式为
(3)图2黑磷区中P原子的杂化方式为
(4)氢化物PH3、CH4、NH3的沸点由高到低顺序为
(5)根据图1和图2的信息,下列说法正确的有
A.黑磷区中P-P键的键能不完全相同
B.复合材料单层中,P原子与C原子之间的作用力属范德华力
C.由石墨与黑磷制备该复合材料的过程,发生了化学反应
D.石墨与黑磷的交界结合区域中,P原子与C原子共平面
Ⅱ.(1)镍元素位于周期表第
(2)第二周期元素的第一电离能(I1)随原子序数(Z)的变化情况如图。I1随Z的递增而呈增大趋势的原因是

(3)下列分子或离子与CO2具有相同类型化学键和立体构型的是
A.
 B.
B. C.O3 D.
C.O3 D.
(4)过渡金属与CO形成羰基配合物时,每个CO分子向中心原子提供2个电子,最终使中心原子的电子总数与同周期的稀有气体原子相同,称为有效原子序数规则。根据此规则推断,镍与CO形成的羰基配合物
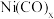 中,x=
中,x=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】前四周期元素及其化合物在生产、生活中应用广泛。回答下列问题:
(1)下列状态的N原子或离子在跃迁时;用光谱仪可捕捉到发射光谱的是______ 。
a. b.
b. c.
c. d.
d.
(2)基态铜原子的价电子排布式为________ 。
(3) 的几何构型为
的几何构型为_______ 。
(4)已知下图均与第三周期的主族元素有关。
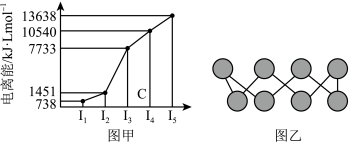
①图甲表示第一至第五电离能数据,则该元素的原子有___ 种不同运动状态的电子。
②图乙中为某单质的一种同素异形体,分子中的各原子最外层均达到8电子稳定结构,则该元素的原子的杂化轨道类型为_____ ,其易溶于 的原因是
的原因是_______ 。
(5)氨气极易溶于水,溶于水的氨分子大部分与水分子形成氢键,生成一水合氨,关于一水合氨的结构有如下两种可能,正确的是b,理由是_________ 。

(1)下列状态的N原子或离子在跃迁时;用光谱仪可捕捉到发射光谱的是
a.
 b.
b.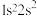 c.
c. d.
d.
(2)基态铜原子的价电子排布式为
(3)
 的几何构型为
的几何构型为(4)已知下图均与第三周期的主族元素有关。

①图甲表示第一至第五电离能数据,则该元素的原子有
②图乙中为某单质的一种同素异形体,分子中的各原子最外层均达到8电子稳定结构,则该元素的原子的杂化轨道类型为
 的原因是
的原因是(5)氨气极易溶于水,溶于水的氨分子大部分与水分子形成氢键,生成一水合氨,关于一水合氨的结构有如下两种可能,正确的是b,理由是

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】镍是一种用途广泛的金属,常用于电镀工业和制造电池。镍易形成Ni(CO)4、[Ni(NH3)6]SO4等配合物。
(1)镍基态原子的核外电子排布式为________ 。
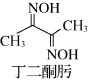
(2)Ni2+可用丁二酮肟检验。丁二酮肟的结构如图所示,其分子中碳原子轨道的杂化类型为________ 。
(3)与CO互为等电子体的阴离子的化学式为__________________ 。
(4)1 mol [Ni(NH3)6]SO4中σ键的数目为________ 。氨的沸点高于膦(PH3),原因是____________________________ 。
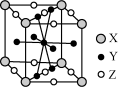
(5)镧镍合金是较好的储氢材料。储氢后所得晶体的化学式为LaNi5H6,晶胞结构如图所示,X、Y、Z表示储氢后的三种微粒,则图中Z表示的微粒为________ (填化学式)。
(1)镍基态原子的核外电子排布式为
(2)Ni2+可用丁二酮肟检验。丁二酮肟的结构如图所示,其分子中碳原子轨道的杂化类型为

(3)与CO互为等电子体的阴离子的化学式为
(4)1 mol [Ni(NH3)6]SO4中σ键的数目为
(5)镧镍合金是较好的储氢材料。储氢后所得晶体的化学式为LaNi5H6,晶胞结构如图所示,X、Y、Z表示储氢后的三种微粒,则图中Z表示的微粒为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】铁、钴均为第四周期第Ⅷ族元素,它们的单质及化合物具有广泛用途。回答下列问题:
(1)基态Co2+中单电子的数目为____ 。
(2)Fe和Co的第三电离能I3(Fe)____ I3(Co)(填“>”、“<”或“=”),原因为___ 。
(3)化学上可用RO取代二硫代磷酸(R代表烃基)萃取铁和钴的离子。萃取原理如图:

①萃取剂中电负性最大的元素是___ ,物质(A)中S原子轨道杂化类型为___ 。
②物质(A)中存在的化学键有____ (填序号)。
a.离子键 b.共价键 c.σ键 d.π键 e.配位键
③物质(B)中X原子的化合价为___ 。
(4)CoCl3·4NH3的中心原子的配位数为6。将1molCoCl3·4NH3溶于水,加入足量AgNO3溶液后生成1molAgCl沉淀。则
①CoCl3·4NH3中配离子的化学式为____ 。
②试判断NH3分子与钴离子形成配合物后H—N—H键角___ (填“变大”、“变小”或“不变”)。
(5)钴铁氧体为反尖晶石结构,其晶胞结构如图所示,已知半数的Fe与O形成[FeO4]四面体,半数的Fe与O形成[FeO6]八面体,Co与O形成[CoO6]八面体。则该化合物的化学式为____ 。已知该晶胞中相邻的两个O2-间的距离为apm,阿伏加德罗常数的值为NA,则该晶体的密度为___ g·cm-3(列出计算式)。

(1)基态Co2+中单电子的数目为
(2)Fe和Co的第三电离能I3(Fe)
(3)化学上可用RO取代二硫代磷酸(R代表烃基)萃取铁和钴的离子。萃取原理如图:

①萃取剂中电负性最大的元素是
②物质(A)中存在的化学键有
a.离子键 b.共价键 c.σ键 d.π键 e.配位键
③物质(B)中X原子的化合价为
(4)CoCl3·4NH3的中心原子的配位数为6。将1molCoCl3·4NH3溶于水,加入足量AgNO3溶液后生成1molAgCl沉淀。则
①CoCl3·4NH3中配离子的化学式为
②试判断NH3分子与钴离子形成配合物后H—N—H键角
(5)钴铁氧体为反尖晶石结构,其晶胞结构如图所示,已知半数的Fe与O形成[FeO4]四面体,半数的Fe与O形成[FeO6]八面体,Co与O形成[CoO6]八面体。则该化合物的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】铜及其化合物在生产生活中有着广泛的应用。回答下列问题:
(1)在元素周期表的分区中,铜属于_______ 区,与铜处于同一周期且最外层电子数相同的元素的基态原子共有_______ 种。
(2)下列现代分析手段中,可用于检验水中痕量铜元素的是_______(填标号)。
(3)在CO分子中,C与O之间形成_______ 个σ键、_______ 个π键,在这些化学键中,O原子共提供了_______ 个电子,过渡金属与O形成羰基配合物时,每个CO分子向中心原子提供2个电子,最终使中心原子的电子总数与同周期的稀有气体原子相同,称为有效原子序数规则。根据此规则推断,镍与CO形成的羰基配合物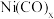 中,
中,
_______ 。
(4)CuCl2可与某有机多齿配体形成具有较强荧光性能的配合物,其结构简式如图所示。该配合物分子中N原子的杂化类型为_______ ,1mol该有机配体与Cu(Ⅱ)形成的配位键为_______ mol。

(5)铜催化烯烃硝化反应时会产生NO 。键角:NO
。键角:NO
_______ NO (填“<”或“=”或“>”),其原因是
(填“<”或“=”或“>”),其原因是_______ 。
(6)近期我国科学家合成了一种电化学性能优异的铜硒化合物,其晶胞结构如图所示。该铜硒化合物的化学式为_______ ,其中Cu元素以Cu+和Cu2+存在,则_______ (填“①”或“②”)为Cu2+。

(1)在元素周期表的分区中,铜属于
(2)下列现代分析手段中,可用于检验水中痕量铜元素的是_______(填标号)。
| A.X射线衍射 | B.原子光谱 | C.质谱 | D.红外光谱 |
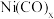 中,
中,
(4)CuCl2可与某有机多齿配体形成具有较强荧光性能的配合物,其结构简式如图所示。该配合物分子中N原子的杂化类型为

(5)铜催化烯烃硝化反应时会产生NO
 。键角:NO
。键角:NO
 (填“<”或“=”或“>”),其原因是
(填“<”或“=”或“>”),其原因是(6)近期我国科学家合成了一种电化学性能优异的铜硒化合物,其晶胞结构如图所示。该铜硒化合物的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】铜及其化合物在科学研究和工农业生产中有许多用途。回答下列问题:
(1) 溶液可以吸收合成氨中对催化剂有毒害的CO气体[醋酸根(
溶液可以吸收合成氨中对催化剂有毒害的CO气体[醋酸根( )简写成
)简写成 ],反应的化学方程式为:
],反应的化学方程式为: 。
。
①基态 的核外电子排布式为
的核外电子排布式为___________ 。
② 中C原子的杂化轨道类型为
中C原子的杂化轨道类型为___________ 。
③ 中所含非金属元素的电负性由大到小的顺序是
中所含非金属元素的电负性由大到小的顺序是___________ (用元素符号表示)。
④ 中N原子形成的H—N—H键角
中N原子形成的H—N—H键角___________ (填“大于”“小于”或“等于”)气态 中的键角,原因是
中的键角,原因是___________ 。
⑤1个 中含有的共价键数为
中含有的共价键数为___________ 。
(2)Cu—Mn—Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示:

①合金的化学式为___________ 。
②若A原子的坐标参数为(0,1,0),则B原子的坐标参数为___________ 。
③已知该合金晶体的边长为a cm,则最近的两个Al原子间的距离为___________ nm
(1)
 溶液可以吸收合成氨中对催化剂有毒害的CO气体[醋酸根(
溶液可以吸收合成氨中对催化剂有毒害的CO气体[醋酸根( )简写成
)简写成 ],反应的化学方程式为:
],反应的化学方程式为: 。
。①基态
 的核外电子排布式为
的核外电子排布式为②
 中C原子的杂化轨道类型为
中C原子的杂化轨道类型为③
 中所含非金属元素的电负性由大到小的顺序是
中所含非金属元素的电负性由大到小的顺序是④
 中N原子形成的H—N—H键角
中N原子形成的H—N—H键角 中的键角,原因是
中的键角,原因是⑤1个
 中含有的共价键数为
中含有的共价键数为(2)Cu—Mn—Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示:

①合金的化学式为
②若A原子的坐标参数为(0,1,0),则B原子的坐标参数为
③已知该合金晶体的边长为a cm,则最近的两个Al原子间的距离为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)N、P、As的第一电离能由大到小的顺序为___ ;基态As原子的核外电子排布式为___ 。
(2)NH3的沸点比PH3的___ (填“高”或低”),原因是___ 。
(3)Na3AsO4中含有的化学键类型包括___ ,AsO43-的空间构型为___ 。
(4)白磷(P4)晶体属于分子晶体,其晶胞结构如图所示(小圆圈表示白磷分子)。已知晶胞的边长为acm,阿伏加 德罗常数为NAmol-1,则该晶胞中含有的P原子的个数为___ ,该晶胞的密度为___ g·cm-3(用含NA、a的式子表示)。

(1)N、P、As的第一电离能由大到小的顺序为
(2)NH3的沸点比PH3的
(3)Na3AsO4中含有的化学键类型包括
(4)白磷(P4)晶体属于分子晶体,其晶胞结构如图所示(小圆圈表示白磷分子)。已知晶胞的边长为acm,阿伏加 德罗常数为NAmol-1,则该晶胞中含有的P原子的个数为

您最近一年使用:0次



