某小组利用H2C2O4溶液与用硫酸酸化的KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时。该小组设计了如下的方案。
(1)a= _______ ,该实验是通过____________________ 来判断反应的快慢。
(2)已知H2C2O4被KMnO4(H+)氧化为CO2逸出,该反应的化学方程式为________ ,为了观察到实验现象从而判断反应的快慢,H2C2O4与KMnO4初始的物质的量需要满足的关系为:___ 。
(3)探究温度对化学反应速率影响的实验编号是_______ 和_______ (填编号,下同),可探究H2C2O4浓度对化学反应速率影响的实验编号是_______ 和_______ 。
(4)实验①测得反应所用的时间为20s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=_______ 。
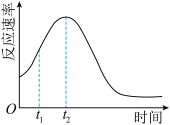
(5)该小组发现室温下反应速率走势如图,其中t1~t2时间内速率变快的主要原因可能是:_______ ,若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是_______ (填序号)
A.硫酸钾 B.硫酸锰 C.稀硫酸 D.氯化锰
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 蒸馏水 体积/ml | 温度/℃ | ||
| 浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | |||
| ① | 0.50 | 6.0 | 0.010 | 4.0 | 0 | 25 |
| ② | 0.50 | 3.0 | 0.010 | 4.0 | a | 25 |
| ③ | 0.50 | 6.0 | 0.010 | 4.0 | 0 | 50 |
(2)已知H2C2O4被KMnO4(H+)氧化为CO2逸出,该反应的化学方程式为
(3)探究温度对化学反应速率影响的实验编号是
(4)实验①测得反应所用的时间为20s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=
(5)该小组发现室温下反应速率走势如图,其中t1~t2时间内速率变快的主要原因可能是:

A.硫酸钾 B.硫酸锰 C.稀硫酸 D.氯化锰
更新时间:2020-10-12 21:59:40
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”,某小组设计了如下方案:先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。
(1)已知H2C2O4与KMnO4反应产生MnSO4和CO2。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4)∶n(KMnO4)≥________ 。
(2)探究温度对反应速率影响的实验编号是___________ (填编号,下同),探究反应物浓度对反应速率影响的实验编号是____________ 。
(3)不同温度下c(MnO4-)随反应时间t的变化曲线如图所示,判断T1_________ T2(填“>”或“<”)

| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)已知H2C2O4与KMnO4反应产生MnSO4和CO2。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4)∶n(KMnO4)≥
(2)探究温度对反应速率影响的实验编号是
(3)不同温度下c(MnO4-)随反应时间t的变化曲线如图所示,判断T1

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某课题小组探究乙酸乙酯(CH3COOC2H5)在不同温度、不同浓度NaOH溶液中的水解速率,取四支大小相同的试管,在试管外壁贴上体积刻度纸,按下表进行对照实验。在两种不同温度的水浴中加热相同时间后,记录酯层的体积来确定水解反应的速率。
已知:①水解反应CH3COOC2H5 + H2O  CH3COOH + C2H5OH;
CH3COOH + C2H5OH;
②CH3COOC2H5难溶于水,密度比水小。
(1)V4 =____________ 。
(2)①下列说法正确的是____________________________ ;
A、加入水,平衡正向移动
B、加入稀盐酸可使平衡逆向移动
C、酯层体积不再改变时,反应停止
D、c(CH3COOH) = c(C2H5OH)时,反应达平衡状态
②用各物质的浓度表示水解平衡常数Kh,则表达式为____________ 。
(3)实验中常用饱和食盐水代替蒸馏水,目的是减小乙酸乙酯在水中的溶解度,会使实验结果更准确,______________ 填“能”或“不能”)用饱和Na2CO3溶液代替蒸馏水。
(4)实验中,试管Ⅳ比试管Ⅱ中的酯层减少更快,可能的原因有_______ 。(乙酸乙酯的沸点为77.1 ℃)
| 实验试剂 | 试管Ⅰ(55 ℃) | 试管Ⅱ(55 ℃) | 试管Ⅲ(55 ℃) | 试管Ⅳ(75 ℃) |
| 乙酸乙酯/mL | 1 | V1 | V2 | V3 |
| 1 mol/L NaOH mL | V4 | 3 | 0 | V5 |
| 蒸馏水/mL | 0 | V6 | 5 | 2 |
 CH3COOH + C2H5OH;
CH3COOH + C2H5OH;②CH3COOC2H5难溶于水,密度比水小。
(1)V4 =
(2)①下列说法正确的是
A、加入水,平衡正向移动
B、加入稀盐酸可使平衡逆向移动
C、酯层体积不再改变时,反应停止
D、c(CH3COOH) = c(C2H5OH)时,反应达平衡状态
②用各物质的浓度表示水解平衡常数Kh,则表达式为
(3)实验中常用饱和食盐水代替蒸馏水,目的是减小乙酸乙酯在水中的溶解度,会使实验结果更准确,
(4)实验中,试管Ⅳ比试管Ⅱ中的酯层减少更快,可能的原因有
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】碳酸钙与盐酸是中学化学实验中的重要试剂。
(1)甲同学拟测定CaCO3固体与过量0.1mol/LHCl的反应速率
①该反应的离子方程式___ 。
②设计两种实验方案:
方案一:通过测量___ 和___ 计算反应速率
方案二:通过测量___ 和___ 计算反应速率
③配制250mL1mol/LHCl:量取___ mL12.5mol/LHCl加入烧杯中,加适量蒸馏水,搅拌,待溶液静置室温后转入___ 中,洗涤,定容,摇匀。
(2)乙同学拟用如图装置探究固体表面积和反应物浓度对化学反应速率的影响

限选试剂与用品:1mol/LHCl、颗粒状CaCO3、粉末状CaCO3、蒸馏水、量筒、秒表
①设计实验方案:在固体表面积或反应物浓度不同的条件下,测定___ (要求所测得的数据能直接体现反应速率大小)。
②完成实验表格(除反应时间需测定),以完整体现实验方案
则V1=___ mL,b=___ g,___ 两组(填实验序号)可比较浓度对反应速率影响,___ 两组(填实验序号)可比较固体表面积对反应速率影响。
(1)甲同学拟测定CaCO3固体与过量0.1mol/LHCl的反应速率
①该反应的离子方程式
②设计两种实验方案:
方案一:通过测量
方案二:通过测量
③配制250mL1mol/LHCl:量取
(2)乙同学拟用如图装置探究固体表面积和反应物浓度对化学反应速率的影响

限选试剂与用品:1mol/LHCl、颗粒状CaCO3、粉末状CaCO3、蒸馏水、量筒、秒表
①设计实验方案:在固体表面积或反应物浓度不同的条件下,测定
②完成实验表格(除反应时间需测定),以完整体现实验方案
| 物理量 实验序号 | V(mL)(1mol/LHCl) | m(颗粒状CaCO3质量)(g) | m(粉末状CaCO3质量)(g) | V(蒸馏水)(mL) | m(CO2)(g) | 反应时间t(s) |
| ① | 10.0 | 5.0 | 0 | 10.0 | 2.0 | |
| ② | V1 | 0 | 5.0 | V2 | 2.0 | |
| ③ | 20.0 | b | 0 | V3 | 2.0 |
您最近一年使用:0次
【推荐1】(1)利用海底的“可燃冰”制作的燃料电池的总反应式为CH4+2O2+2KOH=K2CO3+3H2O,则该燃料电池的负极的电极反应为___________ 。
(2)海底的煤经综合利用开发的副产物CO2能生产甲醇燃料,其反应的方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标。
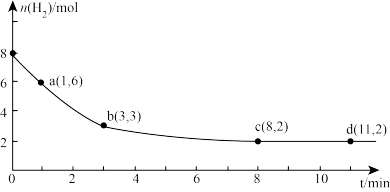
①a点正反应速率______ (填“大于等于或小于”)a点逆反应速率。
②平衡时CO2的物质的量浓度是________ mol/L。
③能够说明该反应达到化学平衡状态的标志是__________ (双选)。
A.单位时间内消耗1molCO2,同时生成3molH2 B.混合气体的密度不随时间变化
C.CH3OH、H2的浓度不再随时间变化 D.CH3OH和H2O浓度相等
(2)海底的煤经综合利用开发的副产物CO2能生产甲醇燃料,其反应的方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标。

①a点正反应速率
②平衡时CO2的物质的量浓度是
③能够说明该反应达到化学平衡状态的标志是
A.单位时间内消耗1molCO2,同时生成3molH2 B.混合气体的密度不随时间变化
C.CH3OH、H2的浓度不再随时间变化 D.CH3OH和H2O浓度相等
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】探究化学反应的快慢和限度具有十分重要的意义。
I.某实验小组欲通过用酸性 和
和 (草酸)反应测定单位时间内生成
(草酸)反应测定单位时间内生成 的速率研究影响反应速率的因素,设计实验方案如下(
的速率研究影响反应速率的因素,设计实验方案如下( 溶液已酸化),实验装置如图甲所示:
溶液已酸化),实验装置如图甲所示:

(1)上述反应的离子方程式为:___________ ,该实验是探究___________ 对反应速率的影响。
(2)若实验①在2min末收集了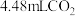 (标准状况下),则在2min末,
(标准状况下),则在2min末,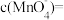
___________ mol/L(假设混合溶液的体积为50mL,反应前后体积变化忽略不计)。
(3)小组同学发现反应速率变化如图乙,其中 时间内速率变快的主要原因可能是:
时间内速率变快的主要原因可能是:___________ 。
Ⅱ.溶液中存在平衡 (橙色)
(橙色)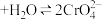 (黄色)
(黄色)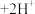 。用溶液进行下列实验:
。用溶液进行下列实验:

(4)向 溶液中加入
溶液中加入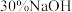 溶液,溶液呈
溶液,溶液呈___________ 色。向 溶液中逐滴加入
溶液中逐滴加入 溶液(已知
溶液(已知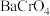 为黄色沉淀),则平衡向着
为黄色沉淀),则平衡向着___________ 方向移动,溶液颜色变化为___________ 。
(5)对比实验②和④可得出的结论是___________ 。
I.某实验小组欲通过用酸性
 和
和 (草酸)反应测定单位时间内生成
(草酸)反应测定单位时间内生成 的速率研究影响反应速率的因素,设计实验方案如下(
的速率研究影响反应速率的因素,设计实验方案如下( 溶液已酸化),实验装置如图甲所示:
溶液已酸化),实验装置如图甲所示:
| 实验序号 | A溶液 | B溶液 |
| ① | 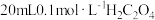 溶液 溶液 | 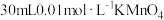 溶液 溶液 |
| ② | 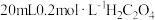 溶液 溶液 | 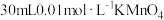 溶液 溶液 |
(2)若实验①在2min末收集了
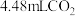 (标准状况下),则在2min末,
(标准状况下),则在2min末,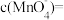
(3)小组同学发现反应速率变化如图乙,其中
 时间内速率变快的主要原因可能是:
时间内速率变快的主要原因可能是:Ⅱ.溶液中存在平衡
 (橙色)
(橙色)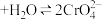 (黄色)
(黄色)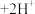 。用溶液进行下列实验:
。用溶液进行下列实验:
(4)向
 溶液中加入
溶液中加入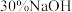 溶液,溶液呈
溶液,溶液呈 溶液中逐滴加入
溶液中逐滴加入 溶液(已知
溶液(已知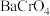 为黄色沉淀),则平衡向着
为黄色沉淀),则平衡向着(5)对比实验②和④可得出的结论是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】I.运用电化学原理可生产硫酸;总反应为2SO2+O2+2H2O=2H2SO4,装置如图所示。其中质子交换膜将该原电池分隔成氧化反应室和还原反应室,能阻止气体通过而允许H+通过。

(1)①H+通过质子交换膜时的移动方向是_______ 。
A.从左向右 B.从右向左
②通入O2的电极反应式是_______ 。
II.光气(COCl2)是合成聚氨酯材料和制农药的原料。
(2)已知光气分子中每个原子最外层都达到8电子稳定结构,光气分子的电子式为_______ 。
(3)在活性炭催化下用氯气和一氧化碳合成光气:Cl2(g)+CO(g) COCl2(g) ΔH=-108 kJ·mol-1。已知:Cl-Cl、C≡O、C-Cl键的键能依次为243 kJ·mol-1、1076 kJ·mol-1、346 kJ·mol-1。根据上述反应估算光气中C=O键的键能为
COCl2(g) ΔH=-108 kJ·mol-1。已知:Cl-Cl、C≡O、C-Cl键的键能依次为243 kJ·mol-1、1076 kJ·mol-1、346 kJ·mol-1。根据上述反应估算光气中C=O键的键能为_______ kJ·mol-1
(4)一定温度下,该反应在密闭容器中进行,下列措施不改变化学反应速率的是_______

(1)①H+通过质子交换膜时的移动方向是
A.从左向右 B.从右向左
②通入O2的电极反应式是
II.光气(COCl2)是合成聚氨酯材料和制农药的原料。
(2)已知光气分子中每个原子最外层都达到8电子稳定结构,光气分子的电子式为
(3)在活性炭催化下用氯气和一氧化碳合成光气:Cl2(g)+CO(g)
 COCl2(g) ΔH=-108 kJ·mol-1。已知:Cl-Cl、C≡O、C-Cl键的键能依次为243 kJ·mol-1、1076 kJ·mol-1、346 kJ·mol-1。根据上述反应估算光气中C=O键的键能为
COCl2(g) ΔH=-108 kJ·mol-1。已知:Cl-Cl、C≡O、C-Cl键的键能依次为243 kJ·mol-1、1076 kJ·mol-1、346 kJ·mol-1。根据上述反应估算光气中C=O键的键能为(4)一定温度下,该反应在密闭容器中进行,下列措施不改变化学反应速率的是_______
| A.缩小体积使压强增大 | B.恒容,充入Cl2 |
| C.恒容,充入N2 | D.恒压,充入N2 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】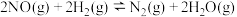 的反应速率表达式为
的反应速率表达式为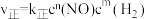 (
( 为正反应速率常数,只与温度有关。
为正反应速率常数,只与温度有关。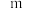 和
和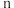 为反应级数,取最简正整数)。
为反应级数,取最简正整数)。
为了探究一定温度下 NO、 的浓度对反应速率的影响,测得实验数据如下:
的浓度对反应速率的影响,测得实验数据如下:
(1)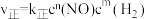 中,m=
中,m=_______ ,n=_______ 。
(2)经研究,有人提出上述反应分两步进行: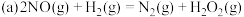 ;
; 。
。
化学总反应由较慢的一步反应决定。
上述反应中,(a)反应较慢,(a)正反应活化能_______ (填“大于”“小于”或“等于”)(b)正反应活化能。
(3)1889年,瑞典化学家阿伦尼乌斯根据实验结果,提出了温度与反应速率常数关系的经验公式: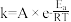 [
[ 为反应速率常数,
为反应速率常数, 为比例常数,
为比例常数,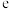 为自然对数的底数,
为自然对数的底数,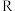 为气体摩尔常数,
为气体摩尔常数, 为开尔文温度,
为开尔文温度, 为活化能
为活化能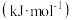 ]。
]。
①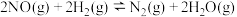 反应达到平衡后,升高温度,正反应速率常数增大的倍数
反应达到平衡后,升高温度,正反应速率常数增大的倍数_______ (填“大于”“小于”或“等于”)逆反应速率常数增大的倍数。
②由此判断下列说法中正确的是_______ (填序号,K正、K逆为正、逆速率常数)。
A.其他条件不变,升高温度,K正增大,K逆变小
B.其他条件不变,使用催化剂,K正、K逆同倍数增大
C.其他条件不变,增大反应物浓度K正增大,K逆不变
D.其他条件不变,减小压强,K正、K逆都变小
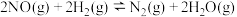 的反应速率表达式为
的反应速率表达式为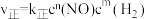 (
( 为正反应速率常数,只与温度有关。
为正反应速率常数,只与温度有关。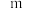 和
和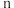 为反应级数,取最简正整数)。
为反应级数,取最简正整数)。为了探究一定温度下 NO、
 的浓度对反应速率的影响,测得实验数据如下:
的浓度对反应速率的影响,测得实验数据如下:| 序号 | 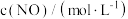 |  | 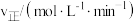 |
| I | 0.10 | 0.10 | 0.414 |
| II | 0.10 | 0.20 | 0.828 |
| III | 0.30 | 0.10 | 3.726 |
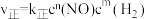 中,m=
中,m=(2)经研究,有人提出上述反应分两步进行:
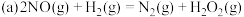 ;
; 。
。化学总反应由较慢的一步反应决定。
上述反应中,(a)反应较慢,(a)正反应活化能
(3)1889年,瑞典化学家阿伦尼乌斯根据实验结果,提出了温度与反应速率常数关系的经验公式:
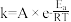 [
[ 为反应速率常数,
为反应速率常数, 为比例常数,
为比例常数,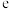 为自然对数的底数,
为自然对数的底数,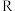 为气体摩尔常数,
为气体摩尔常数, 为开尔文温度,
为开尔文温度, 为活化能
为活化能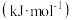 ]。
]。①
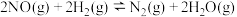 反应达到平衡后,升高温度,正反应速率常数增大的倍数
反应达到平衡后,升高温度,正反应速率常数增大的倍数②由此判断下列说法中正确的是
A.其他条件不变,升高温度,K正增大,K逆变小
B.其他条件不变,使用催化剂,K正、K逆同倍数增大
C.其他条件不变,增大反应物浓度K正增大,K逆不变
D.其他条件不变,减小压强,K正、K逆都变小
您最近一年使用:0次
【推荐2】能源与信息、材料被称为现代社会发展的三大支柱。请回答下列问题。
(1)请判断,甲图②中的温度___________ (填“升高”或“降低”)。反应过程___________ (填“①”或“②”)的能量变化可用图乙表示。

(2)氢气被公认为是21世纪代替矿物燃料的理想能源, 氢气燃烧时放出
氢气燃烧时放出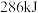 热量,而每千克汽油燃烧时放出的热量为
热量,而每千克汽油燃烧时放出的热量为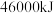 。试据此分析氢气作为能源代替汽油的优势
。试据此分析氢气作为能源代替汽油的优势___________ 。
(3)甲烷可消除 的污染,其反应为
的污染,其反应为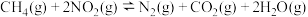 。在
。在 密闭容器中,控制不同温度,分别加入
密闭容器中,控制不同温度,分别加入 和
和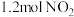 ,测得
,测得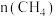 随时间变化的有关实验数据见下表。
随时间变化的有关实验数据见下表。
①组别 中,反应开始至
中,反应开始至 ,
,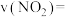
___________  。
。
②由实验数据可知实验控制的温度:T1______ T2 (填“ ”“
”“ ”或“
”或“ ”)。
”)。
③一定条件下,能说明该反应进行到最大限度的是___________ (填序号)。
a.容器内 的物质的量分数不再随时间而发生变化
的物质的量分数不再随时间而发生变化
b. 的浓度为0
的浓度为0
c.体系内物质的平均相对分子质量保持不变
d. 体系内气体的密度保持不变
(4) 、
、 和熔融
和熔融 可制作燃料电池,其原理如图该电池在使用过程中石墨Ⅱ电极上生成氧化物
可制作燃料电池,其原理如图该电池在使用过程中石墨Ⅱ电极上生成氧化物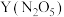 ,则石墨Ⅰ电极是
,则石墨Ⅰ电极是___________ (填“正极”或“负极”),电流从___________ (填“石墨Ⅰ”或“石墨Ⅱ”,下同)经导线流向___________ 。
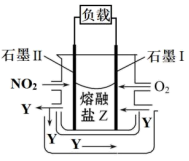
(1)请判断,甲图②中的温度

(2)氢气被公认为是21世纪代替矿物燃料的理想能源,
 氢气燃烧时放出
氢气燃烧时放出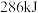 热量,而每千克汽油燃烧时放出的热量为
热量,而每千克汽油燃烧时放出的热量为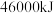 。试据此分析氢气作为能源代替汽油的优势
。试据此分析氢气作为能源代替汽油的优势(3)甲烷可消除
 的污染,其反应为
的污染,其反应为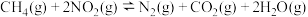 。在
。在 密闭容器中,控制不同温度,分别加入
密闭容器中,控制不同温度,分别加入 和
和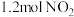 ,测得
,测得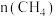 随时间变化的有关实验数据见下表。
随时间变化的有关实验数据见下表。| 组别 | 温度 | 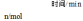 | 0 | 10 | 20 | 40 | 50 |
 |  | 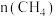 | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
 |  | 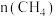 | 0.50 | 0.30 | 0.18 | 0.15 | 0.15 |
①组别
 中,反应开始至
中,反应开始至 ,
,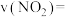
 。
。②由实验数据可知实验控制的温度:T1
 ”“
”“ ”或“
”或“ ”)。
”)。③一定条件下,能说明该反应进行到最大限度的是
a.容器内
 的物质的量分数不再随时间而发生变化
的物质的量分数不再随时间而发生变化b.
 的浓度为0
的浓度为0c.体系内物质的平均相对分子质量保持不变
d. 体系内气体的密度保持不变
(4)
 、
、 和熔融
和熔融 可制作燃料电池,其原理如图该电池在使用过程中石墨Ⅱ电极上生成氧化物
可制作燃料电池,其原理如图该电池在使用过程中石墨Ⅱ电极上生成氧化物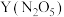 ,则石墨Ⅰ电极是
,则石墨Ⅰ电极是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】大苏打(Na2S2O3)是一种重要的化工产品,也是实验室常用试剂。某小组对大苏打展开如下探究。
实验(一):探究大苏打性质。
按如图装置进行实验,记录如下:
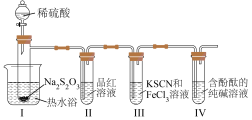
实验过程中发现,装置Ⅰ中产生气泡和浅黄色沉淀,试管Ⅱ中红色溶液变为无色,试管Ⅳ中红色溶液逐渐变为浅红色,最终变为无色。
(1)装Na2S2O3的仪器名称是_______ ,其他条件相同时,若拆去热水浴,试管Ⅱ中溶液褪色速率变_______ (填“快”或“慢”)。
(2)装置Ⅰ中的离子方程式为_______ 。
(3)若试管Ⅲ中现象是红色溶液变浅,证明氧化产物为 的试剂是
的试剂是_______ 。由试管Ⅳ中现象可知,电离常数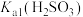
_______ (填“>”“<”或“=”) 。
。
实验(二):探究影响H2SO4和Na2S2O3反应的速率的外界因素。
(4)
_______ 。
(5)实验记录: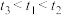 。由实验①②得出的结论是
。由实验①②得出的结论是_______ 。设计实验①③的目的是_______ 。
实验(三):测定中x的值。
已知新制得的大苏打中往往含有结晶水,化学式可表示为,称取24.8g Na2S2O3∙xH2O溶于水配制成100mL溶液,准确量取10.00mL配制的溶液于锥形瓶,滴加0.2mol∙L-1碘水至恰好完全反应,消耗25.00mL碘水。提示: 。
。
(6)Na2S2O3∙xH2O中x为_______ 。
实验(一):探究大苏打性质。
按如图装置进行实验,记录如下:

实验过程中发现,装置Ⅰ中产生气泡和浅黄色沉淀,试管Ⅱ中红色溶液变为无色,试管Ⅳ中红色溶液逐渐变为浅红色,最终变为无色。
(1)装Na2S2O3的仪器名称是
(2)装置Ⅰ中的离子方程式为
(3)若试管Ⅲ中现象是红色溶液变浅,证明氧化产物为
 的试剂是
的试剂是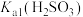
 。
。实验(二):探究影响H2SO4和Na2S2O3反应的速率的外界因素。
| 编号 | 0.1mol∙L-1 Na2S2O3溶液的体积/mL | 0.1mol∙L-1 H2SO4溶液的体积/mL | 水的体积/mL | 水浴温度/℃ | 测定变浑浊时间/s |
| ① | 10.0 | 15.0 | 0 | 35 |  |
| ② | 10.0 | 10.0 |  | 35 |  |
| ③ |  | 15.0 | 0 | 45 |  |
(4)

(5)实验记录:
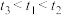 。由实验①②得出的结论是
。由实验①②得出的结论是实验(三):测定中x的值。
已知新制得的大苏打中往往含有结晶水,化学式可表示为,称取24.8g Na2S2O3∙xH2O溶于水配制成100mL溶液,准确量取10.00mL配制的溶液于锥形瓶,滴加0.2mol∙L-1碘水至恰好完全反应,消耗25.00mL碘水。提示:
 。
。(6)Na2S2O3∙xH2O中x为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】I.实验室用50 mL 0.50mol/L盐酸、50mL 0.55 mol/LNaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:

完成下列问题:
(1)图中实验装置中尚缺少的玻璃仪器是____________________________ .
(2)在操作正确的前提下,提高中和热测定准确性的关键是________________________ .
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H=_________ [盐酸和NaOH溶液的密度按1g/cm3计算,反应后混合溶液的比热容(c)按4.18J/(g·℃)计算].
(4)如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将_____ (填“偏大”、“偏小”、“不变”).如改用60 mL0.5mol/L的盐酸与50 mL 0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量______ (填“相等”或“不相等”),所求中和热_____ (填“相等”或“不相等”)。
(5) 上述实验结果数值与57.3相比有偏差,产生偏差的原因可能是(填字母)______ .
A.测量盐酸的温度后,温度计没有用水冲洗干净
B. 把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.在量取NaOH溶液时仰视计数
E.大烧杯的盖扳中间小孔太大。
Ⅱ.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过褪色所需时间来判断反应的快慢。该小组设计了如下方案:

(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4) ≥_______ 。
(2)试验编号②和③探究的内容是_____________ 。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=__________ mol·L-1·min-1。

| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
(1)图中实验装置中尚缺少的玻璃仪器是
(2)在操作正确的前提下,提高中和热测定准确性的关键是
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H=
(4)如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将
(5) 上述实验结果数值与57.3相比有偏差,产生偏差的原因可能是(填字母)
A.测量盐酸的温度后,温度计没有用水冲洗干净
B. 把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.在量取NaOH溶液时仰视计数
E.大烧杯的盖扳中间小孔太大。
Ⅱ.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过褪色所需时间来判断反应的快慢。该小组设计了如下方案:

(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4) ≥
(2)试验编号②和③探究的内容是
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有________ ,____________ 。
(2)加入少量硫酸铜溶液可以加快氢气生成速率的原因是___________ 。
(3)要加快上述实验中气体产生速率,还可以采取的措施有___________ ,___________ (答两种)
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中:V1=______ ,V6=______ ,V7=_______ 。
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_____ 。
(1)上述实验中发生反应的化学方程式有
(2)加入少量硫酸铜溶液可以加快氢气生成速率的原因是
(3)要加快上述实验中气体产生速率,还可以采取的措施有
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验混合溶液 | A | B | C | D | E | F |
| 4 mol/L H2SO4(mL) | 50 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液(mL) | 0 | 5 | 15 | 25 | V6 | 50 |
| H2O(mL) | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1=
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
[实验原理]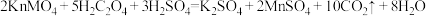
[实验内容及记录]
(1)请完成此实验设计,其中:
_______ ,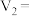
_______ 。
(2)实验①、②探究的是_______ 对化学反应速率的影响,根据表中的实验数据,可以得到的结论是_______ 。
(3)探究温度对化学反应速率的影响,应选择_______ (填实验编号)。
(4)该小组同学根据经验绘制了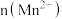 随时间变化的趋势如图甲所示,但有同学查阅已有的实验资料发现该实验过程中
随时间变化的趋势如图甲所示,但有同学查阅已有的实验资料发现该实验过程中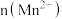 随时间变化的实际趋势如图乙所示。
随时间变化的实际趋势如图乙所示。

该小组同学根据图乙所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
①该小组同学提出的假设是_______ 。
②能佐证该假设成立的实验证据是_______ 。
[实验原理]
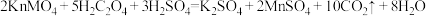
| 实验编号 | 实验温度/℃ | 试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
0.6mol/L 溶液 溶液 |  | 3mol/L稀 溶液 溶液 | 0.05mol/L 溶液 溶液 | |||
| ① | 25 | 3.0 |  | 2.0 | 3.0 | 1.5 |
| ② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
| ③ | 50 | 2.0 |  | 2.0 | 3.0 | 1.7 |
(1)请完成此实验设计,其中:

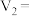
(2)实验①、②探究的是
(3)探究温度对化学反应速率的影响,应选择
(4)该小组同学根据经验绘制了
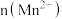 随时间变化的趋势如图甲所示,但有同学查阅已有的实验资料发现该实验过程中
随时间变化的趋势如图甲所示,但有同学查阅已有的实验资料发现该实验过程中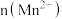 随时间变化的实际趋势如图乙所示。
随时间变化的实际趋势如图乙所示。
该小组同学根据图乙所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
| 实验编号 | 实验温度/℃ | 试管中所加试剂及其用量 | 再向试管中加入某种固体 | 溶液褪至无色所需时间/min | |||
0.6mol/L 溶液 溶液 |  | 3mol/L稀 溶液 溶液 | 0.05mol/L 溶液 溶液 | ||||
| ④ | 25 | 2.0 | 3.0 | 2.0 | 3.0 |  | t |
②能佐证该假设成立的实验证据是
您最近一年使用:0次



