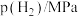工业上常用如下反应消除氮氧化物的污染:
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH
N2(g)+CO2(g)+2H2O(g) ΔH
回答下面问题:
(1)一定温度下,在某密闭容器中进行上述反应,下列措施一定能够加快化学反应速率的是_____ 。
①缩小体积使压强增大②恒容充入NO2③恒容充入He
④恒压充入He⑤升高反应温度
(2)在温度为T1和T2时,分别将0.40 mol CH4和1.0 mol NO2充入体积为1 L的密闭容器中n(CH4)随反应时间的变化如图所示。
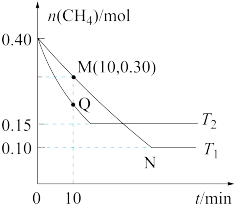
①温度为T1时,0~10 min内NO2的平均反应速率v(NO2)=____________ 。
②温度为T2时,NO2的平衡转化率a%=____________ 。
③比较M点和Q点反应速率较高的是_________ ,则T1_________ T2(填大于、小于或不能确定)。
④比较M点和N点容器内气体压强较大的是____________ ,反应速率较快的是____________ ,原因是____________ 。
CH4(g)+2NO2(g)
 N2(g)+CO2(g)+2H2O(g) ΔH
N2(g)+CO2(g)+2H2O(g) ΔH回答下面问题:
(1)一定温度下,在某密闭容器中进行上述反应,下列措施一定能够加快化学反应速率的是
①缩小体积使压强增大②恒容充入NO2③恒容充入He
④恒压充入He⑤升高反应温度
(2)在温度为T1和T2时,分别将0.40 mol CH4和1.0 mol NO2充入体积为1 L的密闭容器中n(CH4)随反应时间的变化如图所示。

①温度为T1时,0~10 min内NO2的平均反应速率v(NO2)=
②温度为T2时,NO2的平衡转化率a%=
③比较M点和Q点反应速率较高的是
④比较M点和N点容器内气体压强较大的是
更新时间:2020-10-24 22:16:23
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某校化学活动社团做了如下探究实验:
实验一:测定1 mol/L的硫酸与锌粒和锌粉反应的速率,设计如图1装置:
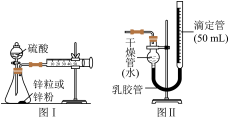
(1)装置图1中放有硫酸的仪器名称是______ 。
(2)按照图1装置实验时,限定了两次实验时间均为10 min,还需要测定的另一个数据是________ 。
(3)若将图1装置中的气体收集装置改为图2,实验完毕待冷却后,该生准备读取滴定管上液面所在处的刻度数,发现滴定管中液面高于干燥管中液面,应首先采取的操作是________ 。
实验二:利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究外界条件改变对化学反应速率的影响。实验如下:
(1)写出相应反应的离子方程式___________ 。
(2)通过实验A、B可探究______ (填外部因素)的改变对反应速率的影响,通过实验_____ 可探究温度变化对化学反应速率的影响。
(3)利用实验B中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=____ 。
(4)实验中发现:反应一段时间后该反应速率会加快,造成此种变化的原因是反应体系中的某种粒子对 与
与 之间的反应有某种特殊的作用,则该作用是
之间的反应有某种特殊的作用,则该作用是_______ 。
实验一:测定1 mol/L的硫酸与锌粒和锌粉反应的速率,设计如图1装置:

(1)装置图1中放有硫酸的仪器名称是
(2)按照图1装置实验时,限定了两次实验时间均为10 min,还需要测定的另一个数据是
(3)若将图1装置中的气体收集装置改为图2,实验完毕待冷却后,该生准备读取滴定管上液面所在处的刻度数,发现滴定管中液面高于干燥管中液面,应首先采取的操作是
实验二:利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究外界条件改变对化学反应速率的影响。实验如下:
| 序号 | 温度/K | 0.02mol·L-1KMnO4 | 0.1mol·L-1H2C2O4 | H2O | 溶液颜色褪至无色时所需时间/s |
| V/mL | V/mL | V/mL | |||
| A | 293 | 2 | 5 | 3 | t1 |
| B | 293 | 2 | 3 | 5 | 8 |
| C | 313 | 2 | 3 | 5 | t2 |
(2)通过实验A、B可探究
(3)利用实验B中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=
(4)实验中发现:反应一段时间后该反应速率会加快,造成此种变化的原因是反应体系中的某种粒子对
 与
与 之间的反应有某种特殊的作用,则该作用是
之间的反应有某种特殊的作用,则该作用是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】工业上通过丁烷裂解可以获得乙烯和丙烯等化工原料:
①C4H10(丁烷,g) CH4(g)+C3H6(丙烯,g);
CH4(g)+C3H6(丙烯,g);
②C4H10(丁烷,g) C2H6(g)+C2H4(g)。
C2H6(g)+C2H4(g)。
(1)丙烯和乙烯均能与Br2发生加反应,标准状况下,33.6L由丙烯和乙烯组成的混合气体与足量的溴水反应,最多消耗
(2)向一体积为2L的恒容密团容器中充入2 mol丁烷,在一定温度和催化剂作用下发生上述2个反应,测得丁烷、丙烯的物质的量与时间关系如图所示。

①下列情况表明上述反应达到平衡状态的是
A.混合气体密度不随时间变化 B.混合气体平均摩尔质量不随时间变化
C.混合气体总压强不随时间变化 D.混合气体中碳原子总数不随时间变化
E.体系中各物质的浓度相等
②0 -4 min内,乙烷的平均反应速率为
③在该条件下,丁烷的平衡转化率为
④平衡体系中,n(乙烯):n(丙烯)=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】I.在2L密闭容器内,800℃时反应2NO(g)+O2(g)⇌2NO2(g)体系中,n(NO)随时间的变化如下表:
(1)下图中表示NO2的变化的曲线是_______ (填字母)。

(2)800℃,反应达到平衡时,NO的转化率是_______ 。
(3)用O2表示从0~2s内该反应的平均速率v=_______ 。
Ⅱ.将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)⇌2NH3(g)+CO2(g)
(1)下图所示,反应中断开反应物化学键吸收的能量_______ (填写“大于”“等于”“小于”)形成生成物中化学键放出的能量。
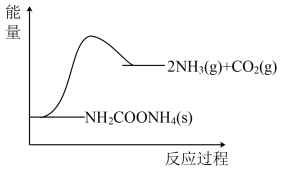
(2)能使该反应的速率增大的是_______ 。
A.及时分离出CO2气体 B.适当升高温度
C.加入少量NH2COONH4(s) D.选择高效催化剂
(3)下列不能判断该分解反应已经达到化学平衡状态的是_______ (填序号)。
①v正(NH3)=2v逆(CO2)
②密闭容器中NH3的物质的量不变
③容器中NH3与CO2的物质的量之比保持不变
④密闭容器中气体总压强保持不变
⑤CO2(g)的体积分数保持不变
⑥形成6个N—H的同时有2个C=O断裂
⑦气体的平均相对分子质量保持不变
⑧混合气体的密度保持不变
| 时间/s | 0 | 1 | 2 | 3 | 5 | 6 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)下图中表示NO2的变化的曲线是

(2)800℃,反应达到平衡时,NO的转化率是
(3)用O2表示从0~2s内该反应的平均速率v=
Ⅱ.将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)⇌2NH3(g)+CO2(g)
(1)下图所示,反应中断开反应物化学键吸收的能量

(2)能使该反应的速率增大的是
A.及时分离出CO2气体 B.适当升高温度
C.加入少量NH2COONH4(s) D.选择高效催化剂
(3)下列不能判断该分解反应已经达到化学平衡状态的是
①v正(NH3)=2v逆(CO2)
②密闭容器中NH3的物质的量不变
③容器中NH3与CO2的物质的量之比保持不变
④密闭容器中气体总压强保持不变
⑤CO2(g)的体积分数保持不变
⑥形成6个N—H的同时有2个C=O断裂
⑦气体的平均相对分子质量保持不变
⑧混合气体的密度保持不变
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】(1)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快。由此判断,影响化学反应速率的因素有______ 和______ 。
(2)锌与盐酸反应速率可以通过观察_________ 进行判断,也可通过实验测定。通过实验测定锌与盐酸反应速率,除测量反应时间外,还需要测量的物理量是_______ 或 _____ 。
(3)为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法是:在100ml稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积已换算为标准状况):
①哪一时间段反应速率最大_______ (填“0~1 min”或“1~2 min”或“2~3 min”或“3~4 min”或“4~5min”)。
②2~3 min时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)为____________ 。
③试分析1~3min时间段里,反应速率变大的主要原因_________________________ 。
(2)锌与盐酸反应速率可以通过观察
(3)为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法是:在100ml稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积已换算为标准状况):
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 体积/mL | 50 | 120 | 232 | 290 | 310 |
①哪一时间段反应速率最大
②2~3 min时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)为
③试分析1~3min时间段里,反应速率变大的主要原因
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】水煤气变换反应是工业上的重要反应,可用于制氢。
水煤气变换反应: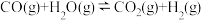
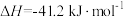
该反应分两步完成:
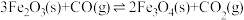
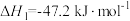
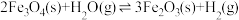
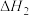
请回答:
(1)
_______  。
。
(2)恒定总压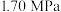 和水碳比[
和水碳比[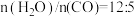 ]投料,在不同条件下达到平衡时
]投料,在不同条件下达到平衡时 和
和 的分压(某成分分压=总压×该成分的物质的量分数)如下表:
的分压(某成分分压=总压×该成分的物质的量分数)如下表:
①在条件1下,水煤气变换反应的平衡常数
___________ 。
②对比条件1,条件2中 产率下降是因为发生了一个不涉及
产率下降是因为发生了一个不涉及 的副反应,写出该反应方程式
的副反应,写出该反应方程式____ 。
(3)下列说法正确的是______。
(4)水煤气变换反应是放热的可逆反应,需在多个催化剂反应层间进行降温操作以“去除”反应过程中的余热(如图1所示),保证反应在最适宜温度附近进行。______ 。
A.按原水碳比通入冷的原料气 B.喷入冷水(蒸气) C.通过热交换器换热
②若采用喷入冷水(蒸气)的方式降温,在图3中作出 平衡转化率随温度变化的曲线
平衡转化率随温度变化的曲线____ 。
(5)在催化剂活性温度范围内,水煤气变换反应的历程包含反应物分子在催化剂表面的吸附(快速)、反应及产物分子脱附等过程。随着温度升高,该反应的反应速率先增大后减小,其速率减小的原因是________ 。
水煤气变换反应:
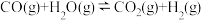
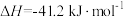
该反应分两步完成:
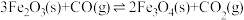
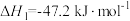
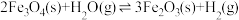
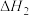
请回答:
(1)

 。
。(2)恒定总压
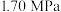 和水碳比[
和水碳比[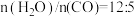 ]投料,在不同条件下达到平衡时
]投料,在不同条件下达到平衡时 和
和 的分压(某成分分压=总压×该成分的物质的量分数)如下表:
的分压(某成分分压=总压×该成分的物质的量分数)如下表:
|
|
| |
条件1 | 0.40 | 0.40 | 0 |
条件2 | 0.42 | 0.36 | 0.02 |

②对比条件1,条件2中
 产率下降是因为发生了一个不涉及
产率下降是因为发生了一个不涉及 的副反应,写出该反应方程式
的副反应,写出该反应方程式(3)下列说法正确的是______。
A.通入反应器的原料气中应避免混入 |
B.恒定水碳比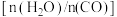 ,增加体系总压可提高 ,增加体系总压可提高 的平衡产率 的平衡产率 |
C.通入过量的水蒸气可防止 被进一步还原为 被进一步还原为 |
| D.通过充入惰性气体增加体系总压,可提高反应速率 |
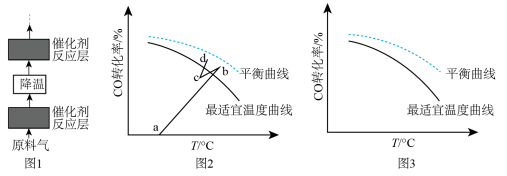
A.按原水碳比通入冷的原料气 B.喷入冷水(蒸气) C.通过热交换器换热
②若采用喷入冷水(蒸气)的方式降温,在图3中作出
 平衡转化率随温度变化的曲线
平衡转化率随温度变化的曲线(5)在催化剂活性温度范围内,水煤气变换反应的历程包含反应物分子在催化剂表面的吸附(快速)、反应及产物分子脱附等过程。随着温度升高,该反应的反应速率先增大后减小,其速率减小的原因是
您最近一年使用:0次
【推荐3】我国力争于2030年前做到碳达峰,2060年前实现碳中和。利用CO2与H2合成有机燃料CH2=CH2是研究热点之一、该反应体系主要涉及以下反应:
①CO2(g)+H2(g)⇌CO(g)+H2O(g) △H1 副反应
②2CO(g)+4H2(g)⇌CH2=CH2(g)+2H2O(g) △H2 副反应
③2CO2(g)+6H2(g)⇌CH2=CH2(g)+4H2O(g) △H3 主反应
(1)根据盖斯定律,反应③的△H3=___________ (用△H1和△H2的代数式表示)。
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
(3)一定条件下,将1molCO2和3molH2加入1L容积不变的密闭容器中,只发生主反应 (不考虑发生副反应),温度对CO2的平衡转化率、实际转化率和催化剂催化效率的影响如图甲所示。
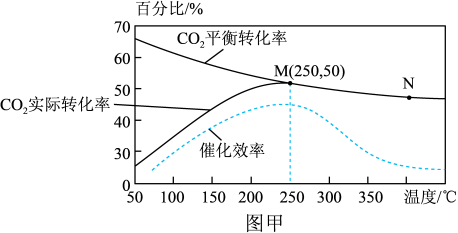
①结合图象分析该反应实际反应温度定于250℃的原因:___________ 。
②实验测得v正=k正c2(CO2)c6(H2),v逆=k逆c(C2H4)·c4(H2O),k正、k逆为速率常数,只与温度有关,250℃时 =
=________ (写出代数式即可);当温度升高时,k正增大m倍,k逆增大n倍,则m_________ n(填“>”、“<”或“=”)。
③设KX为物质的量分数平衡常数,其表达式写法:在浓度平衡常数表达式中,用物质的量分数代替浓度。250℃时,该反应达到平衡时的平衡常数KX=________ (写出代数式即可)。
(4)科学家通过电化学方法,用惰性电极进行电解,可有效实现以CO2和水为原料在酸性条件下合成乙烯,其合成原理如图乙所示:
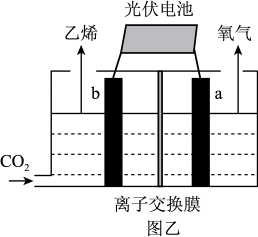
b电极上的电极反应式为________ ,该装置中使用的是_______ (“阴”或“阳”)离子交换膜。
①CO2(g)+H2(g)⇌CO(g)+H2O(g) △H1 副反应
②2CO(g)+4H2(g)⇌CH2=CH2(g)+2H2O(g) △H2 副反应
③2CO2(g)+6H2(g)⇌CH2=CH2(g)+4H2O(g) △H3 主反应
(1)根据盖斯定律,反应③的△H3=
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
| A.增大CO2与H2的浓度,反应①、②、③的正反应速率都增加 |
| B.降低反应温度,反应①、②、③的正、逆反应速率都减小 |
| C.加入催化剂,可提高CO2的平衡转化率 |
| D.及时分离出CH2=CH2(g),反应②、③的平衡均向右移动 |

①结合图象分析该反应实际反应温度定于250℃的原因:
②实验测得v正=k正c2(CO2)c6(H2),v逆=k逆c(C2H4)·c4(H2O),k正、k逆为速率常数,只与温度有关,250℃时
 =
=③设KX为物质的量分数平衡常数,其表达式写法:在浓度平衡常数表达式中,用物质的量分数代替浓度。250℃时,该反应达到平衡时的平衡常数KX=
(4)科学家通过电化学方法,用惰性电极进行电解,可有效实现以CO2和水为原料在酸性条件下合成乙烯,其合成原理如图乙所示:

b电极上的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】合成氨是人类科学技术上的一项重大突破:
(1)根据下表中键能写出合成氨的热化学方程式_______ 。
(2)科研小组模拟不同条件下的合成氨反应,向容器中充入a mol N2和b mol H2,不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系如图1:

①T1、T2、T3由大到小的排序为_______ 。
②在T2、60MPa条件下,A点v正_______ v逆(填“>”、“<”或“=”)
③图2表示500 °C、60 MPa条件下,合成氨反应原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡转化率为_______ %(结果保留一位小数)。
(3)用NH3可消除NO污染,反应原理为:4NH3+6NO 5N2+6H2O,以n(NH3)﹕n(NO)分别为4﹕1、3﹕1、1﹕3投料,得到NO脱除率随温度变化的曲线如图所示:
5N2+6H2O,以n(NH3)﹕n(NO)分别为4﹕1、3﹕1、1﹕3投料,得到NO脱除率随温度变化的曲线如图所示:
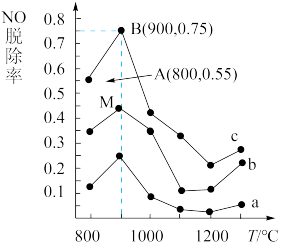
①曲线a对应的n(NH3)﹕n(NO)=_______ 。
②曲线c中NO的起始浓度为4×10-4 mg/m3,从A点到B点(经过0.8 s,该时间段内NO的脱除速率_______ mg/(m3·s)。
(4)用间接电化学法可对NO进行无害化处理,其原理如下图所示(质子膜允许H+和H2O通过),用离子方程式表示吸收塔内吸收NO的原理:_______ 。

(1)根据下表中键能写出合成氨的热化学方程式
| 化学键 | H-H | O-H | N≡N | H-N |
| E/(kJ·mol-1) | 436 | 465 | 946 | 391 |

①T1、T2、T3由大到小的排序为
②在T2、60MPa条件下,A点v正
③图2表示500 °C、60 MPa条件下,合成氨反应原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡转化率为
(3)用NH3可消除NO污染,反应原理为:4NH3+6NO
 5N2+6H2O,以n(NH3)﹕n(NO)分别为4﹕1、3﹕1、1﹕3投料,得到NO脱除率随温度变化的曲线如图所示:
5N2+6H2O,以n(NH3)﹕n(NO)分别为4﹕1、3﹕1、1﹕3投料,得到NO脱除率随温度变化的曲线如图所示:
①曲线a对应的n(NH3)﹕n(NO)=
②曲线c中NO的起始浓度为4×10-4 mg/m3,从A点到B点(经过0.8 s,该时间段内NO的脱除速率
(4)用间接电化学法可对NO进行无害化处理,其原理如下图所示(质子膜允许H+和H2O通过),用离子方程式表示吸收塔内吸收NO的原理:

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】(1)在其他条件不变的情况下,起始氢气的物质的量[用n(H2)表示]对N2(g)+3H2(g) 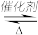 2NH3(g)反应的影响可表示成如图所示的规律(图中
2NH3(g)反应的影响可表示成如图所示的规律(图中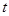 表示温度,
表示温度, 表示物质的量)。
表示物质的量)。

①比较在a、b、c三点处的平衡状态中,反应物N2的转化率最高的是__________ 。
②若容器容积为1L, =3mol,反应达到平衡时H2的转化率为60%,则在起始时体系中加入N2的物质的量为
=3mol,反应达到平衡时H2的转化率为60%,则在起始时体系中加入N2的物质的量为__________ mol,此条件下(t2)反应的平衡常数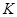 =
=________ 。
③图象中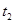 和
和 的关系是t2
的关系是t2 ______ t1(填“高于”“低于”“等于”或“无法确定”)。
(2)氨气和氧气与145 时开始反应,在不同温度和催化剂条件下生成不同产物(如图所示)
时开始反应,在不同温度和催化剂条件下生成不同产物(如图所示)
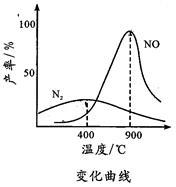
4NH3+5O2 4NO+6H2O
4NO+6H2O
4NH3+3O2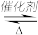 2N2+6H2O
2N2+6H2O
温度较低时以生成________ 为主,温度高于900 时,NO产率下降的原因是
时,NO产率下降的原因是______ 。
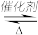 2NH3(g)反应的影响可表示成如图所示的规律(图中
2NH3(g)反应的影响可表示成如图所示的规律(图中 表示温度,
表示温度, 表示物质的量)。
表示物质的量)。
①比较在a、b、c三点处的平衡状态中,反应物N2的转化率最高的是
②若容器容积为1L,
 =3mol,反应达到平衡时H2的转化率为60%,则在起始时体系中加入N2的物质的量为
=3mol,反应达到平衡时H2的转化率为60%,则在起始时体系中加入N2的物质的量为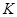 =
=③图象中
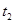 和
和 的关系是t2
的关系是t2 (2)氨气和氧气与145
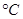 时开始反应,在不同温度和催化剂条件下生成不同产物(如图所示)
时开始反应,在不同温度和催化剂条件下生成不同产物(如图所示)
4NH3+5O2
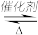 4NO+6H2O
4NO+6H2O4NH3+3O2
 2N2+6H2O
2N2+6H2O温度较低时以生成
 时,NO产率下降的原因是
时,NO产率下降的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】乙醇水蒸气重整制氢是制备氢气的常用方法,体系中发生的主要反应如下:
Ⅰ.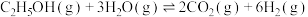
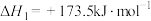
Ⅱ.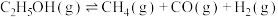
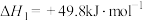
Ⅲ.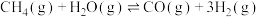

Ⅳ.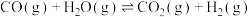
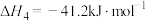
(1)
______  ,平衡时CO在所有产物中的物质的量分数随温度的变化应是图1中曲线
,平衡时CO在所有产物中的物质的量分数随温度的变化应是图1中曲线______ (填序号)
(2)为研究上述反应体系中的平衡关系,向某恒温恒容反应容器中按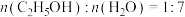 投料,初始压强为p kPa。充分反应,平衡时,乙醇转化率为80%,测得
投料,初始压强为p kPa。充分反应,平衡时,乙醇转化率为80%,测得 体积分数为18%,
体积分数为18%, 体积分数为4%,则反应Ⅳ的平衡常数
体积分数为4%,则反应Ⅳ的平衡常数
______ (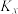 为以物质的量分数表示的平衡常数),到达平衡时体系中CO的分压为
为以物质的量分数表示的平衡常数),到达平衡时体系中CO的分压为______ kPa, 的产率为
的产率为______ 。
(3)一定温度下,加入吸附剂可以改变氢气产率。图2为几种改性CaO吸附剂增重量随时间变化曲线,其中提高氢气产率最大的吸附剂为______ ,原因是______ 。
Ⅰ.
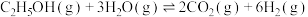
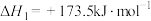
Ⅱ.
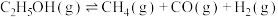
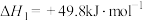
Ⅲ.
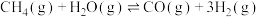

Ⅳ.
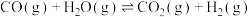
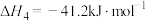
(1)

 ,平衡时CO在所有产物中的物质的量分数随温度的变化应是图1中曲线
,平衡时CO在所有产物中的物质的量分数随温度的变化应是图1中曲线(2)为研究上述反应体系中的平衡关系,向某恒温恒容反应容器中按
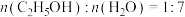 投料,初始压强为p kPa。充分反应,平衡时,乙醇转化率为80%,测得
投料,初始压强为p kPa。充分反应,平衡时,乙醇转化率为80%,测得 体积分数为18%,
体积分数为18%, 体积分数为4%,则反应Ⅳ的平衡常数
体积分数为4%,则反应Ⅳ的平衡常数
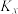 为以物质的量分数表示的平衡常数),到达平衡时体系中CO的分压为
为以物质的量分数表示的平衡常数),到达平衡时体系中CO的分压为 的产率为
的产率为(3)一定温度下,加入吸附剂可以改变氢气产率。图2为几种改性CaO吸附剂增重量随时间变化曲线,其中提高氢气产率最大的吸附剂为

您最近一年使用:0次