下列关于有效碰撞理论与影响速率因素之间关系正确的是( )
| A.增大反应物浓度,可以提高活化分子百分数,从而提高反应速率 |
| B.对于气体反应来说,通过压缩体积增大压强,可以提高单位体积内活化分子数,从而提高反应速率 |
| C.活化分子之间发生的碰撞一定为有效碰撞 |
| D.加入催化剂可以降低活化能,活化分子百分比虽然没变,但可以加快反应速率 |
20-21高二上·河南安阳·阶段练习 查看更多[4]
(已下线)2.1.3 活化能(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)课前-2.1.2 影响化学反应速率的因素 活化能-课前、课中、课后(人教版2019选择性必修1)河南省正阳县高级中学2020-2021学年高二上学期第二次素质检测化学试题河南省安阳市第一中学2020-2021学年高二上学期第一次阶段考试化学试题
更新时间:2020-10-28 14:11:36
|
相似题推荐
单选题
|
容易
(0.94)
解题方法
【推荐1】下列说法错误的是
| A.决定化学反应速率的主要因素是参加反应的物质的性质 |
| B.升高温度可使吸热反应的反应速率增大,使放热反应的反应速率减小 |
| C.对于有气体参加的反应,增大压强,反应速率加快 |
| D.催化剂能增大单位体积内活化分子的百分数,从而增大化学反应速率 |
您最近一年使用:0次
单选题
|
容易
(0.94)
名校
解题方法
【推荐2】某温度下,体积可变的密闭容器中进行如下反应: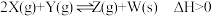 ,下列叙述正确的是
,下列叙述正确的是
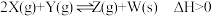 ,下列叙述正确的是
,下列叙述正确的是| A.在容器中加入氩气,反应物反应速率减小 |
| B.加入少量W,逆反应速率大 |
| C.升高温度,正反应速率增大,逆反应速率减小 |
| D.将容器的体积压缩,可增大活化分子的百分数,单位时间内有效碰撞次数增大 |
您最近一年使用:0次
单选题
|
容易
(0.94)
名校
【推荐1】下列影响化学反应速率的外界因素中,肯定能使化学反应速率加快的方法是( )
①升高温度;②增大压强;③增大反应物的物质的量;④将块状固体反应物磨成粉末
①升高温度;②增大压强;③增大反应物的物质的量;④将块状固体反应物磨成粉末
| A.①②③④ | B.①④ | C.①③④ | D.①②③ |
您最近一年使用:0次
单选题
|
容易
(0.94)
名校
解题方法
【推荐2】在密闭容器中发生反应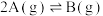 ,不同温度下,A的浓度与反应时间的关系如图所示,下列说法正确的是
,不同温度下,A的浓度与反应时间的关系如图所示,下列说法正确的是
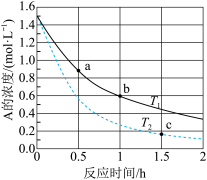
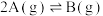 ,不同温度下,A的浓度与反应时间的关系如图所示,下列说法正确的是
,不同温度下,A的浓度与反应时间的关系如图所示,下列说法正确的是
A. | B.a点的正反应速率小于b点的正反应速率 |
| C.c点的正反应速率大于逆反应速率 | D.b点的正反应速率一定大于c点的正反应速率 |
您最近一年使用:0次
单选题
|
容易
(0.94)
【推荐1】下列有关活化分子与活化能的说法正确的是( )
| A.活化分子间所发生的碰撞均为有效碰撞 |
| B.活化分子的平均能量称为活化能 |
| C.增大压强可使活化分子数增多,反应速率加快 |
| D.升高温度可使活化分子百分数增加,反应速率加快 |
您最近一年使用:0次
单选题
|
容易
(0.94)
名校
解题方法
【推荐2】对于反应:H2(g)+I2(g) 2HI(g) ,下列措施能加快反应速率的是
2HI(g) ,下列措施能加快反应速率的是
 2HI(g) ,下列措施能加快反应速率的是
2HI(g) ,下列措施能加快反应速率的是| A.压缩体积 | B.减少H2(g)的量 |
| C.增大容器的体积 | D.降低温度 |
您最近一年使用:0次
单选题
|
容易
(0.94)
名校
解题方法
【推荐1】NO和CO都是汽车尾气中的有害物质,它们能缓慢起反应生成大气成分中的无毒物质,提高该反应化学反应速率最优的方法是
| A.使用催化剂 | B.改变压强 | C.提高反应温度 | D.调节反应物浓度 |
您最近一年使用:0次
单选题
|
容易
(0.94)
名校
解题方法
【推荐2】日常生活中的下列做法不是为了加快化学反应速率的是
| A.清洗水壶垢用较浓白醋 | B.将煤块粉碎后燃烧 |
| C.发馒头加酵母粉 | D.月饼盒内放置还原性铁粉 |
您最近一年使用:0次
单选题
|
容易
(0.94)
名校
【推荐3】为了说明影响化学反应快慢的因素,某同学分别设计了如下A~D四个实验,你认为结论不正确的是( )
| A.将大小、形状相同的镁条和铝条与相同浓度的盐酸反应时,两者速率一样大 |
| B.在相同条件下,等质量的大理石块和大理石粉与相同浓度的盐酸反应,大理石粉反应快 |
| C.将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解 |
| D.两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 |
您最近一年使用:0次



