联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。
(1) 25℃时,1molN2H4(l) 与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出612.5 kJ的热量。请写出该反应的热化学方程式________________
(2) 已知:2NO2(g) N2O4(g),N2O4为无色气体。
N2O4(g),N2O4为无色气体。
① 在上述条件下反应能够自发进行,则反应的ΔH______ 0(填写“>”、“<”、“=”)
② 一定温度下,在密闭容器中反应2NO2(g) N2O4(g)达到平衡,达到平衡状态的标志是
N2O4(g)达到平衡,达到平衡状态的标志是___________ (填字母)
A 单位时间内生成n mol N2O4的同时生成2 nmolNO2
B 用NO2、N2O4的物质的量浓度变化表示的反应速率之比为2:1的状态
C 混合气体的颜色不再改变的状态
D 混合气体的密度不再改变的状态
E 混合气体的平均相对分子质量不再改变的状态
③ 其他条件不变时,下列措施能提高NO2转化率的是___________ (填字母)
A 减小NO2的浓度 B 降低温度 C 增大压强 D 升高温度
(3) 17℃、1.01×105Pa,往10L密闭容器中充入NO2,达到平衡时,c(NO2)= 0.2 mol·L-1,c(N2O4)= 0.16 mol·L-1。该温度下该反应的平衡常数K为_________ 。
(1) 25℃时,1molN2H4(l) 与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出612.5 kJ的热量。请写出该反应的热化学方程式
(2) 已知:2NO2(g)
 N2O4(g),N2O4为无色气体。
N2O4(g),N2O4为无色气体。① 在上述条件下反应能够自发进行,则反应的ΔH
② 一定温度下,在密闭容器中反应2NO2(g)
 N2O4(g)达到平衡,达到平衡状态的标志是
N2O4(g)达到平衡,达到平衡状态的标志是A 单位时间内生成n mol N2O4的同时生成2 nmolNO2
B 用NO2、N2O4的物质的量浓度变化表示的反应速率之比为2:1的状态
C 混合气体的颜色不再改变的状态
D 混合气体的密度不再改变的状态
E 混合气体的平均相对分子质量不再改变的状态
③ 其他条件不变时,下列措施能提高NO2转化率的是
A 减小NO2的浓度 B 降低温度 C 增大压强 D 升高温度
(3) 17℃、1.01×105Pa,往10L密闭容器中充入NO2,达到平衡时,c(NO2)= 0.2 mol·L-1,c(N2O4)= 0.16 mol·L-1。该温度下该反应的平衡常数K为
更新时间:2020/10/31 23:30:40
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】氮及其化合物在工农业生产、生活中有着重要作用。完成下列填空:
合成氨工业中:N2(g) + 3H2(g) 2NH3(g) + Q(Q>0),其化学平衡常数K与温度t的关系如表:
2NH3(g) + Q(Q>0),其化学平衡常数K与温度t的关系如表:
(1)试比较K1、K2的大小,K1________ K2(填写“>”、“=”或“<”)
(2) 400℃时,反应2NH3(g) N2(g) + 3H2(g)的化学平衡常数的值为
N2(g) + 3H2(g)的化学平衡常数的值为_____________ 。
当测得NH3和N2、H2的物质的量浓度分别为3 mol/L和2 mol/L、1 mol/L时,则该反应υ(N2)(正)___________ υ(N2)(逆)(填写“>”、“=”或“<”)
(3)在密闭恒容的容器中,下列能作为合成氨反应达到平衡的依据的是____________ 。
a.υ(N2)(正)=3υ (H2)(逆) b.混合气体的密度保持不变
c.容器内压强保持不变 d.N2、H2、NH3的浓度之比为1∶3∶2
(4)化工生产为做到又“快”又“多”采用多种方法,试写出两项合成氨工业中为实现“多”所采取的措施:__________________________ ,__________________________ 。
(5)0.1 mol/L的(NH4)2SO4水溶液中各离子浓度由大到小的顺序是_____________________ ,在该溶液中加入少量明矾固体,溶液中NH4+的浓度_______ (填“增大”、“减小”或“不变”),其原因是_________________________________________________________ 。
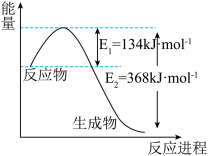
(6)如图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和 CO反应的热化学方程式_____________________________________________ 。
合成氨工业中:N2(g) + 3H2(g)
 2NH3(g) + Q(Q>0),其化学平衡常数K与温度t的关系如表:
2NH3(g) + Q(Q>0),其化学平衡常数K与温度t的关系如表:| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
(1)试比较K1、K2的大小,K1
(2) 400℃时,反应2NH3(g)
 N2(g) + 3H2(g)的化学平衡常数的值为
N2(g) + 3H2(g)的化学平衡常数的值为当测得NH3和N2、H2的物质的量浓度分别为3 mol/L和2 mol/L、1 mol/L时,则该反应υ(N2)(正)
(3)在密闭恒容的容器中,下列能作为合成氨反应达到平衡的依据的是
a.υ(N2)(正)=3υ (H2)(逆) b.混合气体的密度保持不变
c.容器内压强保持不变 d.N2、H2、NH3的浓度之比为1∶3∶2
(4)化工生产为做到又“快”又“多”采用多种方法,试写出两项合成氨工业中为实现“多”所采取的措施:
(5)0.1 mol/L的(NH4)2SO4水溶液中各离子浓度由大到小的顺序是

(6)如图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和 CO反应的热化学方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
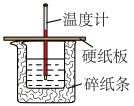
【推荐2】学习小组用50mL 0.50 mol/L NaOH溶液和30mL0.50 mol/L硫酸溶液进行中和热的测定。
(1)大小烧杯之间填满碎纸条的作用是_______ ,从实验装置上看,图中缺少的一种玻璃仪器_______ 。
(2)写出该反应用中和热表示的热化学方程式_______ [中和热测得为57.3kJ/mol。
(3)实验中若用60mL 0.25mol/L 溶液跟50mL 0.5 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量
溶液跟50mL 0.5 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量_______ (填“相等”、“不相等”),所求中和热_______ (填“相等”、“不相等”);若用50mL 0.50 mol/L醋酸代替 溶液进行上述实验,则反应热
溶液进行上述实验,则反应热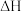 的绝对值
的绝对值_______ (填“偏大”、“偏小”、“不受影响)”。
(1)大小烧杯之间填满碎纸条的作用是

(2)写出该反应用中和热表示的热化学方程式
(3)实验中若用60mL 0.25mol/L
 溶液跟50mL 0.5 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量
溶液跟50mL 0.5 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量 溶液进行上述实验,则反应热
溶液进行上述实验,则反应热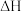 的绝对值
的绝对值
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】现在和将来的社会,对能源和材料的需求是越来越大,我们学习化学就为了认识物质,创造物质,开发新能源,发展人类的新未来。请解决以下有关能源的问题:
(1)未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是:_____ 。
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
(2)运动会上使用的火炬的燃料一般是丙烷(C3H8),请根据完成下列题目。
①已知11g丙烷(C3H8)在298K和101Kpa条件下完全燃烧生成CO2和液态水时放出的热量为555kJ,请写出丙烷燃烧热的热化学方程式:_____ 。
②丙烷在一定条件下发生脱氢反应可以得到丙烯。
已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g) △H1=+156.6kJ•mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g) △H2=+32.4kJ•mol-1
则相同条件下,反应C3H8(g)→CH3CH=CH2(g)+H2(g)的△H=_____ 。
(3)已知:H-H键的键能为436 kJ•mol-1,H-N键的键能为391 kJ•mol-1,根据化学方程式:N2+3H2 2NH3 △H2=-92.4kJ•mol-1。
2NH3 △H2=-92.4kJ•mol-1。
①请计算出N≡N键的键能为_____ 。
②若向处于上述热化学方程式相同温度和体积一定的容器中,通入1molN2和3molH2,充分反应后,恢复原温度时放出的热量_____ 92.4kJ(填大于或小于或等于)。
(1)未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是:
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
(2)运动会上使用的火炬的燃料一般是丙烷(C3H8),请根据完成下列题目。
①已知11g丙烷(C3H8)在298K和101Kpa条件下完全燃烧生成CO2和液态水时放出的热量为555kJ,请写出丙烷燃烧热的热化学方程式:
②丙烷在一定条件下发生脱氢反应可以得到丙烯。
已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g) △H1=+156.6kJ•mol-1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g) △H2=+32.4kJ•mol-1
则相同条件下,反应C3H8(g)→CH3CH=CH2(g)+H2(g)的△H=
(3)已知:H-H键的键能为436 kJ•mol-1,H-N键的键能为391 kJ•mol-1,根据化学方程式:N2+3H2
 2NH3 △H2=-92.4kJ•mol-1。
2NH3 △H2=-92.4kJ•mol-1。①请计算出N≡N键的键能为
②若向处于上述热化学方程式相同温度和体积一定的容器中,通入1molN2和3molH2,充分反应后,恢复原温度时放出的热量
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】I.“嫦娥”五号预计在海南文昌发射中心发射,火箭的第一、二级发动机中,所用的燃料为偏二甲肼和四氧化二氮,偏二甲肼可用肼来制备。用肼(N2H4)作燃料,四氧化二氮作氧化剂,二者反应生成氮气和气态水。已知:
①N2(g)+2O2(g)=N2O4(g) ΔH=+10.7 kJ·mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
(1)写出气态肼和N2O4反应的热化学方程式:_______ 。
II.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
回答下列问题:
(2)该反应的化学平衡常数表达式为K=_______ 。
(3)该反应为_______ 反应(填“吸热”或“放热”)。
(4)某温度下,各物质的平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为_______ 。
(5)若830 ℃时,向容器中充入1 mol CO、5 mol H2O,反应达到平衡后,其化学平衡常数K_______ 1.0(填“大于”“小于”或“等于”)。
(6)830 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡_______ 移动(填“向正反应方向”“向逆反应方向”或“不”)。
①N2(g)+2O2(g)=N2O4(g) ΔH=+10.7 kJ·mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
(1)写出气态肼和N2O4反应的热化学方程式:
II.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(2)该反应的化学平衡常数表达式为K=
(3)该反应为
(4)某温度下,各物质的平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为
(5)若830 ℃时,向容器中充入1 mol CO、5 mol H2O,反应达到平衡后,其化学平衡常数K
(6)830 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】针对氮氧化物的研究是当前的重大课题。
(1)用活性炭可还原NO2防止空气污染。其反应原理为2C(s)+2NO2(g)=N2(g)+2CO2(g)。一定温度下,向2L恒容密闭容器中加入足量的C(s)+和0.200molNO2,如图表示体系中物质浓度变化曲线,请回答下列问题:
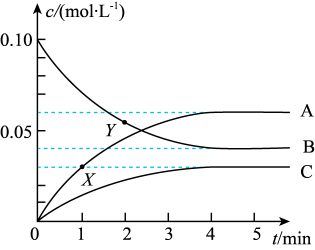
①体系中有四种物质,而图中只有三种物质的浓度变化曲线,能否在图中描述第四种物质的浓度变化曲线?_____ (填“能”或“否”);图中曲线C表示的是体系中_____ 的浓度变化。
②X点的v(正)_____ Y点v(正)(填“>”“<”或“=”);用CO2表示从0~4min内该反应的平均速率v=_____ mol•L-1•min-1。
(2)一定温度下,在容积为1.0L的恒容密闭容器中放入0.10molPCl5(g),在一定温度下进行反应:PCl5(g) PCl3(g)+Cl2(g),该反应为吸热反应,反应时间(t)与容器内气体总压强(p)的数据见表:
PCl3(g)+Cl2(g),该反应为吸热反应,反应时间(t)与容器内气体总压强(p)的数据见表:
①上述反应体系16~20min内是否达到化学平衡______ (填“是”或“否”)。
②下列可以说明该反应达到化学平衡的是______ (填字母)。
A.c(PCl5):c(PCl3):c(Cl2)=1:1:1
B.v(PCl5)=v(PCl3)
C.容器内气体的颜色不再变化
D.混合气体的密度不再变化
E.该容器内的压强不再变化
F.每生成3molP-Cl键的同时生成1molCl-Cl键
③结合上述转化的化学方程式,说明在恒温恒容条件下反应体系压强增大的原因:_____ 。
④平衡时,气体的总物质的量为_____ mol(保留三位有效数字)。
(1)用活性炭可还原NO2防止空气污染。其反应原理为2C(s)+2NO2(g)=N2(g)+2CO2(g)。一定温度下,向2L恒容密闭容器中加入足量的C(s)+和0.200molNO2,如图表示体系中物质浓度变化曲线,请回答下列问题:

①体系中有四种物质,而图中只有三种物质的浓度变化曲线,能否在图中描述第四种物质的浓度变化曲线?
②X点的v(正)
(2)一定温度下,在容积为1.0L的恒容密闭容器中放入0.10molPCl5(g),在一定温度下进行反应:PCl5(g)
 PCl3(g)+Cl2(g),该反应为吸热反应,反应时间(t)与容器内气体总压强(p)的数据见表:
PCl3(g)+Cl2(g),该反应为吸热反应,反应时间(t)与容器内气体总压强(p)的数据见表:| t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
②下列可以说明该反应达到化学平衡的是
A.c(PCl5):c(PCl3):c(Cl2)=1:1:1
B.v(PCl5)=v(PCl3)
C.容器内气体的颜色不再变化
D.混合气体的密度不再变化
E.该容器内的压强不再变化
F.每生成3molP-Cl键的同时生成1molCl-Cl键
③结合上述转化的化学方程式,说明在恒温恒容条件下反应体系压强增大的原因:
④平衡时,气体的总物质的量为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】H2S的转化是资源利用和环境保护的重要研究课题。
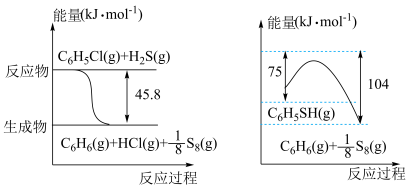
(1)苯硫酚(C6H5SH)是一种重要的有机合成中间体,工业上常用氯苯(C6H5Cl)和硫化氢(H2S)来制备苯硫酚。已知下列两个反应的能量关系如图所示,则C6H5Cl与H2S反应生成C6H5SH的热化学方程式为_______ 。
(2) 与
与 在高温下反应制得的㛶基硫(COS)可用于合成除草剂。在
在高温下反应制得的㛶基硫(COS)可用于合成除草剂。在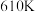 时,将
时,将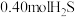 与
与 充入2.5L的空钢㼛中,发生反应:
充入2.5L的空钢㼛中,发生反应: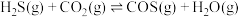
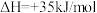 ,反应达平衡后水蒸气的物质的量分数为0.02。
,反应达平衡后水蒸气的物质的量分数为0.02。
①在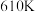 时,反应经
时,反应经 达到平衡,则
达到平衡,则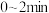 的平均反应速率
的平均反应速率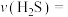
_______ 。
②实验测得上述反应的速率方程为: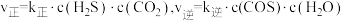 ,k正、k逆分别为正、逆反应速率常数,速率常数随温度升高而增大。则达到平衡后,仅升高温度,k正增大的倍数
,k正、k逆分别为正、逆反应速率常数,速率常数随温度升高而增大。则达到平衡后,仅升高温度,k正增大的倍数_______ (填“>”“<”或“=”)k逆增大的倍数。
③该条件下,容器中反应达到化学平衡状态的依据是_______ (填字母)。
A.容器内混合气体密度不再变化 B.
C.容器内的压强不再变化 D. 与
与 的质量之比不变
的质量之比不变
(3)工业上可以通过硫化氢分解制得 和硫䒱气。在密闭容器中充入一定量
和硫䒱气。在密闭容器中充入一定量 ,反应原理:
,反应原理: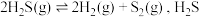 气体的平衡转化率与温度、压强的关系如图所示。
气体的平衡转化率与温度、压强的关系如图所示。
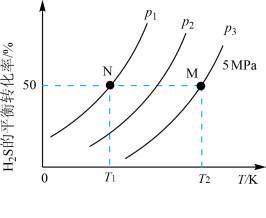
①图中压强(p1、p2、p3)由大到小的顺序为_______ ,理由是_______ 。
②如果要进一步提高H2S的平衡转化率,除改变温度、压强外,还可以采取的措施有_______ 。
(1)苯硫酚(C6H5SH)是一种重要的有机合成中间体,工业上常用氯苯(C6H5Cl)和硫化氢(H2S)来制备苯硫酚。已知下列两个反应的能量关系如图所示,则C6H5Cl与H2S反应生成C6H5SH的热化学方程式为

(2)
 与
与 在高温下反应制得的㛶基硫(COS)可用于合成除草剂。在
在高温下反应制得的㛶基硫(COS)可用于合成除草剂。在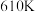 时,将
时,将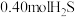 与
与 充入2.5L的空钢㼛中,发生反应:
充入2.5L的空钢㼛中,发生反应: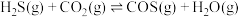
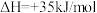 ,反应达平衡后水蒸气的物质的量分数为0.02。
,反应达平衡后水蒸气的物质的量分数为0.02。①在
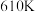 时,反应经
时,反应经 达到平衡,则
达到平衡,则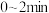 的平均反应速率
的平均反应速率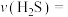
②实验测得上述反应的速率方程为:
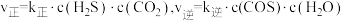 ,k正、k逆分别为正、逆反应速率常数,速率常数随温度升高而增大。则达到平衡后,仅升高温度,k正增大的倍数
,k正、k逆分别为正、逆反应速率常数,速率常数随温度升高而增大。则达到平衡后,仅升高温度,k正增大的倍数③该条件下,容器中反应达到化学平衡状态的依据是
A.容器内混合气体密度不再变化 B.

C.容器内的压强不再变化 D.
 与
与 的质量之比不变
的质量之比不变(3)工业上可以通过硫化氢分解制得
 和硫䒱气。在密闭容器中充入一定量
和硫䒱气。在密闭容器中充入一定量 ,反应原理:
,反应原理: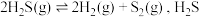 气体的平衡转化率与温度、压强的关系如图所示。
气体的平衡转化率与温度、压强的关系如图所示。
①图中压强(p1、p2、p3)由大到小的顺序为
②如果要进一步提高H2S的平衡转化率,除改变温度、压强外,还可以采取的措施有
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】甲烷水蒸气重整制取的合成气可用于熔融碳酸盐燃料电池。
I.制取合成气的反应为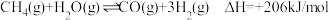 。向体积为2L密闭容器中,按
。向体积为2L密闭容器中,按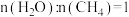 投料:
投料:
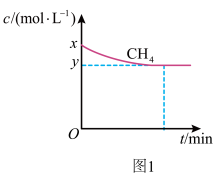
a.保持温度为 时,测得
时,测得 的浓度随时间变化曲线如图1所示。
的浓度随时间变化曲线如图1所示。
b.其他条件相同时,在不同催化剂(I、Ⅱ、Ⅲ)作用下,反应相同时间 后, 的转化率随反应温度的变化如图2所示。
的转化率随反应温度的变化如图2所示。

(1)结合图1,写出反应达平衡的过程中的能量变化:___________  。
。
(2)在图1中画出:起始条件相同,保持温度为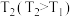 时,
时, 随时间的变化曲线。
随时间的变化曲线。__________
(3)根据图2判断,a点所处的状态不是化学平衡状态,理由是___________ 。
(4)根据图2判断, 的转化率:c>b,原因是
的转化率:c>b,原因是___________ 。
Ⅱ.熔融碳酸盐燃料电池的结构示意图如下。
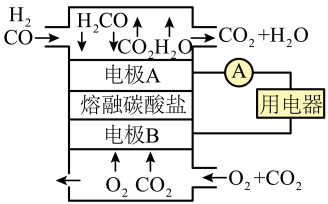
(5)电池工作时,熔融碳酸盐中 移向
移向___________ (填“电极A”或“电极B”)
(6)写出正极上的电极反应:___________ 。
I.制取合成气的反应为
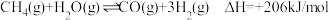 。向体积为2L密闭容器中,按
。向体积为2L密闭容器中,按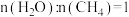 投料:
投料:a.保持温度为
 时,测得
时,测得 的浓度随时间变化曲线如图1所示。
的浓度随时间变化曲线如图1所示。
b.其他条件相同时,在不同催化剂(I、Ⅱ、Ⅲ)作用下,
 的转化率随反应温度的变化如图2所示。
的转化率随反应温度的变化如图2所示。
(1)结合图1,写出反应达平衡的过程中的能量变化:
 。
。(2)在图1中画出:起始条件相同,保持温度为
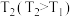 时,
时, 随时间的变化曲线。
随时间的变化曲线。(3)根据图2判断,a点所处的状态不是化学平衡状态,理由是
(4)根据图2判断,
 的转化率:c>b,原因是
的转化率:c>b,原因是Ⅱ.熔融碳酸盐燃料电池的结构示意图如下。

(5)电池工作时,熔融碳酸盐中
 移向
移向(6)写出正极上的电极反应:
您最近一年使用:0次
【推荐2】二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气相似,被誉为“21世纪的清洁燃料”。制备原理如下:
(I)由天然气催化制备二甲醚:①2CH4(g)+O2(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)  H1
H1
(II)由合成气制备二甲醚:
②CO(g)+2H2(g) CH3OH(g)
CH3OH(g)  H2
H2
③2CH3OH(g)=CH3OCH3(g)+H2O(g) H3
H3
回答下列问题:
(1)若甲醇与二甲醚的燃烧热分别是 H=-760.5kJ·mol-1和
H=-760.5kJ·mol-1和 H=-1453.0kJ·mol-1;1mol液态水变为气态水要吸收44.0kJ的热量。则
H=-1453.0kJ·mol-1;1mol液态水变为气态水要吸收44.0kJ的热量。则 H3=
H3=___ kJ·mol-1。
(2)一定温度下,在容积固定的密闭容器中按I制备二甲醚,下列情况能说明反应①达到平衡状态的是______ (填序号)。
A.混合气体的密度保持不变
B.CH4与O2的物质的量之比保持不变
C.混合气体的平均相对分子质量保持不变
D.CH4的生成速率等于CH3OCH3消耗速率的2倍
(3)在恒容密闭容器中按原理(I)制备二甲醚,若起始时c(CH4)=0.20mol·L-1,c(O2)=0.10mol·L-1,平衡时CH4的平衡转化率为50%,则平衡时CH3OCH3的体积分数为_____ 。
(4)工业上按原理(II)制备二甲醚时,反应②合成甲醇时常以Cu2O作催化剂。研究表明,反应体系中少量CO2有利于维持催化剂Cu2O的量不变,请结合平衡移动原理分析其原因是_______ (写出相关的化学方程式并辅以必要的文字说明)。
(5)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,阳极及其溶液中有关转化如下图所示。溶液中III、IV二步总反应的离子方程式为_______ 。

(6)有人模拟工业上按原理(II)制备二甲醚,在1000K时的2L密闭容器中充入2molCO和6molH2,此时体系总压强是3.2×105kPa。达到平衡时c(H2)=1.4mol·L-1,c(CH3OCH3)=0.3mol·L-1,则用平衡分压表示反应③的平衡常数Kp=____ (分压=总压×物质的量分数)。
(I)由天然气催化制备二甲醚:①2CH4(g)+O2(g)
 CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)  H1
H1(II)由合成气制备二甲醚:
②CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)  H2
H2③2CH3OH(g)=CH3OCH3(g)+H2O(g)
 H3
H3回答下列问题:
(1)若甲醇与二甲醚的燃烧热分别是
 H=-760.5kJ·mol-1和
H=-760.5kJ·mol-1和 H=-1453.0kJ·mol-1;1mol液态水变为气态水要吸收44.0kJ的热量。则
H=-1453.0kJ·mol-1;1mol液态水变为气态水要吸收44.0kJ的热量。则 H3=
H3=(2)一定温度下,在容积固定的密闭容器中按I制备二甲醚,下列情况能说明反应①达到平衡状态的是
A.混合气体的密度保持不变
B.CH4与O2的物质的量之比保持不变
C.混合气体的平均相对分子质量保持不变
D.CH4的生成速率等于CH3OCH3消耗速率的2倍
(3)在恒容密闭容器中按原理(I)制备二甲醚,若起始时c(CH4)=0.20mol·L-1,c(O2)=0.10mol·L-1,平衡时CH4的平衡转化率为50%,则平衡时CH3OCH3的体积分数为
(4)工业上按原理(II)制备二甲醚时,反应②合成甲醇时常以Cu2O作催化剂。研究表明,反应体系中少量CO2有利于维持催化剂Cu2O的量不变,请结合平衡移动原理分析其原因是
(5)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,阳极及其溶液中有关转化如下图所示。溶液中III、IV二步总反应的离子方程式为

(6)有人模拟工业上按原理(II)制备二甲醚,在1000K时的2L密闭容器中充入2molCO和6molH2,此时体系总压强是3.2×105kPa。达到平衡时c(H2)=1.4mol·L-1,c(CH3OCH3)=0.3mol·L-1,则用平衡分压表示反应③的平衡常数Kp=
您最近一年使用:0次
【推荐3】氨是重要的基础化工原料,以 与
与 为原料可以合成尿素
为原料可以合成尿素 。已知
。已知
反应Ⅰ:

 ;
;
反应Ⅱ: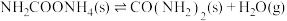

 。
。
回答下列问题:
(1)对于反应Ⅲ: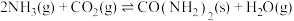

 ;
;
_____ (用含 、
、 的代数式表示),
的代数式表示),
_____ (用含 、
、 的代数式表示)。
的代数式表示)。
(2) 时,向容积为
时,向容积为 的恒容密闭容器中充入
的恒容密闭容器中充入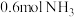 和
和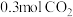 ,仅发生反应Ⅲ,容器内的压强随时间t的变化如图所示,
,仅发生反应Ⅲ,容器内的压强随时间t的变化如图所示,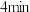 时,反应达到平衡:
时,反应达到平衡: 内,
内,
_____  。
。
② 的平衡转化率为
的平衡转化率为_____ (保留3位有效数字)。
③该反应的平衡常数
_____ (用含 的代数式表示,分压
的代数式表示,分压 总压
总压 物质的量分数)。
物质的量分数)。
④反应达到平衡后,若再充入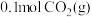 和
和 ,此时
,此时 (正)
(正)_____ (填“ ”“
”“ ”或“
”或“ ”)
”) (逆)。
(逆)。
(3)查阅资料可知: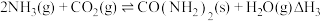 中的
中的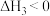 。
。 随温度变化关系的曲线为
随温度变化关系的曲线为_____ (填标号),判断的理由为_____ 。
② ,某恒容密闭容器中,发生反应
,某恒容密闭容器中,发生反应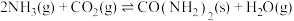 ,下列说法正确的是
,下列说法正确的是_____ (填标号)。
A.若混合气体的质量不再随时间变化而改变,则该反应达到平衡
B.若 的质量不再随时间变化而改变,则该反应达到平衡
的质量不再随时间变化而改变,则该反应达到平衡
C.每断裂 键,同时生成
键,同时生成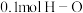 键
键
D.每消耗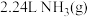 ,同时生成
,同时生成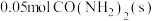
 与
与 为原料可以合成尿素
为原料可以合成尿素 。已知
。已知反应Ⅰ:


 ;
;反应Ⅱ:
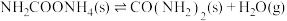

 。
。回答下列问题:
(1)对于反应Ⅲ:
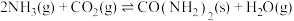

 ;
;
 、
、 的代数式表示),
的代数式表示),
 、
、 的代数式表示)。
的代数式表示)。(2)
 时,向容积为
时,向容积为 的恒容密闭容器中充入
的恒容密闭容器中充入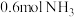 和
和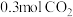 ,仅发生反应Ⅲ,容器内的压强随时间t的变化如图所示,
,仅发生反应Ⅲ,容器内的压强随时间t的变化如图所示, 时,反应达到平衡:
时,反应达到平衡: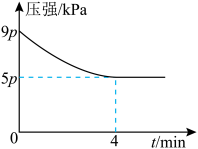
 内,
内,
 。
。②
 的平衡转化率为
的平衡转化率为③该反应的平衡常数

 的代数式表示,分压
的代数式表示,分压 总压
总压 物质的量分数)。
物质的量分数)。④反应达到平衡后,若再充入
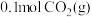 和
和 ,此时
,此时 (正)
(正) ”“
”“ ”或“
”或“ ”)
”) (逆)。
(逆)。(3)查阅资料可知:
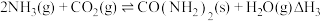 中的
中的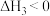 。
。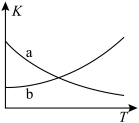
 随温度变化关系的曲线为
随温度变化关系的曲线为②
 ,某恒容密闭容器中,发生反应
,某恒容密闭容器中,发生反应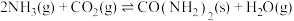 ,下列说法正确的是
,下列说法正确的是A.若混合气体的质量不再随时间变化而改变,则该反应达到平衡
B.若
 的质量不再随时间变化而改变,则该反应达到平衡
的质量不再随时间变化而改变,则该反应达到平衡C.每断裂
 键,同时生成
键,同时生成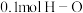 键
键D.每消耗
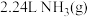 ,同时生成
,同时生成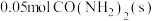
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】氨是一种重要的化工产品,也是一种重要的化工原料。氨的合成在化工生产中具有重要的意义。
(1)某温度下,在容积均为2 L的甲、乙两个密闭容器中分别发生反应:
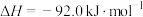 。相关数据如下:
。相关数据如下:
①下列情况能说明该反应一定达到平衡状态的是______ (填字母)。
A. B.容器内混合气体的平均相对分子量不变
B.容器内混合气体的平均相对分子量不变
C.容器内混合气体密度保持不变 D. 和
和 的浓度之比不再随时间改变
的浓度之比不再随时间改变
②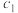
______ 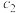 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③该反应的平衡常数
______ (只列算式不计算)。
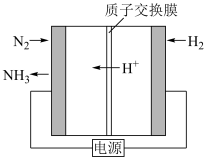
(2)合成氨也可以采用电化学法,其原理如图所示,则阳极的电极反应式是___________ 。
(3)已知:氨在某催化剂催化氧化过程中主要有以下两个竞争反应:
反应I: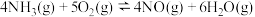

反应Ⅱ: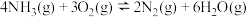
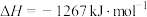
①该条件下, 和
和 反应生成NO的热化学方程式为
反应生成NO的热化学方程式为___________ 。
②为分析催化剂对反应的选择性,在1 L密闭容器中充入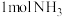 和
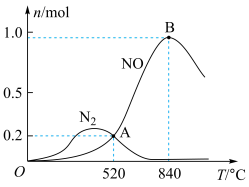
和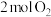 ,在一定时间内测得有关物质的物质的量随温度变化如图所示。该催化剂在较低温度时主要选择
,在一定时间内测得有关物质的物质的量随温度变化如图所示。该催化剂在较低温度时主要选择___________ (填“反应I”或“反应Ⅱ”)。当温度高于840℃时,反应I中NO的物质的量减少的原因可能是___________ ,520℃时,A点 的转化率为
的转化率为___________ 。
(1)某温度下,在容积均为2 L的甲、乙两个密闭容器中分别发生反应:

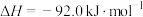 。相关数据如下:
。相关数据如下:| 容器 | 甲 | 乙 |
| 反应物投入量 | 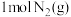 和 和 |  |
平衡时 | 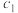 | 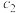 |
| 平衡时能量变化 | 放出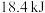 | 吸收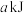 |
A.
 B.容器内混合气体的平均相对分子量不变
B.容器内混合气体的平均相对分子量不变C.容器内混合气体密度保持不变 D.
 和
和 的浓度之比不再随时间改变
的浓度之比不再随时间改变②
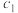
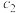 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③该反应的平衡常数

(2)合成氨也可以采用电化学法,其原理如图所示,则阳极的电极反应式是

(3)已知:氨在某催化剂催化氧化过程中主要有以下两个竞争反应:
反应I:
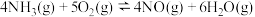

反应Ⅱ:
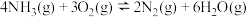
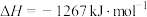
①该条件下,
 和
和 反应生成NO的热化学方程式为
反应生成NO的热化学方程式为②为分析催化剂对反应的选择性,在1 L密闭容器中充入
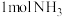 和
和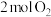 ,在一定时间内测得有关物质的物质的量随温度变化如图所示。该催化剂在较低温度时主要选择
,在一定时间内测得有关物质的物质的量随温度变化如图所示。该催化剂在较低温度时主要选择 的转化率为
的转化率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】“节能减排”和“低碳经济”的一项重要课题就是如何将 转化为可利用的资源。
转化为可利用的资源。
Ⅰ.目前工业上有一种方法是用 来生产燃料甲醇。
来生产燃料甲醇。
已知: 的燃烧热
的燃烧热 kJ⋅mol
kJ⋅mol 、
、 的燃烧热
的燃烧热 kJ⋅mol
kJ⋅mol
反应①:
 kJ⋅mol
kJ⋅mol
反应②:
 kJ⋅mol
kJ⋅mol
反应③:

(1)


(2)恒温条件下,在某恒容密闭容器中;按照
 投料发生反应③,测得
投料发生反应③,测得 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。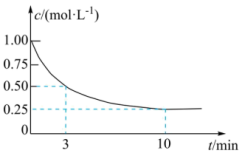
①从反应开始到3 min, 的平均反应速率
的平均反应速率
 ⋅min
⋅min ;试在图中绘制出
;试在图中绘制出 的浓度随时间变化的图像
的浓度随时间变化的图像
②该反应的平衡常数
(3)恒温条件下,在某恒压密闭容器中仅发生反应①,当反应达到平衡后,
Ⅰ.降低温度,CO的平衡转化率
Ⅱ.向平衡体系中通入惰性气体,平衡
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】二甲醚(CH3OCH3)是清洁的燃料和重要的化工原料,具有广泛的应用前景。回答下列问题:
(1)工业上用甲醇制备二甲醚(2CH3OH→CH3OCH3+H2O)分为液相脱水法(已被逐步淘汰)和气相脱水法。液相脱水法是甲醇在浓硫酸作用下加热脱水,该法在实际生产中的主要缺点是_______ 。
(2)我国某科研团队通过计算机模拟技术提出在12-磷钨酸(固体强酸)催化作用下甲醇气相脱水合成二甲醚的反应机理:
CH3OH+H+→IM1(中间体1)→TS1(过渡态1)→IM3(中间体3)→CH +H2O,
+H2O,
CH +CH3OH→+IM2(中间体2)→TS2(过渡态2)→IM4(中间体4)→CH3OCH3+H+
+CH3OH→+IM2(中间体2)→TS2(过渡态2)→IM4(中间体4)→CH3OCH3+H+
反应过程和相对能量E(kJ•mol-1)如图所示。

①该反应机理中的最大能垒(活化能)E正=_______ kJ·mol-1;2CH3OH(g) CH3OCH3(g)+H2O(g)ΔH=
CH3OCH3(g)+H2O(g)ΔH=_______ 。
②IM1为CH2=OH++H2,CH3OH+H+→IM1是一个无垒(活化能为0)过程,可推测该过程_______ (填标号)。
A.从断键开始B.从成键开始C.断键时吸收的能量更多D.成键时释放的能量更多
类似地,IM2为CH2=OH++_______ 。
(3)一定条件下,密闭容器中充入甲醇发生气相脱水反应:2CH3OH(g) CH3OCH3(g)+H2O(g),甲醇的平衡转化率α与平衡常数的关系式为K=
CH3OCH3(g)+H2O(g),甲醇的平衡转化率α与平衡常数的关系式为K=_______ (填含α的代数式);若要进一步提高甲醇的平衡转化率但不改变平衡常数值,可以采取的措施有_______ (答出一条)。
(1)工业上用甲醇制备二甲醚(2CH3OH→CH3OCH3+H2O)分为液相脱水法(已被逐步淘汰)和气相脱水法。液相脱水法是甲醇在浓硫酸作用下加热脱水,该法在实际生产中的主要缺点是
(2)我国某科研团队通过计算机模拟技术提出在12-磷钨酸(固体强酸)催化作用下甲醇气相脱水合成二甲醚的反应机理:
CH3OH+H+→IM1(中间体1)→TS1(过渡态1)→IM3(中间体3)→CH
 +H2O,
+H2O,CH
 +CH3OH→+IM2(中间体2)→TS2(过渡态2)→IM4(中间体4)→CH3OCH3+H+
+CH3OH→+IM2(中间体2)→TS2(过渡态2)→IM4(中间体4)→CH3OCH3+H+反应过程和相对能量E(kJ•mol-1)如图所示。

①该反应机理中的最大能垒(活化能)E正=
 CH3OCH3(g)+H2O(g)ΔH=
CH3OCH3(g)+H2O(g)ΔH=②IM1为CH2=OH++H2,CH3OH+H+→IM1是一个无垒(活化能为0)过程,可推测该过程
A.从断键开始B.从成键开始C.断键时吸收的能量更多D.成键时释放的能量更多
类似地,IM2为CH2=OH++
(3)一定条件下,密闭容器中充入甲醇发生气相脱水反应:2CH3OH(g)
 CH3OCH3(g)+H2O(g),甲醇的平衡转化率α与平衡常数的关系式为K=
CH3OCH3(g)+H2O(g),甲醇的平衡转化率α与平衡常数的关系式为K=
您最近一年使用:0次



