某浓度的HF溶液中存在平衡:HF H++F-,若要增大F-的浓度,同时减小H+的浓度,可以采取的方法是( )
H++F-,若要增大F-的浓度,同时减小H+的浓度,可以采取的方法是( )
 H++F-,若要增大F-的浓度,同时减小H+的浓度,可以采取的方法是( )
H++F-,若要增大F-的浓度,同时减小H+的浓度,可以采取的方法是( )| A.加入少量NaOH固体 | B.适当降低温度 |
| C.加入少量的浓盐酸 | D.加水稀释 |
更新时间:2020-11-10 18:33:48
|
相似题推荐
单选题
|
较易
(0.85)
【推荐1】稀氨水中存在平衡: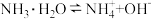 ,现改变条件①加水稀释、②适当升高温度(无NH3逸出),再次达到平衡时,
,现改变条件①加水稀释、②适当升高温度(无NH3逸出),再次达到平衡时, 的值分别会
的值分别会
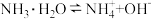 ,现改变条件①加水稀释、②适当升高温度(无NH3逸出),再次达到平衡时,
,现改变条件①加水稀释、②适当升高温度(无NH3逸出),再次达到平衡时, 的值分别会
的值分别会| A.①增大、②增大 | B.①增大、②减小 | C.①减小、②增大 | D.①减小、②减小 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】将浓度为0.05mol/L的HClO的溶液加水不断稀释,下列各量始终保持增大的是
A. | B.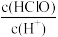 | C.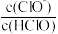 | D.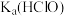 |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐1】石蕊是一种有机弱酸,石蕊分子(HZ)及其酸根离子(Z-)在水溶液中呈现不同的颜色。则Z-的颜色是
| A.蓝色 | B.紫色 | C.红色 | D.由溶液酸碱性确定 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】已知:亚硝酸( )是一种弱酸,亚硝酸钠(
)是一种弱酸,亚硝酸钠( )是一种常用的食品防腐剂。常温下,将0.1mol⋅L-1
)是一种常用的食品防腐剂。常温下,将0.1mol⋅L-1 溶液加水稀释或加入少量
溶液加水稀释或加入少量 晶体时,下列观点正确的是
晶体时,下列观点正确的是
 )是一种弱酸,亚硝酸钠(
)是一种弱酸,亚硝酸钠( )是一种常用的食品防腐剂。常温下,将0.1mol⋅L-1
)是一种常用的食品防腐剂。常温下,将0.1mol⋅L-1 溶液加水稀释或加入少量
溶液加水稀释或加入少量 晶体时,下列观点正确的是
晶体时,下列观点正确的是A.加水稀释时,电离平衡正向移动,溶液中 增大 增大 |
B.加 晶体时,电离平衡逆向移动,溶液导电能力增强 晶体时,电离平衡逆向移动,溶液导电能力增强 |
C.加水稀释时, 的电离程度增大,电离常数也增大 的电离程度增大,电离常数也增大 |
D.加 晶体时,溶液的pH增大,与 晶体时,溶液的pH增大,与 增大有关 增大有关 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐1】已知0.1 mol/L的醋酸溶液中存在电离平衡: CH3COOH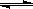 CH3COO-+H+ 要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是。
CH3COO-+H+ 要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是。
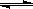 CH3COO-+H+ 要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是。
CH3COO-+H+ 要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是。| A.加少量CH3COONH4固体 | B.降低温度 | C.加少量NaOH固体 | D.加水稀释 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】在0.1mol·L-1的CH3COOH溶液中,要促进醋酸电离且使H+浓度增大,应采取的措施是( )
| A.升温 | B.加水 | C.加入NaOH溶液 | D.加入稀盐酸 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】H2S水溶液中存在电离平衡H2S⇌H++HS-和HS-⇌H++S2-,若向H2S溶液中
| A.通入过量SO2气体,溶液pH增大 |
| B.加水,平衡向右移动,溶液中氢离子浓度增大 |
| C.滴加新制氯水,溶液pH减小 |
| D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】在0.1mol•L﹣1NH3•H2O溶液中存在如下电离平衡:NH3•H2O⇌NH4++OH﹣.对于该平衡,下列叙述中正确的是( )
A.加入水时,溶液中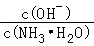 增大 增大 |
| B.加入少量NaOH固体,平衡向逆反应方向移动,电离平衡常数减小 |
| C.加入少量0.1 mol•L﹣1HCl溶液,溶液中c(OH﹣)增大 |
| D.降低温度,溶液中c(NH4+)增大 |
您最近一年使用:0次

 溶液,水的电离程度相同
溶液,水的电离程度相同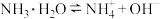 ,若要使平衡逆向移动,同时使
,若要使平衡逆向移动,同时使 增大,应加入的物质或采取的措施正确的是
增大,应加入的物质或采取的措施正确的是 固体
固体 固体
固体 稀溶液进行下列操作,一定可使
稀溶液进行下列操作,一定可使 增大的是
增大的是




