CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式分别为
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ•mol-1,
②2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ•mol-1
③C(s)+O2(g)=CO2(g) △H=-393.5kJ•mol-1
(1)在深海中存在一种甲烷细菌,它们依靠甲烷与O2在酶的催化作用下产生的能量存活,在甲烷细菌使1mol甲烷转化为CO2气体与液态水的过程中,放出的能量___ (填“>”“<”或“=”)890.3kJ。
(2)甲烷与CO2可用于生产合成气(主要成分是一氧化碳和氢气):CH4(g)+CO2(g)=2CO(g)+2H2(g),1gCH4完全反应可释放15.46kJ的热量。则:
①如图能表示该反应过程的能量变化的是____ (填序号)。
A.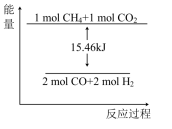 B.
B.  C.
C. 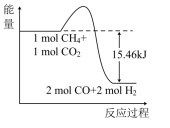 D.
D.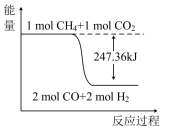
②若将物质的量均为1mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随着时间的变化曲线如图所示,则CH4的转化率为___ 。

(3)C(s)与H2(g)很难发生反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)=CH4(g)的反应热△H=____ 。
(4)目前对题干所述的三种物质的研究是燃料研究的重点,下列关于这三种物质的研究方向中可行的是____ (填序号)。
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B.寻找优质催化剂,在常温常压下使CO2分解生成碳与O2
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4反应生产合成气(CO、H2)
D.用固态碳合成C60,以C60作为燃料
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ•mol-1,
②2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ•mol-1
③C(s)+O2(g)=CO2(g) △H=-393.5kJ•mol-1
(1)在深海中存在一种甲烷细菌,它们依靠甲烷与O2在酶的催化作用下产生的能量存活,在甲烷细菌使1mol甲烷转化为CO2气体与液态水的过程中,放出的能量
(2)甲烷与CO2可用于生产合成气(主要成分是一氧化碳和氢气):CH4(g)+CO2(g)=2CO(g)+2H2(g),1gCH4完全反应可释放15.46kJ的热量。则:
①如图能表示该反应过程的能量变化的是
A.
 B.
B.  C.
C.  D.
D.
②若将物质的量均为1mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随着时间的变化曲线如图所示,则CH4的转化率为

(3)C(s)与H2(g)很难发生反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)=CH4(g)的反应热△H=
(4)目前对题干所述的三种物质的研究是燃料研究的重点,下列关于这三种物质的研究方向中可行的是
A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量
B.寻找优质催化剂,在常温常压下使CO2分解生成碳与O2
C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4反应生产合成气(CO、H2)
D.用固态碳合成C60,以C60作为燃料
16-17高二上·河北张家口·阶段练习 查看更多[11]
广西浦北中学2021-2022学年高二上学期第一次月考化学试题选择性必修1(SJ)专题1第一单元易错疑难集训(二)(已下线)练习2 盖斯定律与化学反应热的计算-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)江苏省南通西藏民族中学2020-2021学年高二上学期期中考试化学(选修)试题人教版(2019)高二化学选择性必修1第一章 化学反应的热效应 过模拟 2年模拟精编精练【全国百强校】福建省三明市第一中学2018-2019学年高二(理)上学期期中考试化学试题湖南省儋州一中2018-2019学年高二上学期第一次月考化学试题【校级联考】江西省南昌市八一中学、洪都中学2018-2019学年高二上学期10月联考化学试题重庆市南开中学2018-2019学年高二上学期第一次月考化学试题2016-2017学年天津市静海一中高二上9月调研化学试卷2016-2017学年河北省涿鹿中学高二上学期第一次月考化学试卷
更新时间:2020-10-12 13:15:07
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】CH3OH是一种清洁能源和重要化工原料。
(1)CH3OH(l)的燃烧热为727kJ∙mol-l。表示甲醇燃烧热的热化学方程式为___________ 。
(2)甲醇脱氢法制备甲醛,已知几个热化学方程式如下:
①CH3OH(l) =HCHO(g)+H2(g) ΔH1
②CH3OH(g)=CO(g)+2H2(g) ΔH2
③CH3OH(l)=CO(g)+2H2(g) ΔH3
④CH3OH(g)=HCHO(g)+H2(g) ΔH=___________ (用含ΔH1、ΔH2、ΔH3的式子表示)。
(3)在恒温恒容条件下,起始只投料甲醇发生反应CH3OH(g)=HCHO(g)+H2(g),达到平衡的标志有___________ (填字母序号)。
A.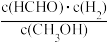 保持不变
保持不变
B.CH3OH的消耗速率等于HCHO的生成速率
C.容器内气体的总压强保持不变
D.容器内气体的密度保持不变
(4)在恒温恒容条件下,在容积相同的甲、乙两个密闭容器中按下列方式投料(a、c均大于零):
已知甲容器达到平衡时气体总压强是起始压强的1.6倍,为了使乙容器中反应保持向逆向进行,达到平衡时与甲容器中同组分体积分数相等,则c的取值范围为___________ 。
(5)向恒容密闭容器中充人一定量的CH3OH(g),发生反应CH3OH(g)=HCHO(g)+H2(g),反应过程中能量变化如图l所示。平衡时甲醇的体积分数与温度、压强的关系如图2所示。

①由图1知,该反应的活化能为_____ 。
②相同温度下,增大压强,CH3OH体积分数增大的原因是___________
③温度T1、T2、T3由高到低的顺序为___________ 。
④M点的压强为2.5MPa,则T2温度下,该反应的平衡常数Kp=___________ MPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(1)CH3OH(l)的燃烧热为727kJ∙mol-l。表示甲醇燃烧热的热化学方程式为
(2)甲醇脱氢法制备甲醛,已知几个热化学方程式如下:
①CH3OH(l) =HCHO(g)+H2(g) ΔH1
②CH3OH(g)=CO(g)+2H2(g) ΔH2
③CH3OH(l)=CO(g)+2H2(g) ΔH3
④CH3OH(g)=HCHO(g)+H2(g) ΔH=
(3)在恒温恒容条件下,起始只投料甲醇发生反应CH3OH(g)=HCHO(g)+H2(g),达到平衡的标志有
A.
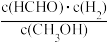 保持不变
保持不变B.CH3OH的消耗速率等于HCHO的生成速率
C.容器内气体的总压强保持不变
D.容器内气体的密度保持不变
(4)在恒温恒容条件下,在容积相同的甲、乙两个密闭容器中按下列方式投料(a、c均大于零):
| 甲 | 乙 |
| 1molCH3OH(g) | amoCH3OH(g),cmol HCHO(g),cmolH2(g) |
已知甲容器达到平衡时气体总压强是起始压强的1.6倍,为了使乙容器中反应保持向逆向进行,达到平衡时与甲容器中同组分体积分数相等,则c的取值范围为
(5)向恒容密闭容器中充人一定量的CH3OH(g),发生反应CH3OH(g)=HCHO(g)+H2(g),反应过程中能量变化如图l所示。平衡时甲醇的体积分数与温度、压强的关系如图2所示。

①由图1知,该反应的活化能为
②相同温度下,增大压强,CH3OH体积分数增大的原因是
③温度T1、T2、T3由高到低的顺序为
④M点的压强为2.5MPa,则T2温度下,该反应的平衡常数Kp=
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,回答下列问题:
(1)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g) = SiH2Cl2(g) + SiCl4(g) △H1 = +48kJ/mol
4SiHCl3(g) = SiH4(g) + 3SiCl4(g) △H3 = +114kJ/mol
则反应3SiH2Cl2(g) = SiH4(g) + 2SiHCl3(g)的△H=______________ kJ/mol。
(2)对于反应2SiHCl3(g) = SiH2Cl2(g) + SiCl4(g),采用合适的催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。

①比较a、b处反应速率大小:υa_____ υb(填“>”、“<”、“=”)
②在343 K下:要缩短反应达到平衡的时间,可采取的措施有____ 。
A、增大反应物浓度
B、增大压强
C、及时将产物从体系分离
D、使用更高效的催化剂
③某温度(T K)下,该反应可使SiHCl3的平衡转化率达到30%,则该温度下的平衡常数KT K___ K343 K(填“>”、“<”、“=”),已知反应速率υ=υ正-υ逆=k正x2(SiHCl3)-k逆x(SiH2Cl2)x(SiCl4),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算在该温度下当转化率为20%的时刻,υ正/υ逆=________ (保留1位小数)。
(1)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g) = SiH2Cl2(g) + SiCl4(g) △H1 = +48kJ/mol
4SiHCl3(g) = SiH4(g) + 3SiCl4(g) △H3 = +114kJ/mol
则反应3SiH2Cl2(g) = SiH4(g) + 2SiHCl3(g)的△H=
(2)对于反应2SiHCl3(g) = SiH2Cl2(g) + SiCl4(g),采用合适的催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。

①比较a、b处反应速率大小:υa
②在343 K下:要缩短反应达到平衡的时间,可采取的措施有
A、增大反应物浓度
B、增大压强
C、及时将产物从体系分离
D、使用更高效的催化剂
③某温度(T K)下,该反应可使SiHCl3的平衡转化率达到30%,则该温度下的平衡常数KT K
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】乙烯是合成食品外包装材料聚乙烯的单体,可以由丁烷裂解制备。
主反应:C4H10(g,正丁烷) C2H4(g)+C2H6(g) ΔH1
C2H4(g)+C2H6(g) ΔH1
副反应:C4H10(g,正丁烷) CH4(g)+C3H6(g) ΔH2
CH4(g)+C3H6(g) ΔH2
回答下列问题:
(1)化学上,将稳定单质的能量定为0,生成稳定化合物时的释放或吸收能量叫生成热,生成热可表示该物质相对能量。下表为25℃、101 kPa下几种有机物的生成热:
①表格中的物质,最稳定的是________________ (填结构简式)。
②上述反应中,ΔH1=____________ kJ·mol1。
③书写热化学方程式时,要标明“同分异构体名称”,其理由是___________________ 。
(2)一定温度下,在恒容密闭容器中投入一定量正丁烷发生反应生成乙烯。
①下列情况表明该反应达到平衡状态的是_________________ (填代号)。
A.气体密度保持不变 B.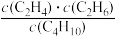 保持不变
保持不变
C.反应热不变 D.正丁烷分解速率和乙烷消耗速率相等
②为了提高反应速率和转化率,下列措施可采用的是_______________ (填代号)。
(3)向密闭容器中充入丁烷,在一定条件(浓度、催化剂及压强等)下发生反应,测得乙烯产率与温度关系如图所示。温度高于600℃时,随着温度升高,乙烯产率降低,可能的原因是____________ (填代号)。

A.平衡常数降低 B.活化能降低 C.催化剂活性降低 D.副产物增多
(4)在一定温度下向1 L恒容密闭容器中充入2 mol正丁烷,反应生成乙烯和乙烷,经过10 min 达到平衡状态,测得平衡时气体压强是原来的1.75倍。
①0~10 min内乙烷的生成速率v(C2H6)为___________ mol·L1·min1。
②上述条件下,正丁烷的平衡转化率为______________ ;该反应的平衡常数K为_____________ (填“数值和单位”)。
(5)丁烷−空气燃料电池以熔融的K2CO3(其中不含O2和 )为电解质,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的正极反应式为26CO2+13O2+52e
)为电解质,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的正极反应式为26CO2+13O2+52e 26
26 ,则负极反应式为
,则负极反应式为____________________ 。
主反应:C4H10(g,正丁烷)
 C2H4(g)+C2H6(g) ΔH1
C2H4(g)+C2H6(g) ΔH1副反应:C4H10(g,正丁烷)
 CH4(g)+C3H6(g) ΔH2
CH4(g)+C3H6(g) ΔH2回答下列问题:
(1)化学上,将稳定单质的能量定为0,生成稳定化合物时的释放或吸收能量叫生成热,生成热可表示该物质相对能量。下表为25℃、101 kPa下几种有机物的生成热:
| 物质 | 甲烷 | 乙烷 | 乙烯 | 丙烯 | 正丁烷 | 异丁烷 |
| 生成热/kJ·mol1 | −75 | −85 | 52 | 20 | −125 | −132 |
①表格中的物质,最稳定的是
②上述反应中,ΔH1=
③书写热化学方程式时,要标明“同分异构体名称”,其理由是
(2)一定温度下,在恒容密闭容器中投入一定量正丁烷发生反应生成乙烯。
①下列情况表明该反应达到平衡状态的是
A.气体密度保持不变 B.
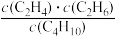 保持不变
保持不变C.反应热不变 D.正丁烷分解速率和乙烷消耗速率相等
②为了提高反应速率和转化率,下列措施可采用的是
A.加入高效催化剂 B.升高温度 C.充入乙烷 D.增大压强
(3)向密闭容器中充入丁烷,在一定条件(浓度、催化剂及压强等)下发生反应,测得乙烯产率与温度关系如图所示。温度高于600℃时,随着温度升高,乙烯产率降低,可能的原因是

A.平衡常数降低 B.活化能降低 C.催化剂活性降低 D.副产物增多
(4)在一定温度下向1 L恒容密闭容器中充入2 mol正丁烷,反应生成乙烯和乙烷,经过10 min 达到平衡状态,测得平衡时气体压强是原来的1.75倍。
①0~10 min内乙烷的生成速率v(C2H6)为
②上述条件下,正丁烷的平衡转化率为
(5)丁烷−空气燃料电池以熔融的K2CO3(其中不含O2和
 )为电解质,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的正极反应式为26CO2+13O2+52e
)为电解质,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的正极反应式为26CO2+13O2+52e 26
26 ,则负极反应式为
,则负极反应式为
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】(1)已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) △H1
2 H2(g)+ O2(g)= 2H2O(g) △H2
C(s)+ O2(g)=CO2(g) △H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为__________
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH
①取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的ΔH_______ 0(填“>”、“<”或“=”,下同)
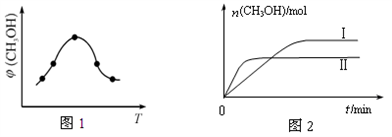
②在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数关系为KⅠ_____________ KⅡ。
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) △H1
2 H2(g)+ O2(g)= 2H2O(g) △H2
C(s)+ O2(g)=CO2(g) △H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH①取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的ΔH

②在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数关系为KⅠ
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】CO、CO2的回收与利用是科学家研究的热点课题,可利用CO、CO2制备甲烷、甲醇、二甲醚等。
(1)CO2加氢制备甲烷:CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=-164.7kJ•mol-1。已知ΔH=ΔfH (生成物)- ΔfH
(生成物)- ΔfH (反应物),298K时,几种气态物质的标准摩尔生成焓如表:
(反应物),298K时,几种气态物质的标准摩尔生成焓如表:
则x=_______ 。
(2)H2和CO合成甲烷的反应为2CO(g)+2H2(g) CH4(g)+CO2(g)。T℃时,将等物质的量的CO和H2充入恒压(200kPa)的密闭容器中。已知v逆=K逆•p(CH4)•p(CO2),其中p为分压,该温度下K逆=5.0×10-4。反应达平衡时测得v正=
CH4(g)+CO2(g)。T℃时,将等物质的量的CO和H2充入恒压(200kPa)的密闭容器中。已知v逆=K逆•p(CH4)•p(CO2),其中p为分压,该温度下K逆=5.0×10-4。反应达平衡时测得v正= kPa•s-1,则该温度下反应的Kp=
kPa•s-1,则该温度下反应的Kp=_______ (用组分的分压计算的平衡常数)。
(3)二氧化碳催化加氢制甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0,反应在起始物
CH3OH(g)+H2O(g) ΔH<0,反应在起始物 =3时,不同条件下达到平衡,体系中甲醇的物质的量分数为x(CH3OH),在t=250℃下的x(CH3OH)~p、在p=5×105Pa下的x(CH3OH)~t如图。
=3时,不同条件下达到平衡,体系中甲醇的物质的量分数为x(CH3OH),在t=250℃下的x(CH3OH)~p、在p=5×105Pa下的x(CH3OH)~t如图。
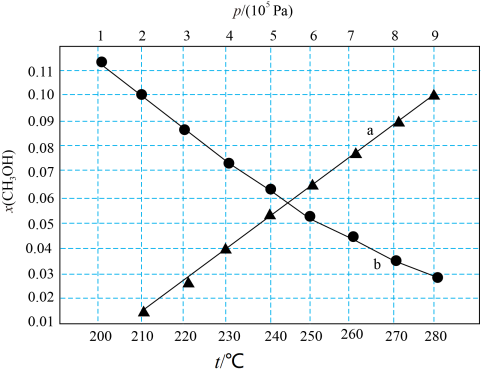
①图中对应等温过程的曲线是_______ 。
②当x(CH3OH)=0.10时,CO2的平衡转化率约为_______ 。
③当x(CH3OH)=0.10时,反应条件可能为_______ 或_______ 。
(4)甲醇脱水制得二甲醚的反应为2CH3OH(g) CH3OCH3(g)+H2O(g),当T=500K时,反应平衡常数Kc≈9,在密闭容器中加入一定量CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数
CH3OCH3(g)+H2O(g),当T=500K时,反应平衡常数Kc≈9,在密闭容器中加入一定量CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数_______ (填字母)。
a.< b.=
b.= c.>
c.> d.无法确定
d.无法确定
(1)CO2加氢制备甲烷:CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH=-164.7kJ•mol-1。已知ΔH=ΔfH
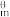 (生成物)- ΔfH
(生成物)- ΔfH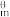 (反应物),298K时,几种气态物质的标准摩尔生成焓如表:
(反应物),298K时,几种气态物质的标准摩尔生成焓如表:| 物质 | CO2(g) | H2O(g) | CH4(g) | H2(g) |
ΔfH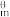 /(kJ•mol-1) /(kJ•mol-1) | -393.5 | -241.8 | x | 0 |
(2)H2和CO合成甲烷的反应为2CO(g)+2H2(g)
 CH4(g)+CO2(g)。T℃时,将等物质的量的CO和H2充入恒压(200kPa)的密闭容器中。已知v逆=K逆•p(CH4)•p(CO2),其中p为分压,该温度下K逆=5.0×10-4。反应达平衡时测得v正=
CH4(g)+CO2(g)。T℃时,将等物质的量的CO和H2充入恒压(200kPa)的密闭容器中。已知v逆=K逆•p(CH4)•p(CO2),其中p为分压,该温度下K逆=5.0×10-4。反应达平衡时测得v正= kPa•s-1,则该温度下反应的Kp=
kPa•s-1,则该温度下反应的Kp=(3)二氧化碳催化加氢制甲醇:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH<0,反应在起始物
CH3OH(g)+H2O(g) ΔH<0,反应在起始物 =3时,不同条件下达到平衡,体系中甲醇的物质的量分数为x(CH3OH),在t=250℃下的x(CH3OH)~p、在p=5×105Pa下的x(CH3OH)~t如图。
=3时,不同条件下达到平衡,体系中甲醇的物质的量分数为x(CH3OH),在t=250℃下的x(CH3OH)~p、在p=5×105Pa下的x(CH3OH)~t如图。
①图中对应等温过程的曲线是
②当x(CH3OH)=0.10时,CO2的平衡转化率约为
③当x(CH3OH)=0.10时,反应条件可能为
(4)甲醇脱水制得二甲醚的反应为2CH3OH(g)
 CH3OCH3(g)+H2O(g),当T=500K时,反应平衡常数Kc≈9,在密闭容器中加入一定量CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数
CH3OCH3(g)+H2O(g),当T=500K时,反应平衡常数Kc≈9,在密闭容器中加入一定量CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数a.<
 b.=
b.= c.>
c.> d.无法确定
d.无法确定
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】按要求填空:
(1) 明矾可用于净水,原因是 用离子方程式表示
用离子方程式表示
___________________________ 
(2)把 溶液蒸干、灼烧,最后得到的主要固体产物是
溶液蒸干、灼烧,最后得到的主要固体产物是_________________ .
(3) CuCl(s)与 反应生成
反应生成 和一种黑色固体。在
和一种黑色固体。在 、
、 下,已知该反应每消耗
下,已知该反应每消耗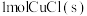 ,放热
,放热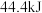 ,该反应的热化学方程式是
,该反应的热化学方程式是_____________________________ .
(4)PH=2的盐酸加水稀释到1000倍后溶液的
____ 。
(5)25℃时, 的盐酸中水的电离程度
的盐酸中水的电离程度________  填“大于”“小于”或“等于”
填“大于”“小于”或“等于” 的
的 溶液中水的电离程度。
溶液中水的电离程度。
(6)已知下列两个热化学方程式:
H2(g)+ 1/2O2(g)= H2O(l);△H =-285kJ·mol-1
C3H8(g)+ 5O2(g)= 3CO2(g)+ 4H2O(l);△H =-2220.0kJ·mol-1
①实验测得H2和C3H8的混合气体共5 mol ,完全燃烧生成液态水时放热6262.5kJ,则混合气体中H2和C3H8的体积比是_______________ 。
②又知:H2O(g)= H2O(l);△H=-44.0kJ·mol-1,
写出丙烷燃烧生成二氧化碳气体和水蒸气的热化学方程式:_____________________
(1) 明矾可用于净水,原因是
 用离子方程式表示
用离子方程式表示

(2)把
 溶液蒸干、灼烧,最后得到的主要固体产物是
溶液蒸干、灼烧,最后得到的主要固体产物是(3) CuCl(s)与
 反应生成
反应生成 和一种黑色固体。在
和一种黑色固体。在 、
、 下,已知该反应每消耗
下,已知该反应每消耗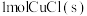 ,放热
,放热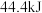 ,该反应的热化学方程式是
,该反应的热化学方程式是(4)PH=2的盐酸加水稀释到1000倍后溶液的

(5)25℃时,
 的盐酸中水的电离程度
的盐酸中水的电离程度 填“大于”“小于”或“等于”
填“大于”“小于”或“等于” 的
的 溶液中水的电离程度。
溶液中水的电离程度。 (6)已知下列两个热化学方程式:
H2(g)+ 1/2O2(g)= H2O(l);△H =-285kJ·mol-1
C3H8(g)+ 5O2(g)= 3CO2(g)+ 4H2O(l);△H =-2220.0kJ·mol-1
①实验测得H2和C3H8的混合气体共5 mol ,完全燃烧生成液态水时放热6262.5kJ,则混合气体中H2和C3H8的体积比是
②又知:H2O(g)= H2O(l);△H=-44.0kJ·mol-1,
写出丙烷燃烧生成二氧化碳气体和水蒸气的热化学方程式:
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】随着我国碳达峰、碳中和目标的确定,二氧化碳资源化利用倍受关注。
I.以CO2和NH3为原料合成尿素2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ∆H
CO(NH2)2(s)+H2O(g) ∆H
(1)有利于提高CO2平衡转化率的措施是_______(填序号)。
(2)研究发现,合成尿素反应分两步完成,其能量变化如下图甲所示:
第一步: 2NH3(g)+CO2(g) NH2COONH4(s) ∆H1
NH2COONH4(s) ∆H1
第二步:NH2COONH4(s) CO(NH2)2(s)+H2O(g) ∆H2
CO(NH2)2(s)+H2O(g) ∆H2
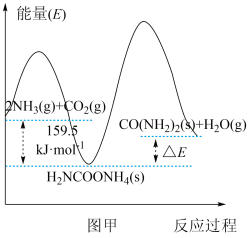
①已知图中ΔE=72 kJ/mol,则∆H=____________________ 。
②决定总反应速率的是_______ 反应(填“第一步”或“第二步”),理由是___ 。
Ⅱ.以CO2和CH4催化重整制备合成气:CO2(g)+CH4(g) 2CO(g)+ 2H2(g)。
2CO(g)+ 2H2(g)。
(3)在密闭容器中通入物质的量均为0.2 mol的CH4和CO2,在一定条件下发生反应CH4(g) +CO2(g) 2CO(g)+2H2(g),CH4的平衡转化率随温度、压强的变化关系如图乙所示。
2CO(g)+2H2(g),CH4的平衡转化率随温度、压强的变化关系如图乙所示。
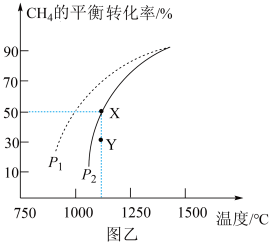
①若反应在恒温、恒容密闭容器中进行,下列叙述能说明反应到达平衡状态的是_______ (填序号)。
A.容器中混合气体的密度保持不变 B. 容器内混合气体的压强保持不变
C.反应速率: 2v正(CO2)=v正(H2) D.同时断裂2molC-H键和1 molH-H键
②由图乙可知,压强P1_______ P2 (填“>”“<”或“=”,下同); Y点速率v正_______ v逆。
③已知气体分压=气体总压x气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数Kp,则X点对应温度下的Kp=_______ (用含P2的代数式表示)。
I.以CO2和NH3为原料合成尿素2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) ∆H
CO(NH2)2(s)+H2O(g) ∆H(1)有利于提高CO2平衡转化率的措施是_______(填序号)。
| A.高温低压 | B.低温高压 | C.高温高压 | D.低温低压 |
第一步: 2NH3(g)+CO2(g)
 NH2COONH4(s) ∆H1
NH2COONH4(s) ∆H1第二步:NH2COONH4(s)
 CO(NH2)2(s)+H2O(g) ∆H2
CO(NH2)2(s)+H2O(g) ∆H2
①已知图中ΔE=72 kJ/mol,则∆H=
②决定总反应速率的是
Ⅱ.以CO2和CH4催化重整制备合成气:CO2(g)+CH4(g)
 2CO(g)+ 2H2(g)。
2CO(g)+ 2H2(g)。(3)在密闭容器中通入物质的量均为0.2 mol的CH4和CO2,在一定条件下发生反应CH4(g) +CO2(g)
 2CO(g)+2H2(g),CH4的平衡转化率随温度、压强的变化关系如图乙所示。
2CO(g)+2H2(g),CH4的平衡转化率随温度、压强的变化关系如图乙所示。
①若反应在恒温、恒容密闭容器中进行,下列叙述能说明反应到达平衡状态的是
A.容器中混合气体的密度保持不变 B. 容器内混合气体的压强保持不变
C.反应速率: 2v正(CO2)=v正(H2) D.同时断裂2molC-H键和1 molH-H键
②由图乙可知,压强P1
③已知气体分压=气体总压x气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数Kp,则X点对应温度下的Kp=
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)⇌CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下,则该反应的ΔH=_______ kJ·mol-1。
(2)上述反应中所需的甲醇,工业上利用水煤气合成:CO(g)+2H2(g)⇌CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的平衡体积分数φ(CH3OH)变化趋势如图所示:
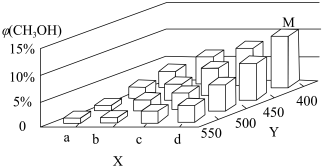
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为_______ 。
②X轴上a点的数值比b点_______ (填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是_______ 。
(3)工业上可采用CH3OH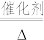 CO+2H2来制取高纯度的CO和H2.我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯基催化剂表面上的物种用*标注。甲醇(CH3OH)脱氢反应的第一步历程,有两种可能的方式:
CO+2H2来制取高纯度的CO和H2.我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯基催化剂表面上的物种用*标注。甲醇(CH3OH)脱氢反应的第一步历程,有两种可能的方式:
方式A:CH3OH*→CH3O*+H* Ea=+103.1 kJ·mol-1
方式B:CH3OH*→CH +OH* Eb=+249.3 kJ·mol-1
+OH* Eb=+249.3 kJ·mol-1
实验证实甲醇裂解过程主要历经的方式为A,试推测可能的原因_______ 。
下图为计算机模拟的各步反应的能量变化示意图。

该历程中,放热最多的步骤的化学方程式为_______ 。
(4)PbI2与金属锂以LiIAl2O3固体为电解质组成锂碘电池,其结构示意图如下,电池总反应可表示为2Li+PbI2=2LiI+Pb,则b极上的电极反应式为_______ 。

(5)CH3NH2的电离方程式为CH3NH2+H2O⇌CH3NH +OH-,电离常数为Kb,已知常温下pKb=-lg Kb=3.4,则常温下向CH3NH2溶液中滴加稀硫酸至c(CH3NH2)=c(CH3NH
+OH-,电离常数为Kb,已知常温下pKb=-lg Kb=3.4,则常温下向CH3NH2溶液中滴加稀硫酸至c(CH3NH2)=c(CH3NH )时,溶液pH=
)时,溶液pH=_______ 。
(6)常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3 mol·L-1,则Ksp(PbI2)=_______ 。
(1)制取甲胺的反应为CH3OH(g)+NH3(g)⇌CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下,则该反应的ΔH=
| 共价键 | C—O | H—O | N—H | C—N | C—H |
| 键能/(kJ·mol-1) | 351 | 463 | 393 | 293 | 414 |
(2)上述反应中所需的甲醇,工业上利用水煤气合成:CO(g)+2H2(g)⇌CH3OH(g) ΔH<0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的平衡体积分数φ(CH3OH)变化趋势如图所示:

①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为
②X轴上a点的数值比b点
(3)工业上可采用CH3OH
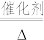 CO+2H2来制取高纯度的CO和H2.我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯基催化剂表面上的物种用*标注。甲醇(CH3OH)脱氢反应的第一步历程,有两种可能的方式:
CO+2H2来制取高纯度的CO和H2.我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯基催化剂表面上的物种用*标注。甲醇(CH3OH)脱氢反应的第一步历程,有两种可能的方式:方式A:CH3OH*→CH3O*+H* Ea=+103.1 kJ·mol-1
方式B:CH3OH*→CH
 +OH* Eb=+249.3 kJ·mol-1
+OH* Eb=+249.3 kJ·mol-1实验证实甲醇裂解过程主要历经的方式为A,试推测可能的原因
下图为计算机模拟的各步反应的能量变化示意图。

该历程中,放热最多的步骤的化学方程式为
(4)PbI2与金属锂以LiIAl2O3固体为电解质组成锂碘电池,其结构示意图如下,电池总反应可表示为2Li+PbI2=2LiI+Pb,则b极上的电极反应式为

(5)CH3NH2的电离方程式为CH3NH2+H2O⇌CH3NH
 +OH-,电离常数为Kb,已知常温下pKb=-lg Kb=3.4,则常温下向CH3NH2溶液中滴加稀硫酸至c(CH3NH2)=c(CH3NH
+OH-,电离常数为Kb,已知常温下pKb=-lg Kb=3.4,则常温下向CH3NH2溶液中滴加稀硫酸至c(CH3NH2)=c(CH3NH )时,溶液pH=
)时,溶液pH=(6)常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3 mol·L-1,则Ksp(PbI2)=
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】探究硫及其化合物的转化,有现实意义。
相关反应:I 2SO2(g)+O2(g)⇌2SO3(g) ΔH1
II 2NO(g)+O2(g)⇌2NO2(g) ΔH 2
III NO2(g)+SO2(g)⇌SO3(g)+NO(g) ΔH3
(1)一定温度下,压强恒定的密闭容器中发生反应2SO2(g)+O2(g)⇌2SO3(g),下列说法正确的是______
A.ΔH1<0,反应I在较低温能自发进行
B.反应混合气组分中SO2和SO3分压比不变,可作为达到化学平衡状态的判据
C.若向反应体系中充入一定量NO2气体,有利于提高SO3的平衡产率
D.增大O2分压可提高SO2的平衡转化率
(2)精制炉气各组分的体积分数SO27%、O211%、N282%,选择五氧化二钒(V2O5)作催化剂合成SO3,SO2的平衡转化率与反应温度和压强的关系如图。

①实际生产选择图中A点的反应条件,不选择B、C点理由分别是______ 。
②计算,D点SO3的分压是______ Mpa(结果保留两位有效数字)
(3)已知:标准生成焓:在298K,100kPa条件下,由最稳定的单质生成单位物质的量的纯物质的热效应。反应ΔH=生成物的标准生成焓总和-反应物的标准生成焓总和。
反应III NO2(g)+SO2(g)⇌SO3(g)+NO(g) ΔH3=_______ kJ/mol
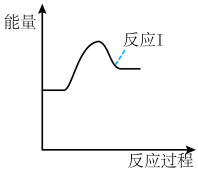
(4)煤炭燃烧采用钙基固硫技术可减少SO2排放,但煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低了脱硫效率。相关反应的热化学方程式如下:
反应I CaSO4(s)+CO(g) ⇌CaO(s) + SO2(g) + CO2(g) ΔH1=218.4kJ∙mol-1
反应II CaSO4(s)+4CO(g) ⇌CaS(s) + 4CO2(g) ΔH2=-175.6kJ∙mol-1
某温度下,若反应I的速率远大于反应II,反应I、II的反应物的初始能量相等,请在图中画出反应II的过程能量变化示意图:_______ 。
相关反应:I 2SO2(g)+O2(g)⇌2SO3(g) ΔH1
II 2NO(g)+O2(g)⇌2NO2(g) ΔH 2
III NO2(g)+SO2(g)⇌SO3(g)+NO(g) ΔH3
(1)一定温度下,压强恒定的密闭容器中发生反应2SO2(g)+O2(g)⇌2SO3(g),下列说法正确的是
A.ΔH1<0,反应I在较低温能自发进行
B.反应混合气组分中SO2和SO3分压比不变,可作为达到化学平衡状态的判据
C.若向反应体系中充入一定量NO2气体,有利于提高SO3的平衡产率
D.增大O2分压可提高SO2的平衡转化率
(2)精制炉气各组分的体积分数SO27%、O211%、N282%,选择五氧化二钒(V2O5)作催化剂合成SO3,SO2的平衡转化率与反应温度和压强的关系如图。

①实际生产选择图中A点的反应条件,不选择B、C点理由分别是
②计算,D点SO3的分压是
(3)已知:标准生成焓:在298K,100kPa条件下,由最稳定的单质生成单位物质的量的纯物质的热效应。反应ΔH=生成物的标准生成焓总和-反应物的标准生成焓总和。
| 物质 | 标准生成焓ΔfHθmkI/mol | 物质 | 标准生成焓ΔfHθmkI/mol |
| O2(g) | 0 | SO2(g) | -296.9 |
| N2(g) | 0 | SO3(g) | -395.2 |
| S(斜方硫,s) | 0 | NO(g) | 89.9 |
| NO2(g) | 33.9 |
反应III NO2(g)+SO2(g)⇌SO3(g)+NO(g) ΔH3=
(4)煤炭燃烧采用钙基固硫技术可减少SO2排放,但煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低了脱硫效率。相关反应的热化学方程式如下:
反应I CaSO4(s)+CO(g) ⇌CaO(s) + SO2(g) + CO2(g) ΔH1=218.4kJ∙mol-1
反应II CaSO4(s)+4CO(g) ⇌CaS(s) + 4CO2(g) ΔH2=-175.6kJ∙mol-1
某温度下,若反应I的速率远大于反应II,反应I、II的反应物的初始能量相等,请在图中画出反应II的过程能量变化示意图:

您最近半年使用:0次



