亚氯酸钠(NaClO2)是一种重要的含氯消毒剂。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
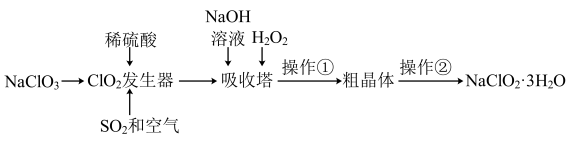
已知:
①HClO2可视为强酸,NaClO2的溶解度随温度升高而增大。
②ClO2的沸点为10℃,纯ClO2易分解爆炸。
(1)SO2是常见的还原剂,反应过程中被氧化成 ,那么发生器中发生反应的离子方程式为
,那么发生器中发生反应的离子方程式为____________________________________ ;向其中鼓入空气的作用可能是___________________________ 。
(2)H2O2一般表现出强氧化性,但是遇到比它氧化性更强的物质的时候也能表现出还原性,H2O2做还原剂时,会生成一种无色无味的气体,则吸收塔中发生反应的化学方程式为__________________________________ ;为防止生成的NaClO2被继续还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是______  填序号
填序号 。
。
A.Na2O2 B.Na2S C.FeCl2 D.KMnO4
(3)操作①的实验方法依次是______________ 、______________
(4)akg NaClO3理论上可制______________ kg NaClO2•3H2O。

已知:
①HClO2可视为强酸,NaClO2的溶解度随温度升高而增大。
②ClO2的沸点为10℃,纯ClO2易分解爆炸。
(1)SO2是常见的还原剂,反应过程中被氧化成
 ,那么发生器中发生反应的离子方程式为
,那么发生器中发生反应的离子方程式为(2)H2O2一般表现出强氧化性,但是遇到比它氧化性更强的物质的时候也能表现出还原性,H2O2做还原剂时,会生成一种无色无味的气体,则吸收塔中发生反应的化学方程式为
 填序号
填序号 。
。A.Na2O2 B.Na2S C.FeCl2 D.KMnO4
(3)操作①的实验方法依次是
(4)akg NaClO3理论上可制
更新时间:2020-11-15 15:23:53
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】高氯酸铜易溶于水,在130 ℃时会发生分解反应,是一种燃烧催化剂。以食盐等为原料制备高氯酸铜[Cu(ClO4)2·6H2O]的一种工艺流程如图1所示:
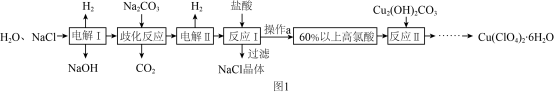
(1)发生“电解Ⅰ”时,所用的交换膜是____ (填“阳”或“阴”)离子交换膜。
(2)歧化反应是同一种物质中同种元素自身的氧化还原反应。已知上述工艺流程中“歧化反应”的产物之一为氯酸钠,则“歧化反应”的化学方程式为________ 。
(3)“电解Ⅱ”主要的阳极产物是_________ (填离子符号)。
(4)操作a的名称是____ 。
(5)用该工艺流程制备高氯酸铜时,若起始时NaCl的质量为a t,最终制得Cu(ClO4)2·6H2O为b t,则产率为____ (用含a,b的代数式表示)。
(6)某温度下,高氯酸铜[Cu(ClO4)2]按A、B两种方式同时分解,分解过程中铜的化合价不发生改变。方式A为Cu(ClO4)2 CuCl2+4O2↑,若4 mol高氯酸铜在该温度下按A、B各占50% 的方式完全分解,且A、B两种方式转移的电子数之比为8∶7,则方式B为
CuCl2+4O2↑,若4 mol高氯酸铜在该温度下按A、B各占50% 的方式完全分解,且A、B两种方式转移的电子数之比为8∶7,则方式B为____ (用化学方程式表示)。

(1)发生“电解Ⅰ”时,所用的交换膜是
(2)歧化反应是同一种物质中同种元素自身的氧化还原反应。已知上述工艺流程中“歧化反应”的产物之一为氯酸钠,则“歧化反应”的化学方程式为
(3)“电解Ⅱ”主要的阳极产物是
(4)操作a的名称是
(5)用该工艺流程制备高氯酸铜时,若起始时NaCl的质量为a t,最终制得Cu(ClO4)2·6H2O为b t,则产率为
(6)某温度下,高氯酸铜[Cu(ClO4)2]按A、B两种方式同时分解,分解过程中铜的化合价不发生改变。方式A为Cu(ClO4)2
 CuCl2+4O2↑,若4 mol高氯酸铜在该温度下按A、B各占50% 的方式完全分解,且A、B两种方式转移的电子数之比为8∶7,则方式B为
CuCl2+4O2↑,若4 mol高氯酸铜在该温度下按A、B各占50% 的方式完全分解,且A、B两种方式转移的电子数之比为8∶7,则方式B为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
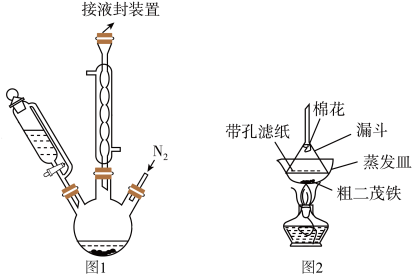
【推荐2】二茂铁[ ]是一种具有芳香族化合物性质的有机过渡金属化合物。二茂铁的熔点是173℃,在100℃时开始升华,沸点是249℃,不溶于水,易溶于苯、乙醚、汽油、柴油等有机溶剂;化学性质稳定,400℃以内不分解。实验室制备二茂铁的装置示意图(夹持及加热装置略)如图1所示,实验步骤如下:
]是一种具有芳香族化合物性质的有机过渡金属化合物。二茂铁的熔点是173℃,在100℃时开始升华,沸点是249℃,不溶于水,易溶于苯、乙醚、汽油、柴油等有机溶剂;化学性质稳定,400℃以内不分解。实验室制备二茂铁的装置示意图(夹持及加热装置略)如图1所示,实验步骤如下:
①向三颈烧瓶中加入25g粉末状的 ,并经恒压滴液漏斗向三颈烧瓶中加入
,并经恒压滴液漏斗向三颈烧瓶中加入 无水乙醚,充分搅拌,同时通入氮气约
无水乙醚,充分搅拌,同时通入氮气约 ;
;
②再经恒压滴液漏斗向三颈烧瓶中滴入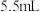 新蒸馏的环戊二烯(
新蒸馏的环戊二烯(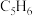 、密度为
、密度为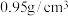 ),搅拌;
),搅拌;
③将6.5g无水 与
与 (二甲亚砜,作溶剂)配制成的
(二甲亚砜,作溶剂)配制成的 溶液装入恒压滴液漏斗中,慢慢滴入三颈烧瓶中,
溶液装入恒压滴液漏斗中,慢慢滴入三颈烧瓶中,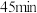 滴完,继续搅拌
滴完,继续搅拌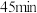 ;
;
④再经恒压滴液漏斗向三颈烧瓶中加入25L无水乙醚,搅拌;
⑤将三颈烧瓶中的液体转移至分液漏斗中,依次用盐酸、水各洗涤两次,分液得到橙黄色溶液;
⑥蒸发橙黄色溶液,得到二茂铁粗产品。
请回答下列问题:
(1) 、
、 、
、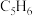 反应生成二茂铁[
反应生成二茂铁[ ]和
]和 的化学方程式为
的化学方程式为_______ 。
(2)二茂铁粗产品提纯过程在图2所示装置中进行,其操作名称为_______ 。
(3)最终得到4.8g纯净的二茂铁,则该实验的产率 (二茂铁)=
(二茂铁)=_______ (保留3位有效数字)。
 ]是一种具有芳香族化合物性质的有机过渡金属化合物。二茂铁的熔点是173℃,在100℃时开始升华,沸点是249℃,不溶于水,易溶于苯、乙醚、汽油、柴油等有机溶剂;化学性质稳定,400℃以内不分解。实验室制备二茂铁的装置示意图(夹持及加热装置略)如图1所示,实验步骤如下:
]是一种具有芳香族化合物性质的有机过渡金属化合物。二茂铁的熔点是173℃,在100℃时开始升华,沸点是249℃,不溶于水,易溶于苯、乙醚、汽油、柴油等有机溶剂;化学性质稳定,400℃以内不分解。实验室制备二茂铁的装置示意图(夹持及加热装置略)如图1所示,实验步骤如下:
①向三颈烧瓶中加入25g粉末状的
 ,并经恒压滴液漏斗向三颈烧瓶中加入
,并经恒压滴液漏斗向三颈烧瓶中加入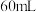 无水乙醚,充分搅拌,同时通入氮气约
无水乙醚,充分搅拌,同时通入氮气约 ;
;②再经恒压滴液漏斗向三颈烧瓶中滴入
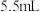 新蒸馏的环戊二烯(
新蒸馏的环戊二烯(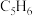 、密度为
、密度为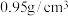 ),搅拌;
),搅拌;③将6.5g无水
 与
与 (二甲亚砜,作溶剂)配制成的
(二甲亚砜,作溶剂)配制成的 溶液装入恒压滴液漏斗中,慢慢滴入三颈烧瓶中,
溶液装入恒压滴液漏斗中,慢慢滴入三颈烧瓶中,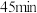 滴完,继续搅拌
滴完,继续搅拌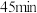 ;
;④再经恒压滴液漏斗向三颈烧瓶中加入25L无水乙醚,搅拌;
⑤将三颈烧瓶中的液体转移至分液漏斗中,依次用盐酸、水各洗涤两次,分液得到橙黄色溶液;
⑥蒸发橙黄色溶液,得到二茂铁粗产品。
请回答下列问题:
(1)
 、
、 、
、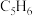 反应生成二茂铁[
反应生成二茂铁[ ]和
]和 的化学方程式为
的化学方程式为(2)二茂铁粗产品提纯过程在图2所示装置中进行,其操作名称为
(3)最终得到4.8g纯净的二茂铁,则该实验的产率
 (二茂铁)=
(二茂铁)=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】已知FeI2常温为灰黑色固体,溶于冷水,用于制碱金属的碘化物,可用于医药,在有机化学中常用作催化剂。某研究性学习小组对FeI2进行了如下实验:
Ⅰ.配制480mL 0.2mol/L FeI2溶液
(1)用托盘天平称量,计算需要称取FeI2固体的质量___________ g。
(2)完成该实验所需要的玻璃仪器除了烧杯、玻璃棒、量筒、胶头滴管外,还需要___________ 。
(3)下列关于容量瓶及其使用方法的表述不正确的是___________(填标号)。
(4)若在配制过程中出现下列情况,会使所配制FeI2溶液的浓度偏低的是___________(填标号)。
Ⅱ.探究FeI2的性质
(5)若向150mL 0.2 mol/L FeI2溶液通入标准状况下896mL Cl2,则反应的离子方程式为___________ 。
(6)为测定FeI2催化剂中铁元素的含量(已知杂质不含铁元素),某化学兴趣小组设计如图方案:
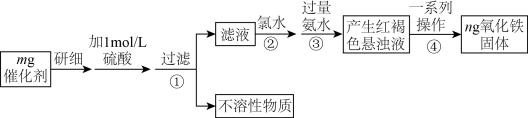
步骤④的一系列操作是___________ 、___________ 、干燥、灼烧、称量。
(7)计算 FeI2催化剂中铁元素的含量为___________ 。
Ⅰ.配制480mL 0.2mol/L FeI2溶液
(1)用托盘天平称量,计算需要称取FeI2固体的质量
(2)完成该实验所需要的玻璃仪器除了烧杯、玻璃棒、量筒、胶头滴管外,还需要
(3)下列关于容量瓶及其使用方法的表述不正确的是___________(填标号)。
| A.容量瓶必须烘干后才能用于溶液配制 |
| B.配制溶液之前,要检查容量瓶是否漏水 |
| C.容量瓶不能加热、溶解固体、稀释;使用完毕,应洗净、晾干 |
| D.可以用500mL的容量瓶配制250mL溶液 |
(4)若在配制过程中出现下列情况,会使所配制FeI2溶液的浓度偏低的是___________(填标号)。
| A.定容摇匀后,发现液面低于刻度线,再加入蒸馏水至刻度线 |
| B.转移溶液后,未洗涤烧杯和玻璃棒就直接定容 |
| C.没有冷却到室温就立即开始转移溶液 |
| D.称量时,所用的砝码已部分生锈 |
Ⅱ.探究FeI2的性质
(5)若向150mL 0.2 mol/L FeI2溶液通入标准状况下896mL Cl2,则反应的离子方程式为
(6)为测定FeI2催化剂中铁元素的含量(已知杂质不含铁元素),某化学兴趣小组设计如图方案:

步骤④的一系列操作是
(7)计算 FeI2催化剂中铁元素的含量为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】硫化氢的转化是资源利用和环境保护的重要研究课题,脱除H2S有多种方法。
(1)沉淀法。
将H2S气体通入ZnSO4溶液,只产生少量白色ZnS沉淀,反应不完全。如果在ZnSO4溶液中先加入CH3COONa,再通入H2S气体,则可得大量ZnS沉淀。含CH3COONa的ZnSO4溶液吸收H2S的离子反应方程式是___________ 。
(2)沉淀氧化法。
在含H2S的废气中混入O2形成混合气体,并将混合气体通入酸性的FeCl3和CuCl2的混合溶液中。反应过程如图所示:
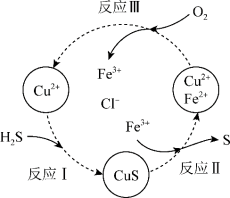
a.反应Ⅱ的离子方程式是___________ 。
b.资料1:Cu2+在反应Ⅲ中起催化作用:
i.Cu2+ + Fe2+ = Cu+ + Fe3+
ii.___________ (将反应ii补充完整)
c.在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有___________ 。
d.该过程的总反应方程式是___________ 。
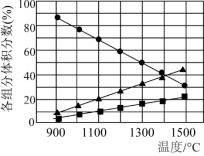
(3)H2S在高温下分解生成硫蒸汽和H2。
已知:硫蒸气为Sx(不同温度下x可能为2,4,6或8),若反应在不同温度下充分进行后,混合气体中各组分的体积分数如图所示。则H2S在此温度范围内分解的化学方程式为___________ 。
(1)沉淀法。
将H2S气体通入ZnSO4溶液,只产生少量白色ZnS沉淀,反应不完全。如果在ZnSO4溶液中先加入CH3COONa,再通入H2S气体,则可得大量ZnS沉淀。含CH3COONa的ZnSO4溶液吸收H2S的离子反应方程式是
(2)沉淀氧化法。
在含H2S的废气中混入O2形成混合气体,并将混合气体通入酸性的FeCl3和CuCl2的混合溶液中。反应过程如图所示:

a.反应Ⅱ的离子方程式是
b.资料1:Cu2+在反应Ⅲ中起催化作用:
i.Cu2+ + Fe2+ = Cu+ + Fe3+
ii.
c.在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有
d.该过程的总反应方程式是
(3)H2S在高温下分解生成硫蒸汽和H2。
已知:硫蒸气为Sx(不同温度下x可能为2,4,6或8),若反应在不同温度下充分进行后,混合气体中各组分的体积分数如图所示。则H2S在此温度范围内分解的化学方程式为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】碱性锌锰电池的工作原理: Zn + 2MnO2 + 2H2O=2MnO(OH) +Zn(OH)2,其中的电解质溶液是KOH溶液。某课题组用废旧铁壳无汞碱性锌锰电池为原料,制备一种新型材料——MnXZn(1-x)Fe2O4,其工艺流程如图所示:

(1)已知MnXZn(1-x)Fe2O4中锰元素的化合价与实验室用二氧化锰制取氯气时还原产物中的锰相同,则铁元素的化合价为___________________ 。
(2)“浸取”工序得到的滤液A经蒸发结晶,可以获得化工产品M,M的电子式为_______ 。
(3)“溶渣”工序中稀硫酸与铁反应生成的硫酸亚铁可将+3价锰的化合物全部还原成Mn2+,写出该反应的离子方程式:____________ 。
(4)“调铁”工序的目的是调整滤液中铁离子的总浓度,使其中金属元素的物质的量之比与产品的化学式MnXZn(1-x)Fe2O4相符合。写出“调铁”工序中发生反应的离子方程式:________ 、____________ 。
(5)在“氧化”工序中,加入双氧水的目的是_____________ ;生产过程中发现实际消耗双氧水的量大于理论值,其可能原因除温度外,主要是_________ 。
(6)用氨水“调pH”后,经“结晶”“过滤”可得到产品和滤液C,从滤液C中还可分离出一种氨肥。该氮肥的溶液中离子浓度由大到小的排序为_______________ 。

(1)已知MnXZn(1-x)Fe2O4中锰元素的化合价与实验室用二氧化锰制取氯气时还原产物中的锰相同,则铁元素的化合价为
(2)“浸取”工序得到的滤液A经蒸发结晶,可以获得化工产品M,M的电子式为
(3)“溶渣”工序中稀硫酸与铁反应生成的硫酸亚铁可将+3价锰的化合物全部还原成Mn2+,写出该反应的离子方程式:
(4)“调铁”工序的目的是调整滤液中铁离子的总浓度,使其中金属元素的物质的量之比与产品的化学式MnXZn(1-x)Fe2O4相符合。写出“调铁”工序中发生反应的离子方程式:
(5)在“氧化”工序中,加入双氧水的目的是
(6)用氨水“调pH”后,经“结晶”“过滤”可得到产品和滤液C,从滤液C中还可分离出一种氨肥。该氮肥的溶液中离子浓度由大到小的排序为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】新冠肺炎期间,化学消毒剂大显身手。高铁酸钾( ,
,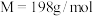 )是一种高效多功能的绿色消毒剂,广泛应用于生活用水和废水的杀菌、消毒。工业制备高铁酸钾的方法主要有湿法和干法两种。
)是一种高效多功能的绿色消毒剂,广泛应用于生活用水和废水的杀菌、消毒。工业制备高铁酸钾的方法主要有湿法和干法两种。
Ⅰ.实验室模拟湿法制备高铁酸钾的流程如下:

已知:转化过程发生复分解反应。
回答下列问题:
(1)配制上述NaOH溶液,下列操作可能导致溶液浓度偏大的有_______ (填序号)。
A.将NaOH放在滤纸上称量
B.NaOH在烧杯中溶解后,未经冷却就立即转移
C.容量瓶洗净之后未干燥
D.定容时俯视刻度线
E.摇匀后发现液面低于刻度线,再加水至刻度线
(2)NaOH溶液应置于冰水浴中,否则温度升高将发生如下副反应: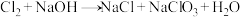 (未配平)
(未配平)
①若有 发生该副反应,该过程中转移电子数目为
发生该副反应,该过程中转移电子数目为_______ ;
②若反应后溶液中NaCl和 的物质的量之比为6∶1,则生成NaCl和NaClO的物质的量之比为
的物质的量之比为6∶1,则生成NaCl和NaClO的物质的量之比为_______ 。
(3)氧化过程中溶液保持碱性。写出反应的离子方程式:_______ 。
(4)产品经干燥后得到纯品99g,则 的产率为
的产率为_______ (用百分数表示)。
Ⅱ.工业干法制备高铁酸钾的第一步反应为: ,
,
(5)该反应中氧化产物为_______ 、_______ ,氧化剂和还原剂的物质的量之比为_______ 。第二步反应为: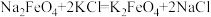 ,试解释该反应能发生的原因
,试解释该反应能发生的原因_______ 。
 ,
,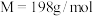 )是一种高效多功能的绿色消毒剂,广泛应用于生活用水和废水的杀菌、消毒。工业制备高铁酸钾的方法主要有湿法和干法两种。
)是一种高效多功能的绿色消毒剂,广泛应用于生活用水和废水的杀菌、消毒。工业制备高铁酸钾的方法主要有湿法和干法两种。Ⅰ.实验室模拟湿法制备高铁酸钾的流程如下:

已知:转化过程发生复分解反应。
回答下列问题:
(1)配制上述NaOH溶液,下列操作可能导致溶液浓度偏大的有
A.将NaOH放在滤纸上称量
B.NaOH在烧杯中溶解后,未经冷却就立即转移
C.容量瓶洗净之后未干燥
D.定容时俯视刻度线
E.摇匀后发现液面低于刻度线,再加水至刻度线
(2)NaOH溶液应置于冰水浴中,否则温度升高将发生如下副反应:
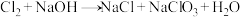 (未配平)
(未配平)①若有
 发生该副反应,该过程中转移电子数目为
发生该副反应,该过程中转移电子数目为②若反应后溶液中NaCl和
 的物质的量之比为6∶1,则生成NaCl和NaClO的物质的量之比为
的物质的量之比为6∶1,则生成NaCl和NaClO的物质的量之比为(3)氧化过程中溶液保持碱性。写出反应的离子方程式:
(4)产品经干燥后得到纯品99g,则
 的产率为
的产率为Ⅱ.工业干法制备高铁酸钾的第一步反应为:
 ,
,(5)该反应中氧化产物为
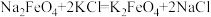 ,试解释该反应能发生的原因
,试解释该反应能发生的原因
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
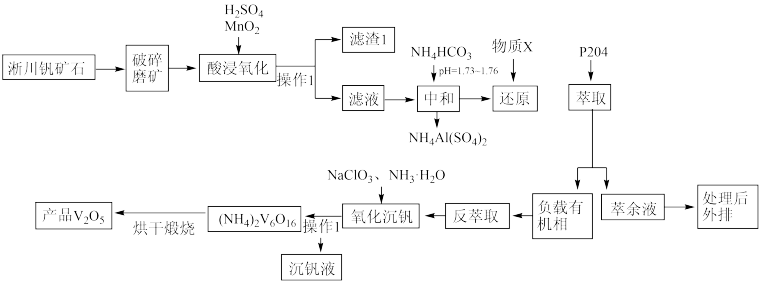
【推荐1】五氧化二钒(V2O5)广泛用于冶金、化工等行业。一种以淅川钒矿(钒以+3、+4价的化合物存在、SiO2、Fe3O4以及Al2O3)为原料生产五氧化二钒的工艺流程如下:
已知:①萃取剂P2O4对VO2+具有高选择性,且萃取Fe3+而不萃取Fe2+、Mn2+、Al3+
②氧化性:VO >Fe3+>VO2+>Fe2+
>Fe3+>VO2+>Fe2+
③萃取反应为:VO2++(HR2PO4)2(O)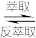 VO(R2PO4)2(O)+2H+,式中HR2PO4为P2O4,R=C8H17
VO(R2PO4)2(O)+2H+,式中HR2PO4为P2O4,R=C8H17
④
回答下列问题:
(1)“酸浸氧化”中,VO+被氧化成VO2+,同时还有___________ 离子被氧化。写出VO+转化为VO 反应的离子方程式
反应的离子方程式___________ 。
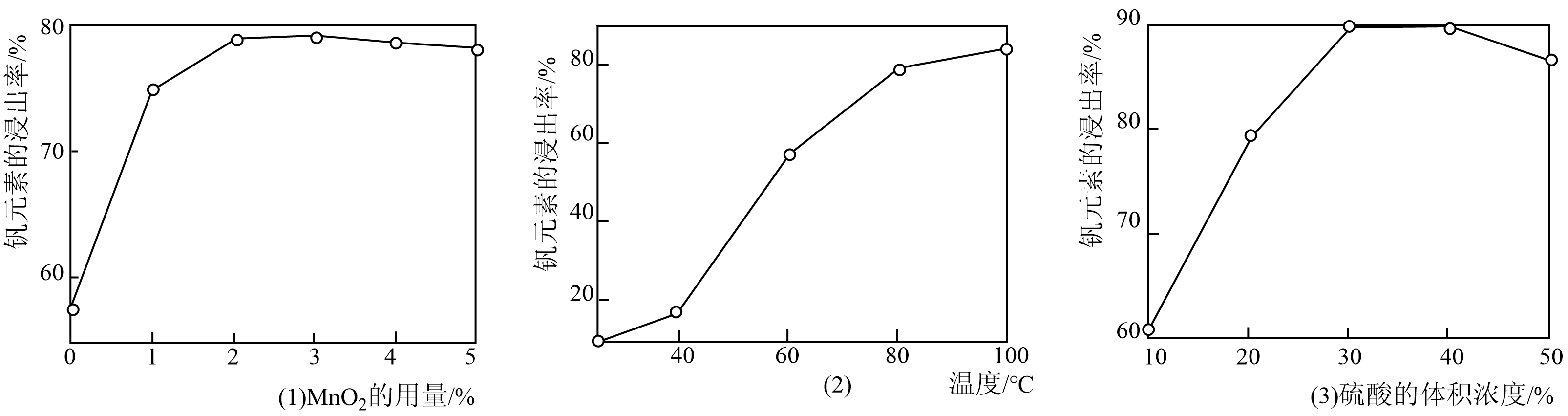
(2)研究表明,“酸浸氧化”中MnO2的用量、温度和硫酸的体积浓度会直接影响钒元素的浸出率,由图(1)(2)(3)可知,最佳条件为___________ (填序号)
(3)“滤渣1”的主要成分为___________ (填化学式)。
(4)“还原”中添加的物质X是___________ (填化学式),且要控制物质X的加入量,既不能过多,也不能过少,原因是___________ 。
(5)“氧化沉钒”的离子方程式是___________ 。
(6)用石灰中和处理萃余液,Fe2+、Al3+、Mn2+以氢氧化物形式沉淀,要使金属离子完全沉淀,则pH的理论最小值为___________ (当溶液中某离子浓度c≤1.0×10-5mol/L时,可认为该离子沉淀完全)。

已知:①萃取剂P2O4对VO2+具有高选择性,且萃取Fe3+而不萃取Fe2+、Mn2+、Al3+
②氧化性:VO
 >Fe3+>VO2+>Fe2+
>Fe3+>VO2+>Fe2+③萃取反应为:VO2++(HR2PO4)2(O)
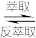 VO(R2PO4)2(O)+2H+,式中HR2PO4为P2O4,R=C8H17
VO(R2PO4)2(O)+2H+,式中HR2PO4为P2O4,R=C8H17④
| 化合物 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
| 溶度积常数(25℃)近似值 | 10-17 | 10-39 | 10-35 | 10-13 |
(1)“酸浸氧化”中,VO+被氧化成VO2+,同时还有
 反应的离子方程式
反应的离子方程式(2)研究表明,“酸浸氧化”中MnO2的用量、温度和硫酸的体积浓度会直接影响钒元素的浸出率,由图(1)(2)(3)可知,最佳条件为

(3)“滤渣1”的主要成分为
(4)“还原”中添加的物质X是
(5)“氧化沉钒”的离子方程式是
(6)用石灰中和处理萃余液,Fe2+、Al3+、Mn2+以氢氧化物形式沉淀,要使金属离子完全沉淀,则pH的理论最小值为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】联合多种工业制备是节能环保,高效生产,减少损耗的重要途径。钛和钛合金性能优良,广泛用于航空、造船和化学工业中。以钛铁矿(主要成分为 (其中
(其中 为
为 价),含有少量
价),含有少量 、
、 )为主要原料制取
)为主要原料制取 单质和绿矾
单质和绿矾 ,同时联合氯碱工业生产甲醇的工艺流程如图1所示。
,同时联合氯碱工业生产甲醇的工艺流程如图1所示。
回答下列问题:
(1)酸浸后,溶液中钛元素主要以 形式存在,则在酸浸工序中发生的主要反应的化学方程式为
形式存在,则在酸浸工序中发生的主要反应的化学方程式为______ 。
(2)某化学兴趣小组在实验室模拟该工艺流程,保持其他反应条件不变,测得加入铁屑还原体系中 (Ⅲ)含量随反应温度的变化如图2所示。为达到实验目的,最佳反应温度为
(Ⅲ)含量随反应温度的变化如图2所示。为达到实验目的,最佳反应温度为______ 。______ (填标号)。
a.工序①为趁热过滤、洗涤、干燥
b.先用适量稀硫酸洗涤绿矾并将洗涤液与滤液合并,可提高钛的产率
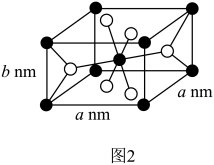
(4)灼烧后的成分为 ,可用作钛白颜料,该物质的一种晶胞结构(四方晶体)如图3所示。该晶体的密度为
,可用作钛白颜料,该物质的一种晶胞结构(四方晶体)如图3所示。该晶体的密度为______  (用含
(用含 、
、 、
、 的代数式表示,
的代数式表示, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(5)工序②生成的气体 为可燃性气体,生成气体
为可燃性气体,生成气体 的反应方程式为
的反应方程式为______ 。
(6)还原工序中通入氩气的目的是______ 。
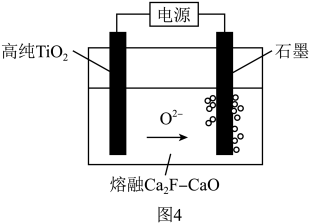
(7)利用图4装置可获得金属钛。在较低的阴极电位下, 中的氧解离进入熔融盐,最后只剩下纯钛,另一极产生
中的氧解离进入熔融盐,最后只剩下纯钛,另一极产生 、
、 和可燃性气体
和可燃性气体 。产生可燃性气体
。产生可燃性气体 的电极反应式为
的电极反应式为______ 。
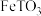 (其中
(其中 为
为 价),含有少量
价),含有少量 、
、 )为主要原料制取
)为主要原料制取 单质和绿矾
单质和绿矾 ,同时联合氯碱工业生产甲醇的工艺流程如图1所示。
,同时联合氯碱工业生产甲醇的工艺流程如图1所示。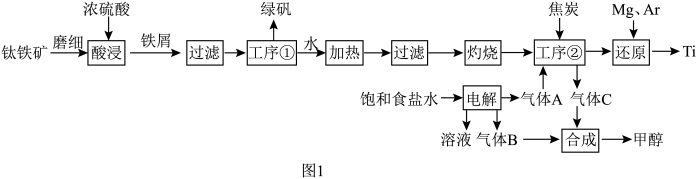

回答下列问题:
(1)酸浸后,溶液中钛元素主要以
 形式存在,则在酸浸工序中发生的主要反应的化学方程式为
形式存在,则在酸浸工序中发生的主要反应的化学方程式为(2)某化学兴趣小组在实验室模拟该工艺流程,保持其他反应条件不变,测得加入铁屑还原体系中
 (Ⅲ)含量随反应温度的变化如图2所示。为达到实验目的,最佳反应温度为
(Ⅲ)含量随反应温度的变化如图2所示。为达到实验目的,最佳反应温度为
a.工序①为趁热过滤、洗涤、干燥
b.先用适量稀硫酸洗涤绿矾并将洗涤液与滤液合并,可提高钛的产率
(4)灼烧后的成分为
 ,可用作钛白颜料,该物质的一种晶胞结构(四方晶体)如图3所示。该晶体的密度为
,可用作钛白颜料,该物质的一种晶胞结构(四方晶体)如图3所示。该晶体的密度为 (用含
(用含 、
、 、
、 的代数式表示,
的代数式表示, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(5)工序②生成的气体
 为可燃性气体,生成气体
为可燃性气体,生成气体 的反应方程式为
的反应方程式为(6)还原工序中通入氩气的目的是
(7)利用图4装置可获得金属钛。在较低的阴极电位下,
 中的氧解离进入熔融盐,最后只剩下纯钛,另一极产生
中的氧解离进入熔融盐,最后只剩下纯钛,另一极产生 、
、 和可燃性气体
和可燃性气体 。产生可燃性气体
。产生可燃性气体 的电极反应式为
的电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】工业上用硫化镍矿(主要成分为NiS,含有ZnS、CuS、FeS等杂质)制备 的工艺流程如下:
的工艺流程如下:
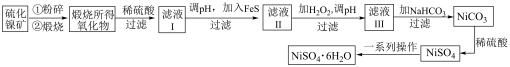
(1)将硫化镍矿粉碎的目的是___________ ,煅烧NiS生成NiO和 的化学方程式为
的化学方程式为___________ 。
(2)向滤液Ⅰ中加入FeS是为了生成难溶于水的硫化物沉淀而除去 、
、 等杂质,则除去
等杂质,则除去 的离子方程式为
的离子方程式为 ,该反应的化学平衡常数为
,该反应的化学平衡常数为___________ (已知 ,
, ,
, )。
)。
(3)往滤液Ⅲ中加入 溶液反应的离子方程式为
溶液反应的离子方程式为___________ 。
(4)滤液Ⅲ中溶质的主要成分是 ,加
,加 过滤后得到
过滤后得到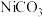 沉淀,再加适量稀硫酸溶解又生成
沉淀,再加适量稀硫酸溶解又生成 ,这两步操作的目的是
,这两步操作的目的是___________ 。
(5)用惰性电极电解 溶液时,在
溶液时,在___________ 极得到单质镍,另一电极的电极反应式为:___________ 。
 的工艺流程如下:
的工艺流程如下:
(1)将硫化镍矿粉碎的目的是
 的化学方程式为
的化学方程式为(2)向滤液Ⅰ中加入FeS是为了生成难溶于水的硫化物沉淀而除去
 、
、 等杂质,则除去
等杂质,则除去 的离子方程式为
的离子方程式为 ,该反应的化学平衡常数为
,该反应的化学平衡常数为 ,
, ,
, )。
)。(3)往滤液Ⅲ中加入
 溶液反应的离子方程式为
溶液反应的离子方程式为(4)滤液Ⅲ中溶质的主要成分是
 ,加
,加 过滤后得到
过滤后得到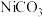 沉淀,再加适量稀硫酸溶解又生成
沉淀,再加适量稀硫酸溶解又生成 ,这两步操作的目的是
,这两步操作的目的是(5)用惰性电极电解
 溶液时,在
溶液时,在
您最近一年使用:0次



