按要求填写下列空白:
(1)Na2O2_____ (填是或不是)碱性氧化物,7.8g Na2O2中含________ 个阴离子;
(2)氯水中含氯粒子有___________________ (填粒子的化学式),氯水长时间放置最终变为_____ ;
(3)配平离子方程式:
___ ___Br-+____=____Cr3++____
___Br-+____=____Cr3++____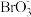 +____H2O
+____H2O_____
(4)标准状况下44.8mL的ClO2气体恰好能与50mL0.1mol/L的Na2SO3溶液完全反应生成Na2SO4,该反应的还原产物中氯元素的化合价为______

(5)“84消毒液”是一种以NaClO为主的高效消毒剂,被广泛用于宾馆、旅游、医院、食品加工行业、家庭等的卫生消毒。某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。某同学量取此“84消毒液”,按说明要求稀释后用于消毒,则稀释后的溶液中c(Na+)=_________ mol/L(保留两位有效数字)
(1)Na2O2
(2)氯水中含氯粒子有
(3)配平离子方程式:
___
 ___Br-+____=____Cr3++____
___Br-+____=____Cr3++____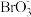 +____H2O
+____H2O(4)标准状况下44.8mL的ClO2气体恰好能与50mL0.1mol/L的Na2SO3溶液完全反应生成Na2SO4,该反应的还原产物中氯元素的化合价为

(5)“84消毒液”是一种以NaClO为主的高效消毒剂,被广泛用于宾馆、旅游、医院、食品加工行业、家庭等的卫生消毒。某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。某同学量取此“84消毒液”,按说明要求稀释后用于消毒,则稀释后的溶液中c(Na+)=
更新时间:2020-11-28 20:47:24
|
相似题推荐
【推荐1】已知锌跟浓硫酸反应生成SO2,跟稀硫酸反应生成H2。使一定量的锌与100mL18.5mol·L-1浓硫酸充分反应,锌完全溶解,同时收集到标准状况下的气体A33.6L。将反应后的溶液稀释到1L,测得溶液中氢离子的浓度为0.1mol·L-1。
(1)写出锌跟浓硫酸反应的化学方程式:____ 。
(2)反应过程中消耗的H2SO4的物质的量是____ 。
(3)气体A的成分是____ ,各成分的体积比是____ 。
(4)反应过程中消耗的锌的质量是____ 。
(1)写出锌跟浓硫酸反应的化学方程式:
(2)反应过程中消耗的H2SO4的物质的量是
(3)气体A的成分是
(4)反应过程中消耗的锌的质量是
您最近一年使用:0次
计算题
|
较易
(0.85)
【推荐2】将5.6克铁投入足量的硫酸铜溶液中充分反应,求生成硫酸亚铁的物质的量和生成铜的质量。
您最近一年使用:0次
计算题
|
较易
(0.85)
名校
【推荐3】质量、物质的量、物质的量浓度、气体体积等是用于化学计算的常见物理量。
(1)质量之比为16:7:6的三种气体 、
、 、
、 。分子个数之比为
。分子个数之比为___________ ;氧原子个数之比为___________ ;相同条件下的体积之比为___________ 。
(2)在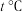 时将ag
时将ag ,完全溶于水得到VmL溶液,该溶液的密度为
,完全溶于水得到VmL溶液,该溶液的密度为 (
(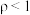 );质量分数为w,物质的量浓度为
);质量分数为w,物质的量浓度为 。下列计算结果正确的是___________。
。下列计算结果正确的是___________。
(3)将aL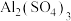 和
和 的混合溶液分成两等份,一份加入bmol
的混合溶液分成两等份,一份加入bmol 溶液使溶液中的
溶液使溶液中的 刚好完全沉淀,另一份加入足量
刚好完全沉淀,另一份加入足量 溶液并加热可得到cmol
溶液并加热可得到cmol ,则原溶液中
,则原溶液中 的物质的量浓度为
的物质的量浓度为___________ 。
(4)ag镁铝合金投入xmL2 mol∙L−1的盐酸中,一段时间后金属完全溶解,再加入ymL l mol∙L−1的 溶液,沉淀达到最大值,其质量为
溶液,沉淀达到最大值,其质量为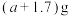 ,产生的
,产生的 在标准状况下体积为
在标准状况下体积为___________ L。
(5)汽车剧烈碰撞时,安全气囊中发生反应: 。该反应中氧化产物与还原产物的质量比为
。该反应中氧化产物与还原产物的质量比为___________ ;若氧化产物比还原产物多19.6g,则反应生成的 在标准状况下的体积为
在标准状况下的体积为___________ L。
(1)质量之比为16:7:6的三种气体
 、
、 、
、 。分子个数之比为
。分子个数之比为(2)在
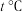 时将ag
时将ag ,完全溶于水得到VmL溶液,该溶液的密度为
,完全溶于水得到VmL溶液,该溶液的密度为 (
(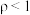 );质量分数为w,物质的量浓度为
);质量分数为w,物质的量浓度为 。下列计算结果正确的是___________。
。下列计算结果正确的是___________。A.溶质的质量分数 |
B.溶质的物质的量浓度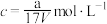 |
C.溶液密度 可表示为 可表示为 |
| D.上述溶液中再加入VmL水,所得溶液溶质的质量分数小于0.5w |
(3)将aL
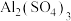 和
和 的混合溶液分成两等份,一份加入bmol
的混合溶液分成两等份,一份加入bmol 溶液使溶液中的
溶液使溶液中的 刚好完全沉淀,另一份加入足量
刚好完全沉淀,另一份加入足量 溶液并加热可得到cmol
溶液并加热可得到cmol ,则原溶液中
,则原溶液中 的物质的量浓度为
的物质的量浓度为(4)ag镁铝合金投入xmL2 mol∙L−1的盐酸中,一段时间后金属完全溶解,再加入ymL l mol∙L−1的
 溶液,沉淀达到最大值,其质量为
溶液,沉淀达到最大值,其质量为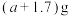 ,产生的
,产生的 在标准状况下体积为
在标准状况下体积为(5)汽车剧烈碰撞时,安全气囊中发生反应:
 。该反应中氧化产物与还原产物的质量比为
。该反应中氧化产物与还原产物的质量比为 在标准状况下的体积为
在标准状况下的体积为
您最近一年使用:0次
【推荐1】某实验小组向100ml ,溶液中逐渐通入
,溶液中逐渐通入 ,其中溶液中
,其中溶液中 、
、 的物质的量随通入的
的物质的量随通入的 的物质的量变化如图所示(不考虑与水的反应)。
的物质的量变化如图所示(不考虑与水的反应)。

请回答:
(1)物质 的量浓度为
的量浓度为_________  .
.
(2)当通入0.12mol 时,溶液中:
时,溶液中: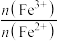
____________ 。
(3)通入足量氯气反应的化学方程式为:________________________________________________ 。
 ,溶液中逐渐通入
,溶液中逐渐通入 ,其中溶液中
,其中溶液中 、
、 的物质的量随通入的
的物质的量随通入的 的物质的量变化如图所示(不考虑与水的反应)。
的物质的量变化如图所示(不考虑与水的反应)。
请回答:
(1)物质
 的量浓度为
的量浓度为 .
. (2)当通入0.12mol
 时,溶液中:
时,溶液中: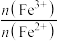
(3)通入足量氯气反应的化学方程式为:
您最近一年使用:0次
计算题
|
较易
(0.85)
解题方法
【推荐2】汽车受到猛烈撞击时,气囊内的 会发生分解反应生成Na和
会发生分解反应生成Na和 ;
;
(1)写出上述气囊内的 发生反应的化学反应方程式:
发生反应的化学反应方程式:______ .
(2)能保护司机不受伤害的某气囊需要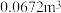 (已折算到标准状况下)的
(已折算到标准状况下)的 ,列式计算该气囊中需要装入
,列式计算该气囊中需要装入 的质量
的质量____ (写出计算过程)
 会发生分解反应生成Na和
会发生分解反应生成Na和 ;
;(1)写出上述气囊内的
 发生反应的化学反应方程式:
发生反应的化学反应方程式:(2)能保护司机不受伤害的某气囊需要
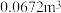 (已折算到标准状况下)的
(已折算到标准状况下)的 ,列式计算该气囊中需要装入
,列式计算该气囊中需要装入 的质量
的质量
您最近一年使用:0次
计算题
|
较易
(0.85)
名校
解题方法
【推荐1】将7.8g Na2O2投入一定量的水中,完全反应后得到溶液的体积为500mL,计算:
(1)生成气体在标准状况下的体积____
(2)反应后溶液的物质的量浓度(本题要求写出计算过程)_____
(1)生成气体在标准状况下的体积
(2)反应后溶液的物质的量浓度(本题要求写出计算过程)
您最近一年使用:0次
计算题
|
较易
(0.85)
名校
【推荐2】将4.34g由Na、Na2O、Na2O2组成的混合物加入到足量的水中充分反应,在标准状况下得到672mL混合气体,将该混合气体放电引燃,恰好完全反应。求混合物中三种物质的物质的量(写出计算过程)。
您最近一年使用:0次
计算题
|
较易
(0.85)
名校
【推荐1】若将7.8g过氧化钠投入足量水中,求生成NaOH的物质的量和所生成的O2在标准状况下的体积。(要求写出计算过程)__________
您最近一年使用:0次
计算题
|
较易
(0.85)
解题方法
【推荐2】将14gNa2O和Na2O2的混合物加入足量的水充分反应后,生成标准状况下的气体1.12L,所得溶液的体积为400mL。试计算:
(1)原混合物中Na2O的质量为___________ 。
(2)该溶液在80℃时吸收一定量Cl2后,溶液中的溶质只有NaCl,NaClO和NaClO3,则吸收的氯气物质的量为___________ 。
(1)原混合物中Na2O的质量为
(2)该溶液在80℃时吸收一定量Cl2后,溶液中的溶质只有NaCl,NaClO和NaClO3,则吸收的氯气物质的量为
您最近一年使用:0次

 与
与 按物质的量
按物质的量 恰好完全反应,生成的产物能使淀粉溶液变蓝,请完成下列离子方程式的填空与配平。
恰好完全反应,生成的产物能使淀粉溶液变蓝,请完成下列离子方程式的填空与配平。

