已知[Co(H2O)6]2+呈粉红色,[CoCl4]2-呈蓝色,[ZnCl4]2-为无色。现将CoCl2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡: 。用该溶液做实验,溶液的颜色变化如图:
。用该溶液做实验,溶液的颜色变化如图:
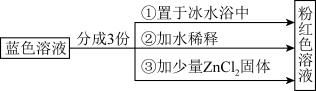
以下结论和解释正确的是( )
 。用该溶液做实验,溶液的颜色变化如图:
。用该溶液做实验,溶液的颜色变化如图:
以下结论和解释正确的是( )
| A.由实验①可推知正反应的△H>0 |
| B.实验②是由于c(H2O)增大,导致平衡逆向移动 |
| C.由实验③可知配离子的稳定性:[ZnCl4]2->[CoCl4]2- |
| D.原蓝色溶液中加入少量NaCl固体,实验现象与实验③相同 |
更新时间:2020-11-30 14:20:08
|
相似题推荐
多选题
|
较难
(0.4)
名校
解题方法
【推荐1】常温下,0.1mol/LH2C2O4水溶液中存在H2C2O4、HC2O4-和C2O42-三种形态含碳粒子,用NaOH或HCl调节该溶液的pH,三种含碳粒子的分布系数δ随溶液pH变化的关系如图[已知:a=1.35,b=4.17,Ksp(CaC2O4)=2.3×10-9,忽略溶液体积变化]。下列说法正确的是( )
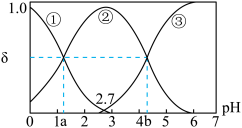

| A.pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-) |
| B.已知pKa=-lgKa,则pKa2(H2C2O4)=4.17 |
| C.0.1mol·L-1NaHC2O4溶液中:c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4) |
| D.一定温度下往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)不变 |
您最近一年使用:0次
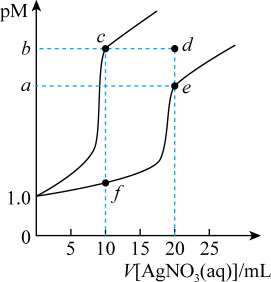
【推荐2】常温下,分别向体积均为10mL,浓度均为0.1mol·L-1的KSCN溶液、K2CrO4溶液滴加0.1mol·L-1AgNO3溶液,溶液中酸根离子浓度负对数(pM)与AgNO3溶液体积的关系如图[已知:pM=-lg(SCN-)或-lgc(CrO )]。下列说法正确的是
)]。下列说法正确的是
 )]。下列说法正确的是
)]。下列说法正确的是
| A.溶解度:AgSCN>Ag2CrO4 | B.Ksp(Ag2CrO4)=4×10-3a |
| C.d点Ag2CrO4溶液是不饱和溶液 | D.c(Ag+):f点溶液>e点溶液 |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
【推荐1】以红土镍矿(主要含有Fe2O3、FeO、NiO、SiO2等)为原料,获取净水剂黄钠铁矾[NaFe3(SO4)2(OH)6]和纳米镍粉的部分工艺流程如图:
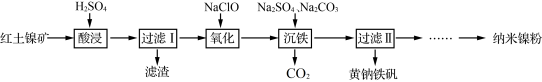
已知:
①Fe3+在pH约为3.7时可完全转化为Fe(OH)3,Fe2+在pH约为9时可完全转化为Fe(OH)2;
②SiO2为不溶于水的酸性氧化物,常温下和硫酸不反应,但可以溶于强碱溶液。
下列说法不正确的是

已知:
①Fe3+在pH约为3.7时可完全转化为Fe(OH)3,Fe2+在pH约为9时可完全转化为Fe(OH)2;
②SiO2为不溶于水的酸性氧化物,常温下和硫酸不反应,但可以溶于强碱溶液。
下列说法不正确的是
| A.“滤渣”的主要成分是SiO2 |
| B.为提高“酸浸”速率,可将稀硫酸更换为浓硫酸 |
| C.“氧化”过程发生的离子方程式为:2H++2Fe2++ClO-=2Fe3++Cl-+H2O |
| D.“沉铁”过程中加入碳酸钠的作用是调节溶液的酸碱度,应将pH控制在3.7~9 |
您最近一年使用:0次
多选题
|
较难
(0.4)
名校
【推荐2】工业上用氨水作为沉淀剂去除酸性废水中的铅元素。除铅时,体系中含铅微粒的物质的量分数与溶液pH的关系如图。【已知:Pb(OH)2难溶于水】
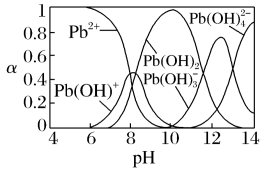
下列说法不正确的是

下列说法不正确的是
A.氨水中:c(NH )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
| B.pH=9废水中的只含铅微粒有Pb2+、Pb(OH)+ |
C.pH=12时,溶液中的离子有且仅有Pb(OH) 、Pb(OH) 、Pb(OH) 、OH-和H+ 、OH-和H+ |
| D.pH=10时,除铅效果最好 |
您最近一年使用:0次
多选题
|
较难
(0.4)
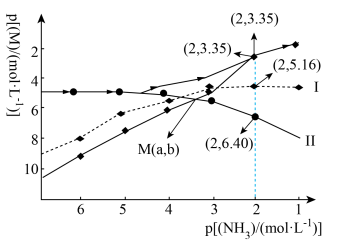
【推荐3】向 悬浊液(
悬浊液( 固体足量)中滴加氨水,发生反应
固体足量)中滴加氨水,发生反应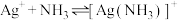 和
和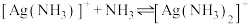 ,已知
,已知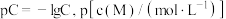 与
与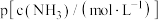 的关系如下图所示(其中M代表
的关系如下图所示(其中M代表 、
、 、
、 或
或 )。下列说法正确的是
)。下列说法正确的是
 悬浊液(
悬浊液( 固体足量)中滴加氨水,发生反应
固体足量)中滴加氨水,发生反应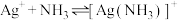 和
和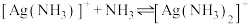 ,已知
,已知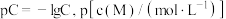 与
与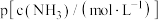 的关系如下图所示(其中M代表
的关系如下图所示(其中M代表 、
、 、
、 或
或 )。下列说法正确的是
)。下列说法正确的是
A.曲线Ⅱ表示 浓度随 浓度随 浓度变化 浓度变化 |
B.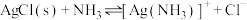 的平衡常数K的值为 的平衡常数K的值为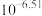 |
| C.图中M点的横坐标a=3.525 |
D.滴加氨水后溶液中: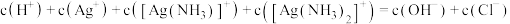 |
您最近一年使用:0次



