某研究性学习小组查阅资料发现,Na2O2与干燥的HCl气体能发生反应生成Cl2。现设计下列实验装置模拟该反应。实验中观察到的现象有:圆底烧瓶内有白雾,装置③中出现黄绿色气体。
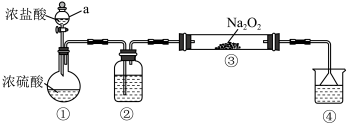
请回答:
(1)装置①中仪器a的名称是________ 。
(2)装置②的作用是_______ 。
(3)装置③中反应的化学方程式是_______ 。
(4)该小组同学想进一步通过实验验证装置③中产生的黄绿色气体中含有氯气,下列方案可行的是_________ 。
A.将气体通入AgNO3溶液中,观察有无白色沉淀产生
B.将气体通入放有湿润的淀粉-KI试纸的洗气瓶,观察试纸有无变蓝
C.将气体通入NaHCO3溶液中,观察有无气泡产生
D.将气体通入放有湿润的有色布条的洗气瓶,观察布条有无褪色
(5)装置④的作用是尾气处理,下列试剂可以选用的是______ 。
A.饱和食盐水 B.蒸馏水 C.NaOH溶液 D.饱和Na2CO3溶液

请回答:
(1)装置①中仪器a的名称是
(2)装置②的作用是
(3)装置③中反应的化学方程式是
(4)该小组同学想进一步通过实验验证装置③中产生的黄绿色气体中含有氯气,下列方案可行的是
A.将气体通入AgNO3溶液中,观察有无白色沉淀产生
B.将气体通入放有湿润的淀粉-KI试纸的洗气瓶,观察试纸有无变蓝
C.将气体通入NaHCO3溶液中,观察有无气泡产生
D.将气体通入放有湿润的有色布条的洗气瓶,观察布条有无褪色
(5)装置④的作用是尾气处理,下列试剂可以选用的是
A.饱和食盐水 B.蒸馏水 C.NaOH溶液 D.饱和Na2CO3溶液
20-21高一上·浙江台州·期末 查看更多[3]
更新时间:2021-01-26 11:04:25
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】如表为元素周期表的一部分,请回答有关问题:
(1)已知元素⑩的一种核素,其中子数为45,用原子符号表示该核素为___ 。
(2)由元素②和④形成的三核直线形分子的结构式为___ 。
(3)由上述元素①和④形成的一种绿色氧化剂的电子式为___ ,该化合物所含的化学键类型为___ (填“离子键”、“极性键”或“非极性键”)。
(4)若将元素④和⑤组成的一种淡黄色固体投入到含有下列离子的溶液中: 、
、 、
、 、Na+。反应完毕后,溶液中上述离子数目几乎不变的有
、Na+。反应完毕后,溶液中上述离子数目几乎不变的有__ (填离子符号)。
(5)能比较元素⑦和⑧非金属性强弱的实验事实是__ (填字母序号)。
a.⑦的氢化物的酸性比⑧的氢化物的酸性弱
b.⑧的单质R2与H2化合比⑦的单质Q与H2化合容易,且HR的稳定性比H2Q强
c.在⑦的氢化物H2Q的水溶液中通少量⑧的单质R2气体可置换出单质Q
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | ⑩ |
(2)由元素②和④形成的三核直线形分子的结构式为
(3)由上述元素①和④形成的一种绿色氧化剂的电子式为
(4)若将元素④和⑤组成的一种淡黄色固体投入到含有下列离子的溶液中:
 、
、 、
、 、Na+。反应完毕后,溶液中上述离子数目几乎不变的有
、Na+。反应完毕后,溶液中上述离子数目几乎不变的有(5)能比较元素⑦和⑧非金属性强弱的实验事实是
a.⑦的氢化物的酸性比⑧的氢化物的酸性弱
b.⑧的单质R2与H2化合比⑦的单质Q与H2化合容易,且HR的稳定性比H2Q强
c.在⑦的氢化物H2Q的水溶液中通少量⑧的单质R2气体可置换出单质Q
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】Na2O2可用作漂白剂和呼吸面具中的供氧剂。
(1)某学习小组发现:在盛有Na2O2的试管中加入足量水,固体完全溶解,并立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞溶液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量MnO2粉末,又有气泡产生。请写出加入MnO2反应的化学方程式为__________________________ 。
(2)Na2O2有强氧化性,H2具有还原性,有同学猜想Na2O2与H2能反应.为了验证此猜想,该小组同学进行如下实验,实验步骤和现象如下。
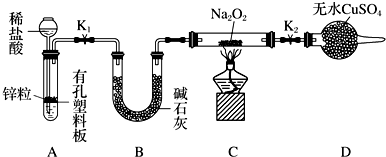
步骤1:按图组装仪器(图中夹持仪器省略),检查气密性,装入药品。
步骤2:打开K1、K2,产生的氢气流经装有Na2O2的硬质玻璃管,一段时间后,没有任何现象。
步骤3:检验H2的纯度后,开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色。
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1。
①添加稀盐酸的仪器名称是_______________ 。
②必须检验氢气纯度的原因是___________________ 。
③设置装置D的目的是_________________________________________ 。
④你得到的结论是___________________________________________________ (若能反应请用化学方程式表示)。
(1)某学习小组发现:在盛有Na2O2的试管中加入足量水,固体完全溶解,并立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞溶液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量MnO2粉末,又有气泡产生。请写出加入MnO2反应的化学方程式为
(2)Na2O2有强氧化性,H2具有还原性,有同学猜想Na2O2与H2能反应.为了验证此猜想,该小组同学进行如下实验,实验步骤和现象如下。

步骤1:按图组装仪器(图中夹持仪器省略),检查气密性,装入药品。
步骤2:打开K1、K2,产生的氢气流经装有Na2O2的硬质玻璃管,一段时间后,没有任何现象。
步骤3:检验H2的纯度后,开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色。
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1。
①添加稀盐酸的仪器名称是
②必须检验氢气纯度的原因是
③设置装置D的目的是
④你得到的结论是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】过氧化钙是一种白色固体,微溶于冷水,不溶于乙醇,化学性质与过氧化钠类似。某学习小组设计在碱性环境中利用CaCl2与H2O2反应制取CaO2·8H2O,装置如下图所示:
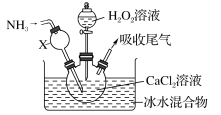
回答下列问题:
(1)小组同学查阅文献得知:该实验用质量分数为20%的H2O2溶液最为适宜。市售H2O2溶液的质量分数为30%。该小组同学用市售H2O2溶液配制约20%的H2O2溶液的过程中,使用的玻璃仪器除玻璃棒、胶头滴管外,还有___________ 。
(2)仪器X的主要作用除导气外,还具有的作用是_________ 。
(3)在冰水浴中进行的原因是_________ 。
(4)实验时,在三颈烧瓶中析出CaO2·8H2O晶体,总反应的离子方程式为_________ 。
(5)反应结束后,经过滤、洗涤、低温烘干获得CaO2·8H2O。下列试剂中,洗涤CaO2·8H2O的最佳选择是_______ 。
A.无水乙醇 B.浓盐酸 C.Na2SO3溶液 D.CaCl2溶液
(6)若CaCl2原料中含有Fe3+杂质,Fe3+催化分解H2O2,会使H2O2的利用率明显降低。反应的机理为:
①Fe3++H2O2===Fe2++H++HOO·
②H2O2+X===Y+Z+W(已配平)
③Fe2++·OH===Fe3++OH-
④H++OH-===H2O
根据上述机理推导步骤②中的化学方程式为____________ 。
(7)如图所示装置,安全漏斗在实验中的作用除了滴加液体外,还有______________ 。
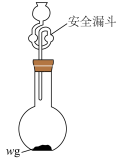

回答下列问题:
(1)小组同学查阅文献得知:该实验用质量分数为20%的H2O2溶液最为适宜。市售H2O2溶液的质量分数为30%。该小组同学用市售H2O2溶液配制约20%的H2O2溶液的过程中,使用的玻璃仪器除玻璃棒、胶头滴管外,还有
(2)仪器X的主要作用除导气外,还具有的作用是
(3)在冰水浴中进行的原因是
(4)实验时,在三颈烧瓶中析出CaO2·8H2O晶体,总反应的离子方程式为
(5)反应结束后,经过滤、洗涤、低温烘干获得CaO2·8H2O。下列试剂中,洗涤CaO2·8H2O的最佳选择是
A.无水乙醇 B.浓盐酸 C.Na2SO3溶液 D.CaCl2溶液
(6)若CaCl2原料中含有Fe3+杂质,Fe3+催化分解H2O2,会使H2O2的利用率明显降低。反应的机理为:
①Fe3++H2O2===Fe2++H++HOO·
②H2O2+X===Y+Z+W(已配平)
③Fe2++·OH===Fe3++OH-
④H++OH-===H2O
根据上述机理推导步骤②中的化学方程式为
(7)如图所示装置,安全漏斗在实验中的作用除了滴加液体外,还有

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】我国化工专家侯德榜改进氨碱法设计了“联合制碱法”,为世界制碱工业作出了突出贡献。生产流程如图1:
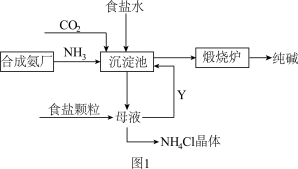

(1)写出“沉淀池”中的化学方程式_____ 。
(2)向母液中加入NaCl粉末,目的是_____ 。
(3)根据NaCl和NH4Cl溶解度曲线(如图2),得到较多NH4Cl晶体时应采用的操作为_____ 、过滤、洗涤、干燥。
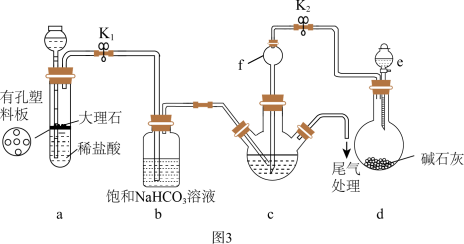
(4)设计如图3所示装置(夹持装置略)模拟制碱工艺。
①将下列实验操作排序:_____ 。
A.打开止水夹K2和e的分液漏斗的活塞,通气一段时间
B.检查装置气密性后加入相应药品,连接装置
C.打开止水夹K1,通气一段时间
D.过滤、洗涤、干燥
②f装置作用为_____ 。
③停止a装置中反应的操作是_____ 。
(5)为测定产品纯碱的成分和含量,做如下实验(假设产品纯碱中只含NaCl、NaHCO3杂质):
i.检验产品中NaCl的试剂为_____ 。
ii.滴定法测定产品中NaHCO3含量:准确称取纯碱样品wg,放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用cmol∙L−1盐酸滴定,起始读数为0,当滴至溶液由红色变为无色时(指 +H+=
+H+= 的反应终点),读数为amL,再加1~2滴甲基橙指示剂,继续用该盐酸滴定,滴至溶液由黄色变为橙色时,读数为bmL。则纯碱样品中NaHCO3质量分数为
的反应终点),读数为amL,再加1~2滴甲基橙指示剂,继续用该盐酸滴定,滴至溶液由黄色变为橙色时,读数为bmL。则纯碱样品中NaHCO3质量分数为_____ %(用含a,b,c,w的代数式表示)。



(1)写出“沉淀池”中的化学方程式
(2)向母液中加入NaCl粉末,目的是
(3)根据NaCl和NH4Cl溶解度曲线(如图2),得到较多NH4Cl晶体时应采用的操作为
(4)设计如图3所示装置(夹持装置略)模拟制碱工艺。
①将下列实验操作排序:
A.打开止水夹K2和e的分液漏斗的活塞,通气一段时间
B.检查装置气密性后加入相应药品,连接装置
C.打开止水夹K1,通气一段时间
D.过滤、洗涤、干燥
②f装置作用为
③停止a装置中反应的操作是
(5)为测定产品纯碱的成分和含量,做如下实验(假设产品纯碱中只含NaCl、NaHCO3杂质):
i.检验产品中NaCl的试剂为
ii.滴定法测定产品中NaHCO3含量:准确称取纯碱样品wg,放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用cmol∙L−1盐酸滴定,起始读数为0,当滴至溶液由红色变为无色时(指
 +H+=
+H+= 的反应终点),读数为amL,再加1~2滴甲基橙指示剂,继续用该盐酸滴定,滴至溶液由黄色变为橙色时,读数为bmL。则纯碱样品中NaHCO3质量分数为
的反应终点),读数为amL,再加1~2滴甲基橙指示剂,继续用该盐酸滴定,滴至溶液由黄色变为橙色时,读数为bmL。则纯碱样品中NaHCO3质量分数为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】元素铬及其化合物工业用途广泛,但含+ 6价铬的污水会损害环境,必须进行处理。下图为某工厂处理含铬废水工艺流程:

回答下列问题:
(1)请写出N2H4的电子式:________ 。
(2)下列溶液中可以代替上述流程中N2H4的是________ (填选项序号)。
A.FeSO4溶液 B.浓HNO3溶液 C.酸性KMnO4溶液 D.Na2SO3溶液
(3)已知加入N2H4的工序中,N2H4转化为无污染的物质,则该反应中氧化剂与还原剂的物质的量之比为______________________ 。
(4)Cr(OH)3的化学性质与Al(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,否则会导致___________________________ (用离子方程式表示)。
(5)实际工业生产中,有时还采用阳离子交换树脂法来测定沉淀后溶液中Cr3+的含量,其原理是Mn++nNaR=nNa++MRn,其中NaR为阳离子交换树脂,Mn+为要测定的离子。常温下,将沉淀后的溶液(此时溶液pH=5)经过阳离子交换树脂后,测得溶液中Na+比交换前增加了0.046 g·L-1,则该条件下Cr(OH)3的Ksp的值为______________________ 。
(6)在含铬废水实际处理中,还可采用直接沉淀的方法,处理成本较低。已知在含铬废水中存在Cr2O72-和CrO42-相互转化平衡,请用离子方程式表示它们之间的转化反应:______________________________ ;

回答下列问题:
(1)请写出N2H4的电子式:
(2)下列溶液中可以代替上述流程中N2H4的是
A.FeSO4溶液 B.浓HNO3溶液 C.酸性KMnO4溶液 D.Na2SO3溶液
(3)已知加入N2H4的工序中,N2H4转化为无污染的物质,则该反应中氧化剂与还原剂的物质的量之比为
(4)Cr(OH)3的化学性质与Al(OH)3相似。在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,否则会导致
(5)实际工业生产中,有时还采用阳离子交换树脂法来测定沉淀后溶液中Cr3+的含量,其原理是Mn++nNaR=nNa++MRn,其中NaR为阳离子交换树脂,Mn+为要测定的离子。常温下,将沉淀后的溶液(此时溶液pH=5)经过阳离子交换树脂后,测得溶液中Na+比交换前增加了0.046 g·L-1,则该条件下Cr(OH)3的Ksp的值为
(6)在含铬废水实际处理中,还可采用直接沉淀的方法,处理成本较低。已知在含铬废水中存在Cr2O72-和CrO42-相互转化平衡,请用离子方程式表示它们之间的转化反应:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某同学用废干电池内的黑色固体(可能含有MnO2、NH4Cl、ZnCl2等物质)进行如图所示实验:
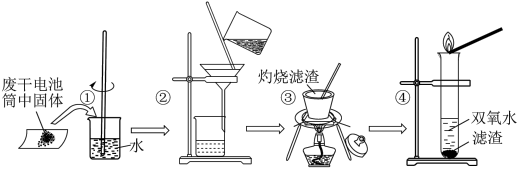
(1)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、____________ 、____________ 、_________________ 等(只需答出三种仪器即可);
(2)操作④的试管加入③中所得滤渣,试管中迅速产生能使带火星的木条复燃的气体,由此推测滤渣可能为MnO2,试管中发生反应的化学方程式:_______________________ ;
(3)操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中除含有MnO2外,还存在的物质为:_____________________________ 。
(4)已知氯化锌与稀氨水反应先生成Zn(OH)2白色沉淀,Zn(OH)2可以溶于稀氨水生成可溶性的Zn(NH3)4(OH)2;下列是该同学对操作②的滤液主次成分进行探究的过程:
[猜想Ⅰ]:主要成分为氯化铵;
[验证(操作)过程]:取少量滤液加入NaOH固体,并加热;
[实验现象]:闻到有轻微的氨味;
[判断猜想]:_____________________ (填“猜想Ⅰ成立”或“猜想Ⅰ不成立”);
[猜想Ⅱ]:主要成分为氯化锌;
[验证(操作)过程]:______________________________________ ;
[实验现象]:______________________________________________ ;
[判断猜想]:猜想Ⅱ成立;由上述实验得出结论:
操作②的滤液中的主要成分为:________________ ;次要成分为:___________ 。

(1)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、
(2)操作④的试管加入③中所得滤渣,试管中迅速产生能使带火星的木条复燃的气体,由此推测滤渣可能为MnO2,试管中发生反应的化学方程式:
(3)操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测滤渣中除含有MnO2外,还存在的物质为:
(4)已知氯化锌与稀氨水反应先生成Zn(OH)2白色沉淀,Zn(OH)2可以溶于稀氨水生成可溶性的Zn(NH3)4(OH)2;下列是该同学对操作②的滤液主次成分进行探究的过程:
[猜想Ⅰ]:主要成分为氯化铵;
[验证(操作)过程]:取少量滤液加入NaOH固体,并加热;
[实验现象]:闻到有轻微的氨味;
[判断猜想]:
[猜想Ⅱ]:主要成分为氯化锌;
[验证(操作)过程]:
[实验现象]:
[判断猜想]:猜想Ⅱ成立;由上述实验得出结论:
操作②的滤液中的主要成分为:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】氨在人类生产生活中有着广泛应用,某化学兴趣小组探究氨气的性质。
(1)氮的氧化物是主要的大气污染物,对大气的影响之一是导致酸雨。用化学方程式表示NO₂形成酸雨的原因_______ ,该反应中氧化剂和还原剂的物质的量之比为_______ 。
(2)实验室常用的几种气体发生装置如图A、B、C所示:

①写出实验室用装置B制备氨气的化学方程式_______ 。
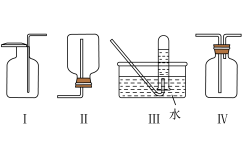
②如图是某学生设计收集氨气的几种装置,其中可行的是_______ 。
(3)该兴趣小组用如图2装置制备氨气,并探究氨气的还原性并检验产物。

①实验现象为:黑色CuO变为红色;白色无水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式_______ 。
②该装置中碱石灰的作用是干燥氨气,无水CuSO4检验反应中有水生成,该装置存在明显缺陷,请提出改进意见_______ 。
(1)氮的氧化物是主要的大气污染物,对大气的影响之一是导致酸雨。用化学方程式表示NO₂形成酸雨的原因
(2)实验室常用的几种气体发生装置如图A、B、C所示:

①写出实验室用装置B制备氨气的化学方程式
②如图是某学生设计收集氨气的几种装置,其中可行的是

(3)该兴趣小组用如图2装置制备氨气,并探究氨气的还原性并检验产物。

①实验现象为:黑色CuO变为红色;白色无水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式
②该装置中碱石灰的作用是干燥氨气,无水CuSO4检验反应中有水生成,该装置存在明显缺陷,请提出改进意见
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某学习小组探究铜跟浓硫酸的反应时,利用如图实验装置进行相关实验。
按要求填写下列空白:
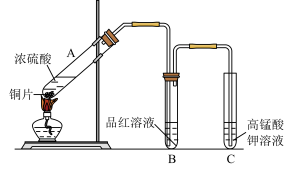
(1)装置A中发生的化学反应方程式为___________ 。
(2)实验过程中装置C中溶液褪色说明装置A中产生的气体具有___________ 性。
(3)有学生提出装置C的试管口还应放置一团浸有NaOH溶液的棉花,其目的是___________ 。
(4)实验结束拆开装置后,加热装置B的试管,观察到的现象是___________ 。
(5)根据氮及其化合物 转化关系回答下列问题:
转化关系回答下列问题:
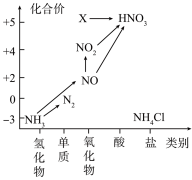
①X的化学式为___________ ,从化合价上看,X具有___________ 性(填“氧化”或“还原”)。
②写出实验制取氨气的化学方程式___________ ;
③下列试剂不能用于干燥NH3的是___________ (填字母)。
A.浓硫酸 B.碱石灰 C.NaOH固体
④NH3→NO的化学方程式为___________ 。
按要求填写下列空白:

(1)装置A中发生的化学反应方程式为
(2)实验过程中装置C中溶液褪色说明装置A中产生的气体具有
(3)有学生提出装置C的试管口还应放置一团浸有NaOH溶液的棉花,其目的是
(4)实验结束拆开装置后,加热装置B的试管,观察到的现象是
(5)根据氮及其化合物
 转化关系回答下列问题:
转化关系回答下列问题:
①X的化学式为
②写出实验制取氨气的化学方程式
③下列试剂不能用于干燥NH3的是
A.浓硫酸 B.碱石灰 C.NaOH固体
④NH3→NO的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】下图为苯和溴的取代反应的实验装置图,其中A为由具有支管的试管制成的反应容器,在其下端开了一个小孔,塞好石棉绒,再加入少量铁屑粉。
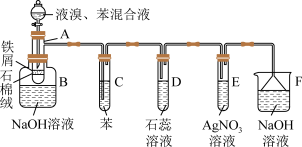
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯,发生反应。写出A中所发生反应的化学方程式:___________________________________________________________ 。
(2)试管观察D中看到的现象为____________________________________ 。
(3)在上述整套装置中,具有防倒吸作用的仪器有____________ (填字母)。

填写下列空白:
(1)向反应容器A中逐滴加入溴和苯,发生反应。写出A中所发生反应的化学方程式:
(2)试管观察D中看到的现象为
(3)在上述整套装置中,具有防倒吸作用的仪器有
您最近一年使用:0次



