I.通过计算回答下列有关沉淀溶解平衡的问题。
向50mL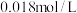 的
的 溶液中加入50mL
溶液中加入50mL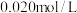 的
的 溶液,生成沉淀。已知该温度下
溶液,生成沉淀。已知该温度下 的
的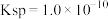 ,忽略溶液混合的体积变化,已知
,忽略溶液混合的体积变化,已知 ,请回答:
,请回答:
(1)两溶液充分混合后溶液的
_______ 。
(2)完全沉淀后,溶液中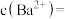
_______ 。
Ⅱ.亚氯酸钠( )常用于纺织、造纸等行业,在工业生产中十分重要,现有一份含有杂质的亚氯酸钠样品,欲测量亚氯酸钠的纯度。
)常用于纺织、造纸等行业,在工业生产中十分重要,现有一份含有杂质的亚氯酸钠样品,欲测量亚氯酸钠的纯度。
准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250mL待测溶液。移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol/L 标准溶液滴定至终点,重复2次,测得消耗
标准溶液滴定至终点,重复2次,测得消耗 标准溶液的平均值为VmL。(已知:杂质不参与反应,
标准溶液的平均值为VmL。(已知:杂质不参与反应,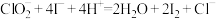 、
、 )
)
(1)达到滴定终点时的现象为_______ 。
(2)下列滴定过程中测量结果偏高的是( )
A.滴定前滴定管尖嘴有气泡,滴定终点时尖嘴气泡消失
B.滴定管用蒸馏水洗净后没有用标准液润洗
C.滴定前仰视滴定管刻度,滴定后俯视滴定管刻度
D.锥形瓶用蒸馏水洗净后未干燥
(3)该样品中 的质量分数为
的质量分数为_______ (用含m、c、V的代数式表示)。
向50mL
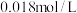 的
的 溶液中加入50mL
溶液中加入50mL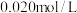 的
的 溶液,生成沉淀。已知该温度下
溶液,生成沉淀。已知该温度下 的
的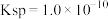 ,忽略溶液混合的体积变化,已知
,忽略溶液混合的体积变化,已知 ,请回答:
,请回答:(1)两溶液充分混合后溶液的

(2)完全沉淀后,溶液中
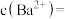
Ⅱ.亚氯酸钠(
 )常用于纺织、造纸等行业,在工业生产中十分重要,现有一份含有杂质的亚氯酸钠样品,欲测量亚氯酸钠的纯度。
)常用于纺织、造纸等行业,在工业生产中十分重要,现有一份含有杂质的亚氯酸钠样品,欲测量亚氯酸钠的纯度。准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250mL待测溶液。移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol/L
 标准溶液滴定至终点,重复2次,测得消耗
标准溶液滴定至终点,重复2次,测得消耗 标准溶液的平均值为VmL。(已知:杂质不参与反应,
标准溶液的平均值为VmL。(已知:杂质不参与反应,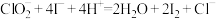 、
、 )
)(1)达到滴定终点时的现象为
(2)下列滴定过程中测量结果偏高的是
A.滴定前滴定管尖嘴有气泡,滴定终点时尖嘴气泡消失
B.滴定管用蒸馏水洗净后没有用标准液润洗
C.滴定前仰视滴定管刻度,滴定后俯视滴定管刻度
D.锥形瓶用蒸馏水洗净后未干燥
(3)该样品中
 的质量分数为
的质量分数为
更新时间:2021-01-28 17:23:32
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】硫氰化钾( )俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示:
)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示: 不溶于水,密度比水的大;
不溶于水,密度比水的大;
② 不溶于
不溶于 ;
;
③三颈烧瓶内盛放有 、水和催化剂。
、水和催化剂。
回答下列问题:
制备 溶液:
溶液:
测定晶体中 的含量:称取10.0g样品,配成
的含量:称取10.0g样品,配成 溶液。量取
溶液。量取 溶液于锥形瓶中,加入适量稀硝酸,再加入几滴
溶液于锥形瓶中,加入适量稀硝酸,再加入几滴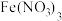 溶液作指示剂,用
溶液作指示剂,用
 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 标准溶液
标准溶液 。
。
(1)滴定时发生的反应: (白色)。则判断到达滴定终点的方法是
(白色)。则判断到达滴定终点的方法是_______ 。
(2)晶体中 的质量分数为
的质量分数为_______ (结果精确至0.1%)。
 )俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示:
)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示: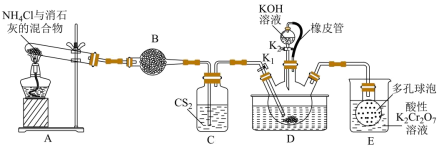
 不溶于水,密度比水的大;
不溶于水,密度比水的大;②
 不溶于
不溶于 ;
;③三颈烧瓶内盛放有
 、水和催化剂。
、水和催化剂。回答下列问题:
制备
 溶液:
溶液:测定晶体中
 的含量:称取10.0g样品,配成
的含量:称取10.0g样品,配成 溶液。量取
溶液。量取 溶液于锥形瓶中,加入适量稀硝酸,再加入几滴
溶液于锥形瓶中,加入适量稀硝酸,再加入几滴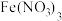 溶液作指示剂,用
溶液作指示剂,用
 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 标准溶液
标准溶液 。
。(1)滴定时发生的反应:
 (白色)。则判断到达滴定终点的方法是
(白色)。则判断到达滴定终点的方法是(2)晶体中
 的质量分数为
的质量分数为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】北京市场销售的某种食用精制盐包装袋上有如下说明:
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式_______(将化学计量数填于空白处)
_______ KIO3+_______ KI+_______ H2SO4=_______ K2SO4+_______ I2+_______ H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。已知Na2SO3稀溶液与I2反应后溶液显酸性,写出该反应的离子方程式_______ 。
(3)已知:I2+2S2O =2I-+S4O
=2I-+S4O 。某学生测定食用精制盐的碘含量,其步骤为:
。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是_______ 。
②b中反应所产生的I2的物质的量是_______ mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)_______ mg/kg。
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。已知Na2SO3稀溶液与I2反应后溶液显酸性,写出该反应的离子方程式
(3)已知:I2+2S2O
 =2I-+S4O
=2I-+S4O 。某学生测定食用精制盐的碘含量,其步骤为:
。某学生测定食用精制盐的碘含量,其步骤为:a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是
②b中反应所产生的I2的物质的量是
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】“84”消毒液,它是一种以次氯酸钠(NaClO)为有效成分的高效消毒剂。已知:Ka(HClO)=4.7×10-8Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11。回答下列问题:
(1)“84”消毒液溶液呈_______ 性,其原因是_______ 。
(2)浓度均为0.1mo/LNaClO、Na2CO3、NaHCO3的pH由大到小的是_______ 。
(3)测定“84"消毒液中NaCIO的物质的量浓度。
量取10.00mL“84"消毒液于锥形瓶中,加入过量的KI溶液,用足量的乙酸酸化,加入几滴指示剂,用0.5000mol/LNa2S2O3溶液滴定,滴定终点时耗Na2S2O3溶液25.00mL(三次平均值)。
①滴定时所用指示剂是_______ ,终点时的现象_______ 。
②该“84”清毒液中NaClO的物质的量浓度_______ mol/L。
(1)“84”消毒液溶液呈
(2)浓度均为0.1mo/LNaClO、Na2CO3、NaHCO3的pH由大到小的是
(3)测定“84"消毒液中NaCIO的物质的量浓度。
量取10.00mL“84"消毒液于锥形瓶中,加入过量的KI溶液,用足量的乙酸酸化,加入几滴指示剂,用0.5000mol/LNa2S2O3溶液滴定,滴定终点时耗Na2S2O3溶液25.00mL(三次平均值)。
①滴定时所用指示剂是
②该“84”清毒液中NaClO的物质的量浓度
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】回答下列问题:
(1)下列物质:①Cu;②SO2;③冰醋酸;④NaHCO3;⑤Cu(OH)2;⑥H2SO4溶液;⑦NaCl,属于非电解质的是____ (填序号),属于强电解质的是___ (填序号)。
(2)写出NaHCO3水解的离子方程式:____ 。
(3)已知Ksp[Cu(OH)2]=2×10-20,常温下某CuSO4溶液里,c(Cu2+)=2.0mol/L,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于____ 。
(4)现有25℃、pH=1的H2SO4溶液,该溶液的物质的量浓度为____ ,溶液中由水电离出的c(OH-)=____ 。
(5)方铅矿(PbS)遇CuSO4溶液生成铜蓝(CuS)的离子方程式:____ 。
(1)下列物质:①Cu;②SO2;③冰醋酸;④NaHCO3;⑤Cu(OH)2;⑥H2SO4溶液;⑦NaCl,属于非电解质的是
(2)写出NaHCO3水解的离子方程式:
(3)已知Ksp[Cu(OH)2]=2×10-20,常温下某CuSO4溶液里,c(Cu2+)=2.0mol/L,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于
(4)现有25℃、pH=1的H2SO4溶液,该溶液的物质的量浓度为
(5)方铅矿(PbS)遇CuSO4溶液生成铜蓝(CuS)的离子方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】25 ℃时,调节2.0×10-3 mol/L氢氟酸水溶液的pH(忽略体积变化),得到c(HF)、c(F-) 与溶液pH的变化关系如图所示。请结合图中信息回答下列问题:

(1)HF电离平衡常数的表达式:Ka=_________ 。室温下,向HF溶液中滴加NaOH溶液至pH=3.4时,c(F-)∶c(HF) =_______ 。HF 的电离常数值为_______ 。
(2)将4.0×10-3 mol/L的HF溶液与4.0×10-4 mol/L CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生:
______________________________ 。[ 已知Ksp(CaF2)=1.5×10-10 ]

(1)HF电离平衡常数的表达式:Ka=
(2)将4.0×10-3 mol/L的HF溶液与4.0×10-4 mol/L CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】氮、磷对水体的污染情况越来越受到人们的重视。回答下列问题:
(1)常温下,在 约为9时,用澄清石灰水可将水体中的
约为9时,用澄清石灰水可将水体中的 转化为
转化为 沉淀除去,该反应的离子方程式为
沉淀除去,该反应的离子方程式为_______ 。
(2)除去地下水中的硝态氮通常用还原剂将其还原为 。
。
①Prusse等提出的用 作催化剂,常温下,在
作催化剂,常温下,在 为4.0~6.0时,可直接用
为4.0~6.0时,可直接用 将
将 还原为
还原为 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。研究发现用 和
和 的混合气体代替
的混合气体代替 ,
, 的去除效果比只用
的去除效果比只用 时更好,其原因是
时更好,其原因是_______ 。
②在 约为5时,用纳米
约为5时,用纳米 粉可将
粉可将 还原为
还原为 ,
, 粉被氧化为
粉被氧化为 ,该反应中氧化产物与还原产物的物质的量之比为
,该反应中氧化产物与还原产物的物质的量之比为_______ 。
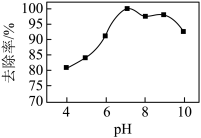
(3)实验测得相同条件下,用次氯酸钠脱除水体中的氨态氮的过程中(
 ),
), 与氨态氮的去除率关系如图所示,在
与氨态氮的去除率关系如图所示,在 大于9时,
大于9时, 越大,去除率越小,其原因是
越大,去除率越小,其原因是_______ 。
(1)常温下,在
 约为9时,用澄清石灰水可将水体中的
约为9时,用澄清石灰水可将水体中的 转化为
转化为 沉淀除去,该反应的离子方程式为
沉淀除去,该反应的离子方程式为(2)除去地下水中的硝态氮通常用还原剂将其还原为
 。
。①Prusse等提出的用
 作催化剂,常温下,在
作催化剂,常温下,在 为4.0~6.0时,可直接用
为4.0~6.0时,可直接用 将
将 还原为
还原为 ,该反应的离子方程式为
,该反应的离子方程式为 和
和 的混合气体代替
的混合气体代替 ,
, 的去除效果比只用
的去除效果比只用 时更好,其原因是
时更好,其原因是②在
 约为5时,用纳米
约为5时,用纳米 粉可将
粉可将 还原为
还原为 ,
, 粉被氧化为
粉被氧化为 ,该反应中氧化产物与还原产物的物质的量之比为
,该反应中氧化产物与还原产物的物质的量之比为(3)实验测得相同条件下,用次氯酸钠脱除水体中的氨态氮的过程中(

 ),
), 与氨态氮的去除率关系如图所示,在
与氨态氮的去除率关系如图所示,在 大于9时,
大于9时, 越大,去除率越小,其原因是
越大,去除率越小,其原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】H2Y2-是乙二胺四乙酸根( )的简写,可与多种金属离子形成络合物。
)的简写,可与多种金属离子形成络合物。
I. H2Y2-与Fe2+形成的络合物FeY2-可用于吸收烟气中的NO。其吸收原理:
FeY2- (aq)+ NO(g) FeY2-(NO) (aq) △H<0
FeY2-(NO) (aq) △H<0
(1) 将含NO的烟气以一定的流速通入起始温度为50℃的FeY2-溶液中。NO吸收率随通入烟气的时间变化如右图。时间越长,NO吸收率越低的原因是_________ 。

(2)生成的FeY2-(NO) (aq)可通过加入铁粉还原再生,其原理:FeY2-(NO) (aq)+Fe+H2O→FeY2-(aq)+Fe(OH)2+NH3(未配平)。
若吸收液再生消耗14g铁粉,则所吸收的烟气中含有NO的物质的量为_______ 。
II.络合铜(CuY2-)废水的处理一直是环境工程领域的研究热点。
(1)H2Y2-与Cu2+、Fe3+、Ca2+络合情况如下表:
①表中最不稳定的金属络合物是_____ (填化学式)。向含有络合铜(CuY2-)废水中加入一种黄色的盐溶液A 可解离出Cu2+,则盐A中阳离子为________ (填化学式)。
②调节pH可将解离出的Cu2+转化为Cu(OH)2沉淀,若要使c(Cu2+)≤2.2×10-4mol/L,pH应不低于________ (常温下Ksp[Cu(OH)2]= 2.2×10-20)。
(2)羟基自由基(-OH)、Na2FeO2都可氧化络合铜中的Y4-而使Cu2+得到解离。
①酸性条件下,-OH 可将Y4-(C10H12O8N24-)氧化生成CO2、H2O、N2。该反应的离子方程式为___________________ 。
②Na2FeO4在酸性条件下不稳定。用Na2FeO4处理后的废水中Cu2+的浓度与pH的关系如右图。pH越大,废水处理效果越好,这是因为______________ 。

 )的简写,可与多种金属离子形成络合物。
)的简写,可与多种金属离子形成络合物。I. H2Y2-与Fe2+形成的络合物FeY2-可用于吸收烟气中的NO。其吸收原理:
FeY2- (aq)+ NO(g)
 FeY2-(NO) (aq) △H<0
FeY2-(NO) (aq) △H<0(1) 将含NO的烟气以一定的流速通入起始温度为50℃的FeY2-溶液中。NO吸收率随通入烟气的时间变化如右图。时间越长,NO吸收率越低的原因是

(2)生成的FeY2-(NO) (aq)可通过加入铁粉还原再生,其原理:FeY2-(NO) (aq)+Fe+H2O→FeY2-(aq)+Fe(OH)2+NH3(未配平)。
若吸收液再生消耗14g铁粉,则所吸收的烟气中含有NO的物质的量为
II.络合铜(CuY2-)废水的处理一直是环境工程领域的研究热点。
(1)H2Y2-与Cu2+、Fe3+、Ca2+络合情况如下表:
| 络合反应 | lgK(K 为平衡常数) |
Cu2++ H2Y2- CuY2-+ 2H+ CuY2-+ 2H+ | 18.8 |
Fe3++ H2Y2- FeY-+ 2H+ FeY-+ 2H+ | 25.1 |
Ca2++ H2Y2- CaY2-+ 2H+ CaY2-+ 2H+ | 10.7 |
①表中最不稳定的金属络合物是
②调节pH可将解离出的Cu2+转化为Cu(OH)2沉淀,若要使c(Cu2+)≤2.2×10-4mol/L,pH应不低于
(2)羟基自由基(-OH)、Na2FeO2都可氧化络合铜中的Y4-而使Cu2+得到解离。
①酸性条件下,-OH 可将Y4-(C10H12O8N24-)氧化生成CO2、H2O、N2。该反应的离子方程式为
②Na2FeO4在酸性条件下不稳定。用Na2FeO4处理后的废水中Cu2+的浓度与pH的关系如右图。pH越大,废水处理效果越好,这是因为

您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】固体的研究是化学中的重要课题,回答下列问题:
(1)实验室在配制硝酸铜的溶液时,加蒸馏水前常将硝酸铜固体先溶于适量硝酸中,其主要目的是_____ 。
(2)将下列固体物质溶于水,再将其溶液加热、蒸发结晶,再充分灼烧,得到化学组成与原固体物质相同的是_____ (填选项字母)。
A.胆矾 B.氯化铝 C.硫酸铝 D.氯化铜 E.硫酸亚铁 F.碳酸钠
(3)已知常温下Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.5×10-9。
①BaSO4和BaCO3均为沉淀,二者可以相互转化。医疗上做“钡餐”的是____ ,向等浓度的Na2CO3、Na2SO4的混合溶液中逐滴加入BaCl2溶液,最先出现的沉淀是_____ 。
②用下列流程得到BaCl2溶液:BaSO4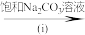 BaCO3
BaCO3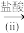 BaCl2,计算反应(i)的平衡常数K=
BaCl2,计算反应(i)的平衡常数K=____ 。
③向1LNa2CO3溶液中加入足量BaSO4固体,假定溶液体积不变、温度不变,当溶液中c(CO )=1×10-3mol•L-1时,溶解BaSO4的物质的量为
)=1×10-3mol•L-1时,溶解BaSO4的物质的量为____ mol。
(4)常温下用废电池的锌皮制备ZnSO4•7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是加稀H2SO4和H2O2溶解使铁变为Fe3+。已知:
①若上述过程不加H2O2将导致Zn2+和Fe2+不能分离,原因是____ 。
②加碱调节至pH为_____ (保留到小数点后1位)时,铁离子刚好沉淀完全(离子浓度小于1×10-5mol•L-1时,即可认为该离子沉淀完全)。
(1)实验室在配制硝酸铜的溶液时,加蒸馏水前常将硝酸铜固体先溶于适量硝酸中,其主要目的是
(2)将下列固体物质溶于水,再将其溶液加热、蒸发结晶,再充分灼烧,得到化学组成与原固体物质相同的是
A.胆矾 B.氯化铝 C.硫酸铝 D.氯化铜 E.硫酸亚铁 F.碳酸钠
(3)已知常温下Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.5×10-9。
①BaSO4和BaCO3均为沉淀,二者可以相互转化。医疗上做“钡餐”的是
②用下列流程得到BaCl2溶液:BaSO4
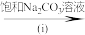 BaCO3
BaCO3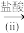 BaCl2,计算反应(i)的平衡常数K=
BaCl2,计算反应(i)的平衡常数K=③向1LNa2CO3溶液中加入足量BaSO4固体,假定溶液体积不变、温度不变,当溶液中c(CO
 )=1×10-3mol•L-1时,溶解BaSO4的物质的量为
)=1×10-3mol•L-1时,溶解BaSO4的物质的量为(4)常温下用废电池的锌皮制备ZnSO4•7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是加稀H2SO4和H2O2溶解使铁变为Fe3+。已知:
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp的近似值 | 1×10-17 | 1×10-17 | 1×10-39 |
①若上述过程不加H2O2将导致Zn2+和Fe2+不能分离,原因是
②加碱调节至pH为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】完成下列问题。
(1)现用300mL0.5mol•L﹣1的NaOH溶液吸收2.24L(标准状况下)CO2,完全吸收反应后,所得溶液中离子浓度由大到小的顺序为:___________ 。
(2)现有含有 和
和 的混合溶液,若溶液中
的混合溶液,若溶液中 ,加入碳酸钠调节溶液的pH为
,加入碳酸钠调节溶液的pH为___________ 可使 恰好沉淀完全(离子浓度≤1.0×10-5mol/L),此时
恰好沉淀完全(离子浓度≤1.0×10-5mol/L),此时___________ (填“有”或“无”) 沉淀生成。(假设溶液体积不变,
沉淀生成。(假设溶液体积不变,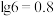 ;
;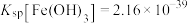 ,
, )
)
(3)生成 沉淀是利用反应
沉淀是利用反应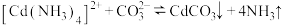 ,常温下,该反应平衡常数
,常温下,该反应平衡常数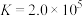 ,
,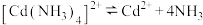 的平衡常数
的平衡常数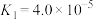 ,则
,则
___________ 。
(4)某小组同学探究饱和 和
和 溶液混合反应的实验,模拟泡沫灭火器的原理。向盛有
溶液混合反应的实验,模拟泡沫灭火器的原理。向盛有 溶液的烧瓶中加入饱和
溶液的烧瓶中加入饱和 溶液,产生大量的白色沉淀并迅速释放出大量气体。出现上述现象的原因是
溶液,产生大量的白色沉淀并迅速释放出大量气体。出现上述现象的原因是___________ (请用反应的离子方程式表示)。
(5)写出下列粒子的价电子排布式:
Fe2+:___________ ;As:___________ 。
(1)现用300mL0.5mol•L﹣1的NaOH溶液吸收2.24L(标准状况下)CO2,完全吸收反应后,所得溶液中离子浓度由大到小的顺序为:
(2)现有含有
 和
和 的混合溶液,若溶液中
的混合溶液,若溶液中 ,加入碳酸钠调节溶液的pH为
,加入碳酸钠调节溶液的pH为 恰好沉淀完全(离子浓度≤1.0×10-5mol/L),此时
恰好沉淀完全(离子浓度≤1.0×10-5mol/L),此时 沉淀生成。(假设溶液体积不变,
沉淀生成。(假设溶液体积不变, ;
;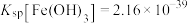 ,
, )
)(3)生成
 沉淀是利用反应
沉淀是利用反应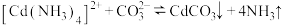 ,常温下,该反应平衡常数
,常温下,该反应平衡常数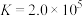 ,
,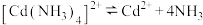 的平衡常数
的平衡常数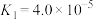 ,则
,则
(4)某小组同学探究饱和
 和
和 溶液混合反应的实验,模拟泡沫灭火器的原理。向盛有
溶液混合反应的实验,模拟泡沫灭火器的原理。向盛有 溶液的烧瓶中加入饱和
溶液的烧瓶中加入饱和 溶液,产生大量的白色沉淀并迅速释放出大量气体。出现上述现象的原因是
溶液,产生大量的白色沉淀并迅速释放出大量气体。出现上述现象的原因是(5)写出下列粒子的价电子排布式:
Fe2+:
您最近一年使用:0次



