氮的化合物的处理和利用是环境科学研究的热点。
(1)机动车排放的尾气中主要污染物为NOx,可用CH4催化还原NOx以消除其污染。298K时,1.0g CH4(g)与足量的NO气体完全反应生成N2、CO2和H2O(g),放出72.5kJ的热量。该反应的热化学方程式为_______ 。
(2)氮氧化物与悬浮大气中的海盐粒子相互作用会生成NOCl,涉及的相关反应有:
ΔH1、ΔH2、ΔH3之间的关系为ΔH3=_____ ;K1、K2、K3的关系为K3=______ 。
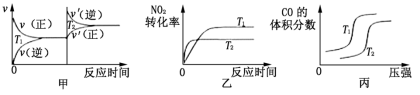
(3)对汽车加装尾气净化装置,可使汽车尾气中含有的CO、NO2等有毒气体转化为无毒气体:4CO(g)+2NO2(g)⇌4CO2(g)+N2(g) ΔH=-1200kJ·mol-1.对于该反应,温度不同(T2﹥T1),其他条件相同时,下列图象正确的是_______ (填序号)。
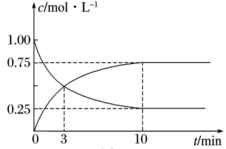
(4)用活性炭还原法也可以处理氮氧化物。向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)⇌N2(g)+CO2(g) ΔH。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
①T1℃时,该反应在0~20min的平均反应速率v(CO2)=____ ;该反应的平衡常数K=_____ ;
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是_______ (填序号);
A.加入一定量的活性炭
B.恒温恒压充入氩气
C.适当缩小容器的体积
D.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则和原平衡相比,NO的转化率_______ (填“升高”或“降低”),反应的平衡常数Kp=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(1)机动车排放的尾气中主要污染物为NOx,可用CH4催化还原NOx以消除其污染。298K时,1.0g CH4(g)与足量的NO气体完全反应生成N2、CO2和H2O(g),放出72.5kJ的热量。该反应的热化学方程式为
(2)氮氧化物与悬浮大气中的海盐粒子相互作用会生成NOCl,涉及的相关反应有:
| 热化学方程式 | 平衡常数 | |
| ① | 2NO2(g)+NaCl(s)⇌NaNO3(s)+NOCl(g) ΔH1 | K1 |
| ② | 4NO2(g)+2NaCl(s)⇌2NaNO3(s)+2NO(g)+Cl2(g) ΔH2 | K2 |
| ③ | 2NO(g)+Cl2(g)⇌2NOCl(g) ΔH3 | K3 |
ΔH1、ΔH2、ΔH3之间的关系为ΔH3=
(3)对汽车加装尾气净化装置,可使汽车尾气中含有的CO、NO2等有毒气体转化为无毒气体:4CO(g)+2NO2(g)⇌4CO2(g)+N2(g) ΔH=-1200kJ·mol-1.对于该反应,温度不同(T2﹥T1),其他条件相同时,下列图象正确的是

(4)用活性炭还原法也可以处理氮氧化物。向某密闭容器中加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)⇌N2(g)+CO2(g) ΔH。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
时间/min 浓度/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①T1℃时,该反应在0~20min的平均反应速率v(CO2)=
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是
A.加入一定量的活性炭
B.恒温恒压充入氩气
C.适当缩小容器的体积
D.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则和原平衡相比,NO的转化率
更新时间:2021-01-27 11:06:47
|
相似题推荐
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐1】完成下列问题。
(1)某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计如下系列实验:
(1)①写出硫代硫酸钠与稀硫酸反应的化学方程式:_______ 。
②该实验①、②可探究_______ 对反应速率的影响,因此V3是_______ ;实验①、③可探究_______ 对反应速率的影响,因此V5是_______ 。
(2)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表所示:
①该反应的化学平衡常数表达式为K=_______ 。
②该反应为_______ 反应(填“吸热”或“放热”)。
③某温度下,平衡浓度符合下式:c(CO2)∙c(H2)=c(CO)∙c(H2O),试判断此时的温度为_______ ℃。
④在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2mol/L,c(H2)=1.5mol/L,c(CO)=1mol/L,c(H2O)=3mol/L,则下一时刻,反应向_______ (填“正向”或“逆向”)进行。
(3)已知常温时红磷比白磷稳定,比较下列反应中ΔH的大小:ΔH1_______ ΔH2(填“>”或“<”)。
①P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1
②4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2
(1)某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计如下系列实验:
| 实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| ② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
| ③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
(1)①写出硫代硫酸钠与稀硫酸反应的化学方程式:
②该实验①、②可探究
(2)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表所示:
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
①该反应的化学平衡常数表达式为K=
②该反应为
③某温度下,平衡浓度符合下式:c(CO2)∙c(H2)=c(CO)∙c(H2O),试判断此时的温度为
④在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2mol/L,c(H2)=1.5mol/L,c(CO)=1mol/L,c(H2O)=3mol/L,则下一时刻,反应向
(3)已知常温时红磷比白磷稳定,比较下列反应中ΔH的大小:ΔH1
①P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1
②4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
【推荐2】第五届联合国环境大会(UNEA5)于2021年2月份在肯尼亚举行,会议主题为“加大力度保护自然,实现可持续发展”。有效去除大气中的H2S、SO2以及废水中的硫化物是环境保护的重要课题。
(1)氨水可以脱除烟气中的SO2,氨水脱硫的相关热化学方程式如下:
①2NH3(g)+H2O(l)+SO2(g)=(NH4)2SO3(aq) ΔH=a kJ·mol-1
②(NH4)2SO3(aq)+H2O(l)+SO2(g)=2NH4HSO3(aq) ΔH=b kJ·mol-1
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ΔH=c kJ·mol-1
反应NH3(g)+NH4HSO3(aq)+ O2(g)=(NH4)2SO4(aq)的ΔH=
O2(g)=(NH4)2SO4(aq)的ΔH=_______ kJ·mol-1。(用含a、b、c的代数式表示)
(2)SO2可被NO2氧化:SO2(g)+NO2(g) SO3(g)+NO(g)。当温度高于225 ℃时,反应速率v正=k正·c(SO2)·c(NO2),v逆=k逆·c(SO3)·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为
SO3(g)+NO(g)。当温度高于225 ℃时,反应速率v正=k正·c(SO2)·c(NO2),v逆=k逆·c(SO3)·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为_______ 。
(3)在气体总压强分别为p1和p2时,反应2SO3(g) 2SO2(g)+O2(g)在不同温度下达到平衡,测得SO3(g)及SO2(g)的物质的量分数如图所示:
2SO2(g)+O2(g)在不同温度下达到平衡,测得SO3(g)及SO2(g)的物质的量分数如图所示:
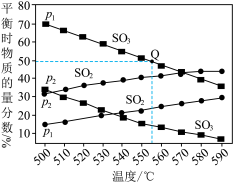
①压强:p1_______ (填“>”或“<”)p2。
②若p1=0.81 MPa,起始时充入一定量的SO3(g)发生反应,计算Q点对应温度下该反应的平衡常数Kp=_______ (用平衡分压代替平衡浓度计算。分压=总压×物质的量分数)MPa。
(1)氨水可以脱除烟气中的SO2,氨水脱硫的相关热化学方程式如下:
①2NH3(g)+H2O(l)+SO2(g)=(NH4)2SO3(aq) ΔH=a kJ·mol-1
②(NH4)2SO3(aq)+H2O(l)+SO2(g)=2NH4HSO3(aq) ΔH=b kJ·mol-1
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(aq) ΔH=c kJ·mol-1
反应NH3(g)+NH4HSO3(aq)+
 O2(g)=(NH4)2SO4(aq)的ΔH=
O2(g)=(NH4)2SO4(aq)的ΔH=(2)SO2可被NO2氧化:SO2(g)+NO2(g)
 SO3(g)+NO(g)。当温度高于225 ℃时,反应速率v正=k正·c(SO2)·c(NO2),v逆=k逆·c(SO3)·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为
SO3(g)+NO(g)。当温度高于225 ℃时,反应速率v正=k正·c(SO2)·c(NO2),v逆=k逆·c(SO3)·c(NO),k正、k逆分别为正、逆反应速率常数。在上述温度范围内,k正、k逆与该反应的平衡常数K之间的关系为(3)在气体总压强分别为p1和p2时,反应2SO3(g)
 2SO2(g)+O2(g)在不同温度下达到平衡,测得SO3(g)及SO2(g)的物质的量分数如图所示:
2SO2(g)+O2(g)在不同温度下达到平衡,测得SO3(g)及SO2(g)的物质的量分数如图所示:
①压强:p1
②若p1=0.81 MPa,起始时充入一定量的SO3(g)发生反应,计算Q点对应温度下该反应的平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
【推荐3】回答下列问题:
(1)当今世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25℃时,相关物质的燃烧热数据如表:
则25℃时H2(g)和C(石墨,s)生成C6H6(l)的热化学方程式为___________ 。
(2)已知相关化学键的键能数据:
则反应 :Si (s) +O2 (g) =SiO2(s) ΔH=___________ kJ·mol-1。
(3)HCOOH燃料电池。研究 HCOOH燃料电池性能的装置如图所示,两电极区间用允许K+、H+通过的半透膜隔开。
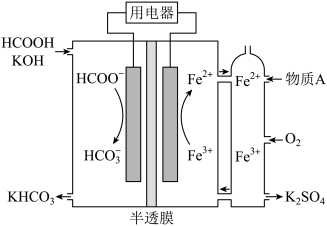
①电池负极电极反应式为___________ ;放电过程中需补充的物质A为___________ (填化学式)。
②上图所示的 HCOOH燃料电池放电的本质是通过 HCOOH与O2的反应,将化学能转化为电能,其反应的离子方程式为___________ 。
(1)当今世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25℃时,相关物质的燃烧热数据如表:
| 物质 | H2(g) | C(石墨,s) | C6H6(l) |
| 燃烧热ΔH(kJ•mol-1) | -285.8 | -393.5 | -3267.5 |
(2)已知相关化学键的键能数据:
| 化学键 | Si-Si | O=O | Si-O |
| 键能E/(kJ•mol-1) | 176 | 494 | 460 |
(3)HCOOH燃料电池。研究 HCOOH燃料电池性能的装置如图所示,两电极区间用允许K+、H+通过的半透膜隔开。

①电池负极电极反应式为
②上图所示的 HCOOH燃料电池放电的本质是通过 HCOOH与O2的反应,将化学能转化为电能,其反应的离子方程式为
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
【推荐1】氮的化合物在生产生活中广泛存在。
(1)①氯胺( )的电子式为
)的电子式为___________ 。可通过反应 制备氯胺,已知部分化学键的键能如表所示,则上述反应的
制备氯胺,已知部分化学键的键能如表所示,则上述反应的
___________ 。
② 与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为
与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为___________ 。
(2)用焦炭还原NO的反应为: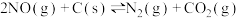 ,向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中
,向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中 随反应时间t的变化情况如下表所示:
随反应时间t的变化情况如下表所示:
①该正反应为___________ (填“放热”或“吸热”)反应。
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率
___________ 。
(3)用焦炭还原 的反应为:
的反应为: ,在恒温条件下,
,在恒温条件下,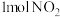 和足量C发生该反应,测得平衡时
和足量C发生该反应,测得平衡时 和
和 的物质的量浓度与平衡总压的关系如图所示:
的物质的量浓度与平衡总压的关系如图所示:
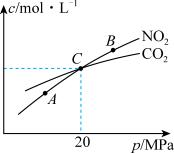
①A、B两点的浓度平衡常数关系:Kc(A)___________ Kc(B) (填“<”“>”或“=”)。
②A、B、C三点中 的转化率最低的是
的转化率最低的是___________ (填“A”“B”或“C”)点。
③计算C点时该反应的压强平衡常数
___________ ( 是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(1)①氯胺(
 )的电子式为
)的电子式为 制备氯胺,已知部分化学键的键能如表所示,则上述反应的
制备氯胺,已知部分化学键的键能如表所示,则上述反应的
键能/( ) ) | 391 | 243 | 191 | 431 |
| 化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
 与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为
与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为(2)用焦炭还原NO的反应为:
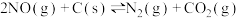 ,向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中
,向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中 随反应时间t的变化情况如下表所示:
随反应时间t的变化情况如下表所示:| t/min | 0 | 40 | 80 | 120 | 160 |
 (甲容器,400℃)/mol (甲容器,400℃)/mol | 2.00 | 1.50 | 1.10 | 0.60 | 0.60 |
 (乙容器,400℃)/mol (乙容器,400℃)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
 (丙容器,T℃)/mol (丙容器,T℃)/mol | 2.00 | 1.00 | 0.50 | 0.50 | 0.50 |
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率

(3)用焦炭还原
 的反应为:
的反应为: ,在恒温条件下,
,在恒温条件下,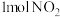 和足量C发生该反应,测得平衡时
和足量C发生该反应,测得平衡时 和
和 的物质的量浓度与平衡总压的关系如图所示:
的物质的量浓度与平衡总压的关系如图所示:
①A、B两点的浓度平衡常数关系:Kc(A)
②A、B、C三点中
 的转化率最低的是
的转化率最低的是③计算C点时该反应的压强平衡常数

 是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
您最近一年使用:0次
【推荐2】人体中的锌具有维持人体正常食欲、增强人体免疫力等生理功能,如儿童缺锌会导致味觉障碍、皮肤疾患、生长发育不良、免疫力下降等。请回答下列有关锌的问题。
(1)锌能与盐酸反应,该反应是___________ (填“放热”或“吸热”)反应,该反应中反应物的总能量___________ (填“大于”或“小于”)生成物的总能量。锌也能像铝一样与氢氧化钠溶液反应,则锌与氢氧化钠溶液反应的化学方程式为___________ 。
(2)用锌片与铜片作电极,稀硫酸作电解质溶液,可以组成原电池,该电池的正极发生___________ (填“氧化”或“还原”)反应,其电极反应式是___________ 。用锌片与 作电极,KOH溶液作电解质溶液,也可以组成原电池,工作原理如图所示,该原电池工作时,电池总反应是
作电极,KOH溶液作电解质溶液,也可以组成原电池,工作原理如图所示,该原电池工作时,电池总反应是
 ,该电池的正极材料是
,该电池的正极材料是___________ (填化学式),负极的电极反应式为___________ 。 稀硫酸与足量的锌粒发生反应,用针筒收集气体,当反应进行2min时,收集的气体为67.2mL(换算为标准状况),0~2min内用硫酸表示的平均反应速率为
稀硫酸与足量的锌粒发生反应,用针筒收集气体,当反应进行2min时,收集的气体为67.2mL(换算为标准状况),0~2min内用硫酸表示的平均反应速率为___________ (忽略溶液体积的变化)。
(1)锌能与盐酸反应,该反应是
(2)用锌片与铜片作电极,稀硫酸作电解质溶液,可以组成原电池,该电池的正极发生
 作电极,KOH溶液作电解质溶液,也可以组成原电池,工作原理如图所示,该原电池工作时,电池总反应是
作电极,KOH溶液作电解质溶液,也可以组成原电池,工作原理如图所示,该原电池工作时,电池总反应是
 ,该电池的正极材料是
,该电池的正极材料是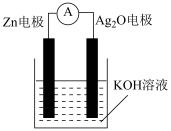
 稀硫酸与足量的锌粒发生反应,用针筒收集气体,当反应进行2min时,收集的气体为67.2mL(换算为标准状况),0~2min内用硫酸表示的平均反应速率为
稀硫酸与足量的锌粒发生反应,用针筒收集气体,当反应进行2min时,收集的气体为67.2mL(换算为标准状况),0~2min内用硫酸表示的平均反应速率为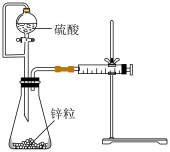
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐3】我国力争2060年前实现碳中和,将 转化为甲醇是实现碳中和的途径之一、原理为:
转化为甲醇是实现碳中和的途径之一、原理为: 。在一定温度下,体积为1L的密闭容器中,充入
。在一定温度下,体积为1L的密闭容器中,充入 和
和 ,测得
,测得 和
和 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。
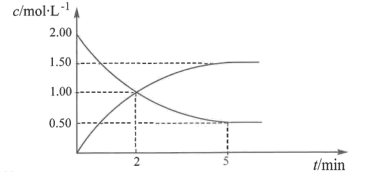
回答下列问题:
(1)2min~5min的平均反应速率
_______ 。
(2)平衡时 的转化率为
的转化率为_______ %。
(3)2min时,
_______  (填“>”“<”“=”或“无法比较”)。
(填“>”“<”“=”或“无法比较”)。
(4)下图为甲醇酸性燃料电池的构造示意图,根据原电池的工作原理,电极a是____ (填“正极”或“负极”),此电池工作时,负极的电极反应为___ 。
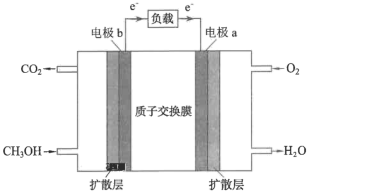
 转化为甲醇是实现碳中和的途径之一、原理为:
转化为甲醇是实现碳中和的途径之一、原理为: 。在一定温度下,体积为1L的密闭容器中,充入
。在一定温度下,体积为1L的密闭容器中,充入 和
和 ,测得
,测得 和
和 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。
回答下列问题:
(1)2min~5min的平均反应速率

(2)平衡时
 的转化率为
的转化率为(3)2min时,

 (填“>”“<”“=”或“无法比较”)。
(填“>”“<”“=”或“无法比较”)。(4)下图为甲醇酸性燃料电池的构造示意图,根据原电池的工作原理,电极a是

您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
【推荐1】CO可用于合成甲醇,下图是反应CO(g)+2H2(g)⇌CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变ΔH_______ 0(填“>”“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______ K2(填“>”、“<”或“=”)。
③在T1温度下,往体积为1 L的密闭容器中,充入1 mol CO和2 mol H2 ,经测得CO和CH3OH(g)的浓度随时间变化如下图所示。则该反应的平衡常数为_______ 。
④若容器容积不变,下列措施可增加CO转化率的是_______ (填字母)。
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大

①该反应的焓变ΔH
②T1和T2温度下的平衡常数大小关系是K1
③在T1温度下,往体积为1 L的密闭容器中,充入1 mol CO和2 mol H2 ,经测得CO和CH3OH(g)的浓度随时间变化如下图所示。则该反应的平衡常数为

④若容器容积不变,下列措施可增加CO转化率的是
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐2】三氯胺(NCl3)是一种饮用水二级消毒剂,可由以下反应制备:
Ⅰ.NH3(g)+3Cl2(g)=NCl3(1)+3HCl(g)△H回答下列问题:
(1)已知:Ⅱ.2NH3(g)+3Cl2(g)=N2(g)+6HCl(g)△H1
Ⅲ.N2(g)+3Cl2(g)=2NCl3(1)△H2
则△H =______  用含△H1和△H2的代数式表示
用含△H1和△H2的代数式表示 。
。
(2)向容积均为2L的甲、乙两个恒温密闭容器中分别加入4 mol 和4 mol Cl2,发生反应Ⅰ,测得两容器中
和4 mol Cl2,发生反应Ⅰ,测得两容器中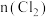 随反应时间的变化情况如表所示:
随反应时间的变化情况如表所示:
①0~80min内,容器甲中
______
②反应Ⅰ的△H______  填“
填“ ”或“
”或“ ”
” ,其原因为
,其原因为______ 。
③关于反应Ⅰ,下列说法正确的是______  填选项字母
填选项字母 。
。
A 容器内 ,说明反应达到平衡状态
,说明反应达到平衡状态
B 容器内气体密度不变,说明反应达到平衡状态
C 达平衡后,加入一定量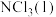 ,平衡逆向移动
,平衡逆向移动
D 达平衡后,按原投料比再充入一定量反应物。平衡后 的转化率增大
的转化率增大
④温度为 时,该反应的平衡常数
时,该反应的平衡常数
______ 。
Ⅰ.NH3(g)+3Cl2(g)=NCl3(1)+3HCl(g)△H回答下列问题:
(1)已知:Ⅱ.2NH3(g)+3Cl2(g)=N2(g)+6HCl(g)△H1
Ⅲ.N2(g)+3Cl2(g)=2NCl3(1)△H2
则△H =
 用含△H1和△H2的代数式表示
用含△H1和△H2的代数式表示 。
。(2)向容积均为2L的甲、乙两个恒温密闭容器中分别加入4 mol
 和4 mol Cl2,发生反应Ⅰ,测得两容器中
和4 mol Cl2,发生反应Ⅰ,测得两容器中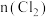 随反应时间的变化情况如表所示:
随反应时间的变化情况如表所示:| 时间 | 0 | 40 | 80 | 120 | 160 |
容器甲 |  |  |  | 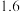 | 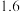 |
容器乙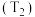 |  |  |  |  |  |

②反应Ⅰ的△H
 填“
填“ ”或“
”或“ ”
” ,其原因为
,其原因为③关于反应Ⅰ,下列说法正确的是
 填选项字母
填选项字母 。
。A 容器内
 ,说明反应达到平衡状态
,说明反应达到平衡状态B 容器内气体密度不变,说明反应达到平衡状态
C 达平衡后,加入一定量
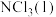 ,平衡逆向移动
,平衡逆向移动D 达平衡后,按原投料比再充入一定量反应物。平衡后
 的转化率增大
的转化率增大④温度为
 时,该反应的平衡常数
时,该反应的平衡常数
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
【推荐3】甲醇是多种有机产品的基本原料和重要的化工产品,广泛用于有机合成、染料、医药、涂料和国防等工业。回答下列问题:
(1)一定条件下1molCH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化如图1所示。其中,反应物O2(g)和生成物H2O(g)略去。则HCHO(g)与O2(g)反应生成CO(g)的热化学方程式为___________ 。

(2)在恒容密闭容器中利用合成气(主要成分为CO2和含有少量CO的H2)合成甲醇,发生的主反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g)。在
CH3OH(g)+H2O(g)。在 分别为1:a和1:1.5a两种投料比时,CO2的平衡转化率随温度变化的曲线如图2所示,则投料比为1:1.5a时,对应的曲线是
分别为1:a和1:1.5a两种投料比时,CO2的平衡转化率随温度变化的曲线如图2所示,则投料比为1:1.5a时,对应的曲线是___________ (填①或②); 的数值,m点比n点
的数值,m点比n点___________ (填“大”或“小”)。

(3)铜系催化剂对反应2CH3OH(g) HCOOCH3(g)+2H2(g)具有较高的活性。在583K下,将a mol甲醇置于b L恒容密闭容器中,经过t min到达平衡,气体压强为P0 Pa,且P氢气=P甲醇,此过程中的平均反应速率v(HCOOCH3) =
HCOOCH3(g)+2H2(g)具有较高的活性。在583K下,将a mol甲醇置于b L恒容密闭容器中,经过t min到达平衡,气体压强为P0 Pa,且P氢气=P甲醇,此过程中的平均反应速率v(HCOOCH3) =___________ (用含a、b、t的式子表达);用气体分压表示的平衡常数Kp=___________ (用含P0的式子表达);相同温度下,将a mol甲醇置于b L恒压密闭容器中,反应到达平衡时P氢气___________ P甲醇(填“>”,“=”或“<”)。
(4)利用CH3OH催化重整可以制取氢气,主反应:CH3OH(g)+H2O(g) CO2(g)+3H2(g),副反应:CH3OH(g)
CO2(g)+3H2(g),副反应:CH3OH(g)  CO(g)+2H2(g);某研究小组对实验条件温度( T )与水醇比(
CO(g)+2H2(g);某研究小组对实验条件温度( T )与水醇比( )进行优化,实验结果如图3和图4。
)进行优化,实验结果如图3和图4。
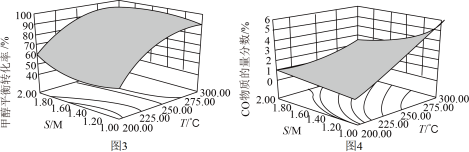
①结合图3分析温度、水醇比与甲醇平衡转化率的关系:___________ 。
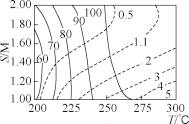
②在下图中用阴影画出最优化的反应条件区域__________ (下图为图3和图4组合的平面图,实线为甲醇平衡转化率,虚线为CO物质的量分数)。(注:在选定的区域用铅笔涂黑)。
(1)一定条件下1molCH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化如图1所示。其中,反应物O2(g)和生成物H2O(g)略去。则HCHO(g)与O2(g)反应生成CO(g)的热化学方程式为

(2)在恒容密闭容器中利用合成气(主要成分为CO2和含有少量CO的H2)合成甲醇,发生的主反应为CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。在
CH3OH(g)+H2O(g)。在 分别为1:a和1:1.5a两种投料比时,CO2的平衡转化率随温度变化的曲线如图2所示,则投料比为1:1.5a时,对应的曲线是
分别为1:a和1:1.5a两种投料比时,CO2的平衡转化率随温度变化的曲线如图2所示,则投料比为1:1.5a时,对应的曲线是 的数值,m点比n点
的数值,m点比n点
(3)铜系催化剂对反应2CH3OH(g)
 HCOOCH3(g)+2H2(g)具有较高的活性。在583K下,将a mol甲醇置于b L恒容密闭容器中,经过t min到达平衡,气体压强为P0 Pa,且P氢气=P甲醇,此过程中的平均反应速率v(HCOOCH3) =
HCOOCH3(g)+2H2(g)具有较高的活性。在583K下,将a mol甲醇置于b L恒容密闭容器中,经过t min到达平衡,气体压强为P0 Pa,且P氢气=P甲醇,此过程中的平均反应速率v(HCOOCH3) =(4)利用CH3OH催化重整可以制取氢气,主反应:CH3OH(g)+H2O(g)
 CO2(g)+3H2(g),副反应:CH3OH(g)
CO2(g)+3H2(g),副反应:CH3OH(g)  CO(g)+2H2(g);某研究小组对实验条件温度( T )与水醇比(
CO(g)+2H2(g);某研究小组对实验条件温度( T )与水醇比( )进行优化,实验结果如图3和图4。
)进行优化,实验结果如图3和图4。
①结合图3分析温度、水醇比与甲醇平衡转化率的关系:
②在下图中用阴影画出最优化的反应条件区域

您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐1】在密闭容器中充入一定量的H2S, 发生反应: 2H2S(g)  2H2(g)+S2(g) ΔH, 如图丙所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
2H2(g)+S2(g) ΔH, 如图丙所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
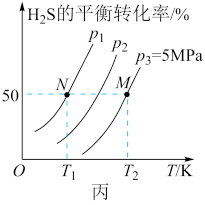
(1)ΔH___________ (填“>”“<”或“=”)0。
(2)图丙中压强(p1、p2、 p3)的大小顺序为___________
(3)如果想进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有___________ 。
 2H2(g)+S2(g) ΔH, 如图丙所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
2H2(g)+S2(g) ΔH, 如图丙所示为H2S气体分解生成H2(g)和S2(g)的平衡转化率与温度、压强的关系。
(1)ΔH
(2)图丙中压强(p1、p2、 p3)的大小顺序为
(3)如果想进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐2】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2 )在催化剂的作用下合成甲醇,可能发生的反应如下:
i. CO2(g)+ 3H2(g) CH3OH(g)+ H2O(g) △H1=QkJ·mol- 1
CH3OH(g)+ H2O(g) △H1=QkJ·mol- 1
ii. CO2(g)+ H2(g) CO(g)+ H2O(g) ∆H2=+41 kJ·mol- 1
CO(g)+ H2O(g) ∆H2=+41 kJ·mol- 1
iii. CO(g)+2H2(g) CH3OH(g) ∆H3=-99 kJ·mol- 1
CH3OH(g) ∆H3=-99 kJ·mol- 1
回答下列问题:
(1)Q=______________
(2)反应iii的化学平衡常数K3=_____________ (填表达式)。
(3)图中能正确反映平衡常数K3随温度变化关系的曲线为_____ (填字母),理由是_______

(4)如图为单位时间内CO2+H2、CO+ H2、CO/CO2+H2三个条件下生成甲醇的物质的量浓度与温度的关系(三个条件下通入的CO、CO2和H2的物质的量浓度相同)。

①490K时,根据曲线a、c判断合成甲醇时主要发生的反应为______________ (填"i ”或" iii");由曲线a可知,甲醇的量先增大后减小,其原因是__________ 。
②曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从热力学与动力学角度,并结合反应i、ii分析原因:__________ 。
(5)如图是以NaOH溶液为电解质溶液的甲醇燃料电池:电极a的反应式为__________ , 若隔膜为阳离子交换膜,则每转移6 mol电子,溶液中有___ mol Na+向___ (填“正极区”或“负极区”)移动。

i. CO2(g)+ 3H2(g)
 CH3OH(g)+ H2O(g) △H1=QkJ·mol- 1
CH3OH(g)+ H2O(g) △H1=QkJ·mol- 1ii. CO2(g)+ H2(g)
 CO(g)+ H2O(g) ∆H2=+41 kJ·mol- 1
CO(g)+ H2O(g) ∆H2=+41 kJ·mol- 1iii. CO(g)+2H2(g)
 CH3OH(g) ∆H3=-99 kJ·mol- 1
CH3OH(g) ∆H3=-99 kJ·mol- 1回答下列问题:
(1)Q=
(2)反应iii的化学平衡常数K3=
(3)图中能正确反映平衡常数K3随温度变化关系的曲线为

(4)如图为单位时间内CO2+H2、CO+ H2、CO/CO2+H2三个条件下生成甲醇的物质的量浓度与温度的关系(三个条件下通入的CO、CO2和H2的物质的量浓度相同)。

①490K时,根据曲线a、c判断合成甲醇时主要发生的反应为
②曲线a与曲线b相比,CO的存在使甲醇生成速率增大,从热力学与动力学角度,并结合反应i、ii分析原因:
(5)如图是以NaOH溶液为电解质溶液的甲醇燃料电池:电极a的反应式为

您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐3】氨在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2molNH3,放出92.2kJ热量。
(1)工业合成氨的热化学方程式是_______ 。
(2)已知:
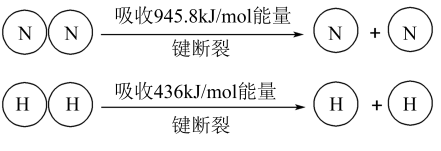
1molN-H键断裂吸收的能量约等于_______ kJ。
(3)T℃时,在有催化剂的恒容密闭容器中充入N2和H2。下图为不同投料比[n(H2)/n(N2)]时某反应物X的平衡转化率变化曲线。
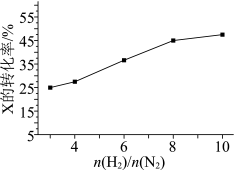
①反应物X是_______ (填“N2”或“H2”)。
②判断依据是_______ 。
(4)在其他条件相同时,下图为分别测定不同压强、不同温度下,N2的平衡转化率。
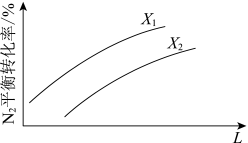
L表示_______ ,其中X1_______ X2(填“>”或“<”)。
(1)工业合成氨的热化学方程式是
(2)已知:

1molN-H键断裂吸收的能量约等于
(3)T℃时,在有催化剂的恒容密闭容器中充入N2和H2。下图为不同投料比[n(H2)/n(N2)]时某反应物X的平衡转化率变化曲线。

①反应物X是
②判断依据是
(4)在其他条件相同时,下图为分别测定不同压强、不同温度下,N2的平衡转化率。

L表示
您最近一年使用:0次



