
(1)装置F中的固体试剂为
(2)实验开始时,先打开K1、K2,关闭K3,再打开分液漏斗活塞滴入适量稀硝酸,当观察到B中红棕色完全消失时关闭K1、K2,之后可能观察到B中现象为
(3)制得的NOCl中可能含有少量N2O4杂质,为测定产品纯度进行如下实验:
Ⅰ.称取一定量的AgNO3晶体,溶于水,用250mL 容量瓶定容至250mL 溶液,再用某基准溶液滴定,测得其准确浓度为0.4000mol•L-1
Ⅱ.将所得亚硝酰氯(NOC1)产品13.10g溶于水,配制成250mL溶液;取出25.00mL,以
①NOCl可用AgNO3溶液滴定是因为它与水发生了反应,离子方程式为
②亚硝酰氯(NOCl)的质量分数为
③若配制AgNO3溶液时仰视容量瓶刻度线,则最终滴定测定结果
相似题推荐
 可用于面粉的漂白和杀菌。已知:
可用于面粉的漂白和杀菌。已知: 为黄色油状液体,熔点为﹣40℃,沸点为70℃,95℃以上易爆炸。
为黄色油状液体,熔点为﹣40℃,沸点为70℃,95℃以上易爆炸。Ⅰ.实验室可用
 和
和 溶液反应制取
溶液反应制取 ,所用装置如下:
,所用装置如下: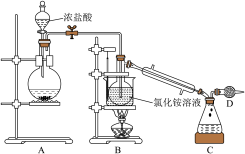
完成下列填空:
(1)三卤化氮 (
 )的分子空间构型与
)的分子空间构型与 相似,其空间构型
相似,其空间构型 强的
强的 有
有 在热水中立刻反应,反应液有漂白性,同时生成另一种有刺激性气味的气体。写出此过程的化学方程式
在热水中立刻反应,反应液有漂白性,同时生成另一种有刺激性气味的气体。写出此过程的化学方程式(2)仪器D的作用是
(3)向蒸馏烧瓶内的
 溶液中通入过量
溶液中通入过量 ,B中反应的化学方程式为
,B中反应的化学方程式为 蒸出。
蒸出。Ⅱ.待反应结束,为测定溶液中残留的的物质的量浓度,进行如下操作:
ⅰ.取蒸馏烧瓶中的反应液25.00mL,加入过量饱和
 溶液充分反应后,再加入过量30%的NaOH溶液,微热。
溶液充分反应后,再加入过量30%的NaOH溶液,微热。ⅱ.用
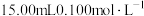 的稀硫酸吸收产生的
的稀硫酸吸收产生的 ,得到溶液A。
,得到溶液A。ⅲ.用
 的NaOH标准液滴定溶液A至滴定终点,消耗VmLNaOH标准液。
的NaOH标准液滴定溶液A至滴定终点,消耗VmLNaOH标准液。(4)滴定至终点时溶液中溶质仅有
 和
和 ,用含V的代数式表示残留液中
,用含V的代数式表示残留液中 的物质的量浓度为
的物质的量浓度为 。
。(5)为减小误差,滴定时最适宜的指示剂为
a.酚酞 b.甲基橙 c.石蕊 d.淀粉溶液
Ⅰ.通过海水晾晒可得粗盐,粗盐中除
 外,还含有
外,还含有 、
、 、
、 以及泥沙等杂质,需要提纯后才能综合利用。某同学利用给定试剂
以及泥沙等杂质,需要提纯后才能综合利用。某同学利用给定试剂 溶液、
溶液、 溶液、
溶液、 溶液和盐酸,设计了如图粗盐精制的实验流程。(提示:根据实验目的,请思考试剂的用量)
溶液和盐酸,设计了如图粗盐精制的实验流程。(提示:根据实验目的,请思考试剂的用量)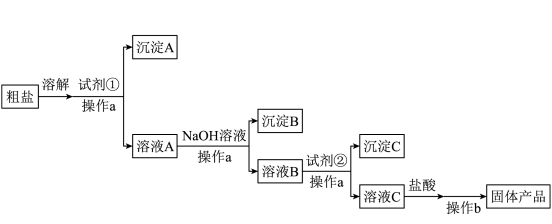
(1)操作a和操作b的名称依次是
(2)加入
 溶液后,得到的沉淀B是
溶液后,得到的沉淀B是(3)加入试剂②后,发生反应的离子方程式有
(4)加入盐酸的作用是
(5)如果加入试剂②后直接加盐酸,产生的后果是
Ⅱ.
 是一种催化剂,某校学习小组用下面装置制备少量
是一种催化剂,某校学习小组用下面装置制备少量 。已知:
。已知: 遇到空气中的水蒸气时能剧烈反应生成
遇到空气中的水蒸气时能剧烈反应生成 和
和 ;
; 在180℃时升华。根据要求完成问题:
在180℃时升华。根据要求完成问题:
(6)A装置中反应的离子方程式为
(7)试剂b为
(8)所用d导管较粗的原因是
(9)F装置的作用为
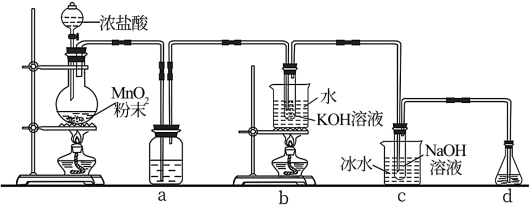
回答下列问题:
(1)盛放浓盐酸的仪器名称是
A.酸性 B.氧化性 C.还原性
(2)a中盛放的试剂为饱和食盐水,其作用为
(3)c中化学反应的离子方程式是
(4)d的作用是
(5)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入淀粉,静置后溶液变为
[实验]在两支试管中各放入一小块等质量的铜片,分别加入等体积的浓HNO3(14 mol ∙L-1)和稀HNO3(4mol ∙L-1),立即用蘸有NaOH的棉花封住试管口。充分反应后铜均无剩余。
(1)Cu与浓HNO3反应的离子方程式
(2)用蘸有NaOH的棉花封住试管口的原因
已知NO2与NaOH溶液反应中,其中NO2的还原产物是亚硝酸盐(
 ),写出反应的化学反应式
),写出反应的化学反应式[提出假设]假设一、因为铜离子浓度大造成的。
假设二、溶液呈绿色是因为铜与浓硝酸反应时产生的二氧化氮溶于过量浓硝酸,加上和蓝色的硝酸铜溶液混在一起,使溶液呈绿色。
[设计实验方案,验证假设]
(3)上述实验
(4)甲同学设计实验验证假设二,请帮他完成下表中内容(提示:
 在不同条件下的还原产物较复杂,有时难以观察到气体产生)
在不同条件下的还原产物较复杂,有时难以观察到气体产生)| 实验步骤 | 预期现象和结论 |
| ①取铜与浓硝酸反应所得的绿色溶液于试管中,多次振荡,静置 ②取铜与稀硝酸反应所得的蓝色溶液通NO2气体 ③ | 溶液颜色由绿色转变为深蓝色,证明假设二成立。 蓝色溶液变成绿色,证明假设二成立。 |
(5)铜和稀硝酸反应后溶液为蓝色的原理
(1)元素X的最高价氧化物的电子式为
(2)用电子式表示元素R氢化物的形成过程:
(3)单质铜和元素Y的最高价氧化物对应水化物的稀溶液发生反应的化学方程式为
(4)元素W位于周期表的位置:
(5)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液作该氧化物的吸收剂,写出吸收剂与过量该氧化物反应的离子方程式:

(1)写出实验室制氨气的化学反应方程式:
(2)实验室装置和所用样品都正确的是
(3)检验试管里是否收集满了氨气的方法是:
(4)上述装置中,其中的一个装置肯定收集不到氨气的是
(5)尾气处理时: 选择不可以用于处理氨气的

(6)氨的催化氧化是工业制硝酸的基础反应,写出反应的化学方程式
II. 将红热的固体单质甲放入显黄色的溶液乙中剧烈反应产生混合气体A,A 在常温下不与空气作用,有如下变化关系:

①推导出各物质的化学式B
②写出甲跟乙反应的化学方程式:
【推荐1】(1)实验室有一瓶久置的亚硫酸钠溶液,同学分成甲、乙两小组对该瓶亚硫酸钠溶液成分进行实验探究。
【提出问题】该溶液中溶质成分是什么?该溶液中亚硫酸钠的物质的量浓度是多少?
【查阅资料】 有较强还原性,在空气中易被氧气氧化
有较强还原性,在空气中易被氧气氧化
【作出猜想】猜想 :没有变质,成分是
:没有变质,成分是
猜想 :完全变质,成分是
:完全变质,成分是
猜想 :部分变质,成分是
:部分变质,成分是 和
和
【实验探究Ⅰ】
(1)甲组设计实验探究溶液是否变质
甲组 | 实验操作 | 现象 | 结论 |
步骤 | 取少量样品于试管中加入过量稀盐酸 | 产生气泡 | 溶液中含有 |
步骤 | 另取样品于试管中,滴加足量氯化钡溶液,再滴加足量稀盐酸 | 溶液中含有 |
实验结论:样品部分变质。样品在空气中变质的化学方程式:
【实验探究Ⅱ】
(2)乙组设计如下实验测定
 溶液物质的量浓度。
溶液物质的量浓度。①连好装置并检查装置气密性,在锥形瓶中放入 该样品,通入
该样品,通入 。
。
②称量C装置的质量为 。
。
③关闭活塞 ,用注射器推入浓硫酸至不再产生气泡,注射器可以换为
,用注射器推入浓硫酸至不再产生气泡,注射器可以换为
④打开活塞 ,再缓缓鼓入一定量的
,再缓缓鼓入一定量的 ,继续通入
,继续通入 的作用是
的作用是
⑤再次称量C装置的质量为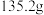 。
。

⑥计算出原溶液中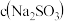 =
= 装置,实验结果将
装置,实验结果将 填“偏大”“不变”或“偏小”
填“偏大”“不变”或“偏小” 。
。
 ,是一种典型的维尔纳配合物。在实验室中,常以活性炭为催化剂,以H2O2、NH3、NH4Cl、CoCl2为原料在溶液中反应制备,化学方程式为:
,是一种典型的维尔纳配合物。在实验室中,常以活性炭为催化剂,以H2O2、NH3、NH4Cl、CoCl2为原料在溶液中反应制备,化学方程式为: ,某同学设计如图反应装置(夹持仪器及加热装置已省略)制备
,某同学设计如图反应装置(夹持仪器及加热装置已省略)制备 ,并测定该物质中NH3的含量:
,并测定该物质中NH3的含量:
回答下列问题:
(1)装置A中盛放浓氨水的仪器名称
(2)反应温度不宜超过50℃的原因是
(3)装置C的作用
(4)装置B中反应结束后,用冰水浴冷却后过滤,把沉淀溶解于沸水中,趁热过滤,再慢慢加入适量浓盐酸于滤液中,有大量橙黄色
 晶体析出。
晶体析出。①趁热过滤的目的是
②简述加入适量浓盐酸于滤液中,有大量橙黄色
 晶体析出的原因
晶体析出的原因(5)三氯化六氨合钴(Ⅲ)样品中NH3的含量测定涉及反应为
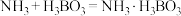 ;
;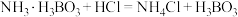 。所用装置(部分夹持仪器已省略)如图所示。
。所用装置(部分夹持仪器已省略)如图所示。
称取
 晶体样品mg于烧杯中,加入蒸馏水溶解后,由进样漏斗加入烧瓶中,然后再通过进样漏斗加入足量的NaOH溶液,蒸馏水冲洗后,在进样漏斗留一部分蒸馏水。开启电炉加热,烧瓶内充分反应
晶体样品mg于烧杯中,加入蒸馏水溶解后,由进样漏斗加入烧瓶中,然后再通过进样漏斗加入足量的NaOH溶液,蒸馏水冲洗后,在进样漏斗留一部分蒸馏水。开启电炉加热,烧瓶内充分反应 ,直至无气体放出。氨气被硼酸完全吸收后,用
,直至无气体放出。氨气被硼酸完全吸收后,用 的盐酸滴定锥形瓶中混合液,滴定终点时,消耗盐酸的体积VmL。三氯化六氨合钴(Ⅲ)样品中NH3的质量分数为
的盐酸滴定锥形瓶中混合液,滴定终点时,消耗盐酸的体积VmL。三氯化六氨合钴(Ⅲ)样品中NH3的质量分数为化工专家侯德榜发明的侯氏制碱法,其工艺流程图如下:
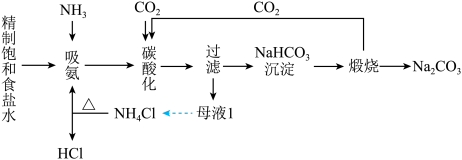
已知:氯化铵在加热条件下生成氨气和氯化氢。
(1)由工艺流程图可知可以循环使用的物质有
(2)写出碳酸化过程中发生反应的化学方程式:
(3)欲除去制得的碳酸钠中的碳酸氢钠可用加热的方法,用化学方程式表示其原理
(4)若在(3)中加热的时间较短,
 分解不完全,取加热了
分解不完全,取加热了 的
的 样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如图所示:
样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如图所示: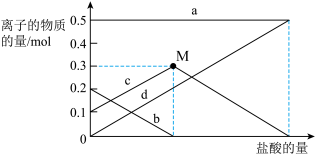
①则曲线b对应的溶液中的离子是
②该样品中
 和
和 的质量之比是
的质量之比是(5)产品分析:把11.6 g含有少量NaCl杂质的
 ,样品与足量稀硫酸反应后,产生的气体先通过足量浓硫酸后,再通过足量
,样品与足量稀硫酸反应后,产生的气体先通过足量浓硫酸后,再通过足量 ,
, 增重2.8 g。
增重2.8 g。①气体通过浓硫酸后与
 反应的化学方程式为
反应的化学方程式为②产品中杂质氯化钠的质量为
 和
和 )是一种常用家庭消毒液,某小组同学对“84”消毒液的制备及漂白性进行如下探究。
)是一种常用家庭消毒液,某小组同学对“84”消毒液的制备及漂白性进行如下探究。I.制备“84消毒液

(1)盛装
 仪器的名称为
仪器的名称为(2)装置A中反应的离子方程式为
(3)装置E中得到“84”消毒液的化学方程式为
(4)工业上是将氯气通入到
 的
的 溶液中来制备“84”消毒液,则生产
溶液中来制备“84”消毒液,则生产 该溶液理论上至少需消耗氯气的质量为
该溶液理论上至少需消耗氯气的质量为 (保留整数)。
(保留整数)。II.探究“84消毒液”的漂白性
资料:i.相同浓度时,
 氧化性强于
氧化性强于 ;
;ii.
 反应水溶液中所有物质表现出来的氧化-还原性,
反应水溶液中所有物质表现出来的氧化-还原性, 越大,氧化性越强。
越大,氧化性越强。某小组同学进行了如下实验:
①向
 “84消毒液”中加入
“84消毒液”中加入 水后,放入红色纸片,观察到纸片慢慢褪色。
水后,放入红色纸片,观察到纸片慢慢褪色。②向
 “84消毒液”中加入
“84消毒液”中加入 白醋后,放入红色纸片,观察到纸片迅速褪色。
白醋后,放入红色纸片,观察到纸片迅速褪色。③向
 “84消毒液”中加入
“84消毒液”中加入 浓盐酸后,观察到大量黄绿色气体产生。
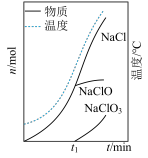
浓盐酸后,观察到大量黄绿色气体产生。④测得“84消毒液”在不同温度时
 随时间的变化曲线如下图。
随时间的变化曲线如下图。
(5)已知白醋显酸性,不具有漂白性。实验①、②现象不同的原因是
(6)实验③现象表明,向“84消毒液”中加入浓盐酸时会产生氯气,该反应的离子方程式为
(7)由实验④可得出的结论是
 值与温度有关,且温度越高,
值与温度有关,且温度越高, 值越低。
值越低。 不同的原因可能是
不同的原因可能是 。
。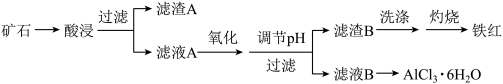
该工艺条件下,有关金属离子开始沉淀和完全沉淀的pH如表:
| 金属离子 |  |  |  |
| 开始沉淀的pH | 2.2 | 3.7 | 9.5 |
沉淀完全的pH( ) ) | 3.1 | 4.7 | 11.1 |
(2)“氧化”步骤采用双氧水,且反应放热,需分多次添加方式。其涉及的离子方程式:
(3)调节pH的范围为
(4)由
 制备无水
制备无水 的操作为
的操作为(5)写出滤渣A与氢氟酸反应的化学反应方程式
 。某科研小组制备并探究其性质。
。某科研小组制备并探究其性质。Ⅰ.制备Na2S2O4(加热等辅助仪器略去)

(1)Na2S2O4中硫元素的化合价为
(2)连接好装置后,检查其气密性良好的操作是
(3)添加药品、再次连接好装置:
①第一步,将A中生成的气体通往B中进行反应,在B装置生成连二亚硫酸锌的化合反应方程式为
②第二步,加入NaOH溶液,于28~35℃下反应生成Na2S2O4,该步反应的离子方程式为
第三步,将第二步的混合物过滤,并向滤液中加入固体NaCl,冷却至20℃,便有Na2S2O4晶体析出。
③第四步,将第三步所得混合物经
(4)装置C的作用是
Ⅱ.探究Na2S2O4的稳定性
(5)隔绝空气加热Na2S2O4固体完全分解得到固体产物Na2SO3、Na2S2O3和SO2,但科研小组没有做到完全隔绝空气,得到的固体产物中还含有Na2SO4。请设计实验证明该分解产物中含有Na2SO4。实验方案是



