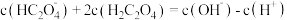25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgc(M2+)与溶液pH的变化关系如图所示,已知该温度下Ksp[Cu(OH)2]<Ksp[Fe(OH)2],下列说法正确的个数有
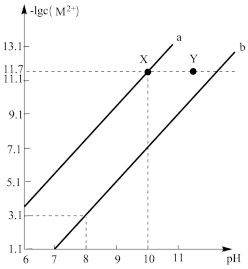
①b线表示Fe(OH)2饱和溶液中的变化关系,且Ksp[Fe(OH)2]=10-15.1
②当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中:c(Fe2+):c(Cu2+)=1:10-4.6
③向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液
④除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO

①b线表示Fe(OH)2饱和溶液中的变化关系,且Ksp[Fe(OH)2]=10-15.1
②当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中:c(Fe2+):c(Cu2+)=1:10-4.6
③向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液
④除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO
| A.1个 | B.2个 | C.3个 | D.4个 |
更新时间:2021-03-04 16:54:56
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】已知25℃时,AgI饱和溶液中c(Ag+)为 ,AgCl的饱和溶液中c(Ag+)为
,AgCl的饱和溶液中c(Ag+)为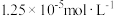 。若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/LAgNO3溶液,下列叙述正确的是
。若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/LAgNO3溶液,下列叙述正确的是
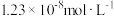 ,AgCl的饱和溶液中c(Ag+)为
,AgCl的饱和溶液中c(Ag+)为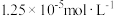 。若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/LAgNO3溶液,下列叙述正确的是
。若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/LAgNO3溶液,下列叙述正确的是A.混合溶液中 |
B.混合溶液中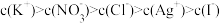 |
| C.加入AgNO3溶液时首先生成AgCl沉淀 |
D.混合溶液中 约为 约为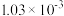 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+: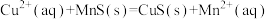 ,一定温度下,下列有关该反应的推理正确的是
,一定温度下,下列有关该反应的推理正确的是
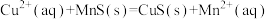 ,一定温度下,下列有关该反应的推理正确的是
,一定温度下,下列有关该反应的推理正确的是| A.该反应达到平衡时c(Cu2+)=c(Mn2+) |
| B.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 |
C.该反应的平衡常数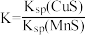 |
| D.平衡体系中加入少量CuS(s)后,c(Mn2+)变小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】某地山泉中所含的离子浓度如下表。向1.0 L该泉水中滴入1.0 mL 1.0 mol·L-1NaOH溶液,过滤得滤液X和沉淀Y。下列说法不正确的是
注:溶液中某种离子的浓度小于1.0×10-5 mol·L-1时,可认为该离子不存在;实验过程中,假设溶液体积不变;Ksp(CaCO3)=4.96×10-9、Ksp[Ca(OH)2]=4.68×10-5、Ksp(MgCO3)=6.82×10-6、Ksp[Mg(OH)2]=5.40×10-12。
| 山泉中的离子 | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
| 浓度/(mol·L-1) | 0.050 | 0.011 | 0.560 | 0.001 |
| A.c(Na+)=0.439 mol·L-1 |
| B.Y为CaCO3 |
| C.MgCO3的溶解度小于CaCO3 |
| D.若将含有Mg(HCO3)2的水溶液加热,则有Mg(OH)2生成 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】下列离子方程式中书写错误的是
A.用FeS除去废水中的Hg2+:FeS(s)+Hg2+(aq)  HgS(s)+Fe2+(aq) HgS(s)+Fe2+(aq) |
B.向Na2SO3溶液中通入少量Cl2: +Cl2+H2O= +Cl2+H2O= +2Cl-+2H+ +2Cl-+2H+ |
C.向酸性高锰酸钾溶液中滴加过氧化氢: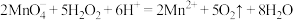 |
D.在弱碱性条件下FeS与 反应:FeS+ 反应:FeS+ +4H2O=Fe(OH)3↓+Cr(OH)3↓+S↓+2OH- +4H2O=Fe(OH)3↓+Cr(OH)3↓+S↓+2OH- |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列方程式与所给事实不相符的是
A.向ZnS浊液中滴加 溶液,白色浑浊变为黑色: 溶液,白色浑浊变为黑色: |
B.用白醋去除水垢的离子方程式: |
C.向 溶液中滴加少量浓 溶液中滴加少量浓 ,溶液橙色加深: ,溶液橙色加深: |
D.氯化铵的水溶液显酸性: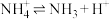 |
您最近一年使用:0次
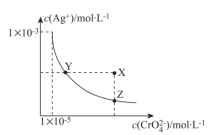
【推荐1】 时,
时, (橘红色)在水溶液中的沉淀溶解平衡曲线如图所示,已知:
(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示,已知: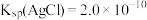 。下列说法错误的是
。下列说法错误的是
 时,
时, (橘红色)在水溶液中的沉淀溶解平衡曲线如图所示,已知:
(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示,已知: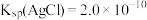 。下列说法错误的是
。下列说法错误的是
A. 时, 时, 和 和 的饱和溶液中 的饱和溶液中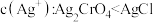 |
B.分散系稳定性: |
C. 时,Y点和Z点的 时,Y点和Z点的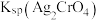 相等 相等 |
D.向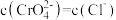 的混合溶液中滴入 的混合溶液中滴入 溶液,先生成白色沉淀 溶液,先生成白色沉淀 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】室温时,下列各溶液的叙述中正确的是
| A.将AgCl与AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,析出的AgCl沉淀少于AgBr沉淀 |
| B.已知酸性:HF>CH3COOH,pH相等的NaF与CH3COOK溶液中:[c(Na+)-c(F-)]<[c(K+)-c(CH3COO-) ] |
| C.0.1mol/L的氨水的pH=a,0.01mol/L的氨水的pH=b,则a-1>b |
| D.0.10mol·L-1CH3COONa溶液中通入HCl至溶液的pH恰好等于7,则c(Na+)>c(CH3COOH)=c(Cl-) |
您最近一年使用:0次


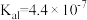
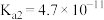

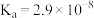 ]
]

 溶液:
溶液:
 气体:
气体: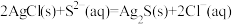
 体系中
体系中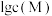 与
与 代表
代表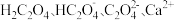 ),已知
),已知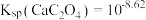 、
、 。下列有关叙述正确的是
。下列有关叙述正确的是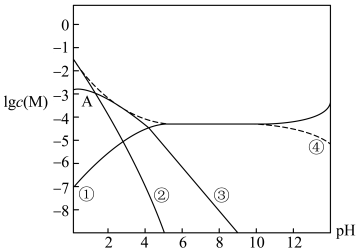
 的
的 数量级为
数量级为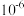
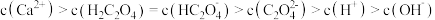
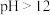 时,曲线①呈上升趋势的原因是部分
时,曲线①呈上升趋势的原因是部分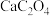 转化为
转化为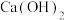
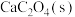 溶于水所得饱和溶液中存在:
溶于水所得饱和溶液中存在: