(1)滴定时边滴边摇动锥形瓶,眼睛应注意观察
(2)盛装氢氧化钠溶液应该选择图中滴定管


(3)滴定结果如表所示:
| 滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 0.60 | 20.60 |
| 3 | 25.00 | 0.20 | 20.19 |
(4)氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去24mLl.0×l0-4mol/L的KMnO4溶液。
Ⅰ.判断滴定终点的方法是
Ⅱ.写出用KMnO4滴定H2C2O4的离子方程式
Ⅲ.计算:血液中含钙离子的浓度为
相似题推荐
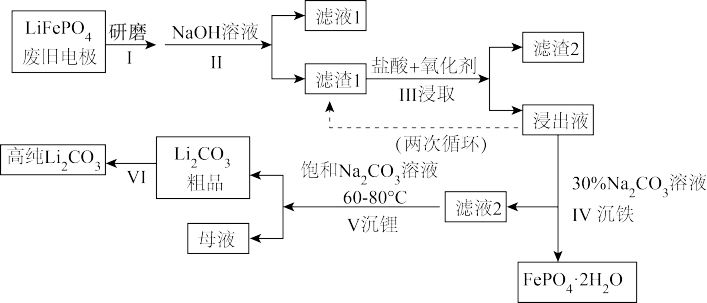
资料:碳酸锂在水中溶解度:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
(2)“过程ii”加入足量 NaOH 溶液的离子反应方程式是
(3)“过程iii ”采用不同氧化剂分别进行实验,均采用 Li含量为3.7% 的原料,控制pH 为3.5,浸取1.5h后,实验结果如表所示:
| 序号 | 酸 | 氧化剂 | 浸出液Li+浓度(g/L) | ) 滤渣中Li含量/% |
| 实验1 | HCl | H2O2 | 9.02 | 0.10 |
| 实验2 | HCl | NaClO3 | 9.05 | 0.08 |
| 实验3 | HCl | O2 | 7.05 | 0.93 |
②“过程iii”得到的浸出液循环两次的目的是
(4)浸出液中存在大量 H2PO4 -和 HPO
 ,已知:H2PO
,已知:H2PO ⇌HPO
⇌HPO +H+,HPO
+H+,HPO ⇌PO
⇌PO +H+,结合
+H+,结合(5)“过程v”中,若“沉锂”中c(Li+ )=1.0mol·L-1,加入等体积饱和 Na2CO3溶液(浓度约为1.78mol/L),此时实验所得沉锂率为
(6)简述“过程vi”的操作:
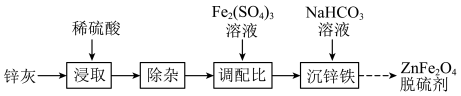
(1)“浸取”时需不断通入高温水蒸气,其目的是
(2)“除杂”包括:向浸取后的滤液中加足量锌粉、过滤、加H2O2氧化等步骤。过滤所得滤渣的成分为(填化学式)
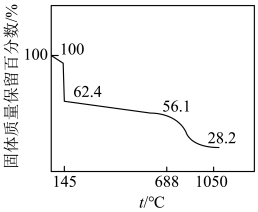
(3)ZnSO4溶液经结晶可得ZnSO4∙7H2O固体。加热该固体,固体质量保留百分数与温度的关系如图所示。温度从688℃升高到1050℃时,分解生成的产物中有两种气体(只有一种是氧化物),该过程中发生反应的化学方程式为
(4)400℃时,将一定比例H2、H2S的混合气体以一定流速通过装有ZnFe2O4脱硫剂的硫化反应器进行硫化。已知:硫化过程中ZnFe2O4反应后生成ZnS和FeS,该过程中发生的化学反应方程式为
(5)①氧化锌晶体的一种晶胞是如图甲所示的立方晶胞,其中与Zn原子距离最近的O原子数目有
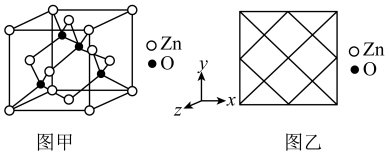
②Zn2+能形成多种配离子,已知Zn2+形成的一种配离子[Zn(NH3)2(H2O)2]2+只有一种空间结构,则[Zn(NH3)4]2+的空间结构为
【推荐3】“材料”的发现和使用往往会极大地推动生产、生活的发展,一些材料的出现甚至具有里程碑式划时代的意义。请回答下列问题:
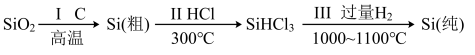
(1)无机非金属材料。高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。这种材料可以按下列方法制备:
①写出步骤I的化学方程式:
②步骤II经过冷凝得到的SiHCl3(沸点为33.0℃)中含有少量的SiCl4(沸点为57.6℃)和HCl(沸点为-84.7℃),提纯SiHCl3的实验方法是
(2)磁性材料。这种黑色材料含有某种铁的氧化物,请写出该氧化物溶于稀硫酸溶液的化学方程式
(3)激光材料。我国是激光技术先进的国家,红宝石(Al2O3)是最早用于产生激光的材料。请用离子方程式来证明它是一种两性氧化物:
(4)高分子材料。一种新型高效净水剂[Al Fe (OH)n Cl6-n]m属于无机高分子材料,它广泛应用于生活用水和工业污水的处理,其中铁元素的化合价为
(5)合金材料。取等质量的两份某镁铝合金分别加入足量的稀盐酸和氢氧化钠溶液中,产生的H2体积分别为100mL、90mL则该合金中镁,铝的质量之比为
(6)消毒材料。棕黄色强刺激性气体Cl2O为国际公认高效安全灭菌消毒剂之一,实验室可用潮湿的Cl2与Na2CO3反应制取少量Cl2O,补充完整并配平下列反应方程式:
_______Cl2+_______Na2CO3+_______=_______NaHCO3+_______NaCl+_______Cl2O
【测定原理】4MnO
 +5HCHO+12H+=4Mn2++5CO2↑+11H2O
+5HCHO+12H+=4Mn2++5CO2↑+11H2O【测定装置】部分装置如图1所示。


(1)①检查装置的气密性(气密性良好)。
②用
③将1.00×10-3mol/L草酸标准溶液置于酸式滴定管中备用。
④
⑥将洗气瓶中溶液(包括洗涤液)转移到锥形瓶中,再用标准草酸溶液进行滴定。有关滴定管的正确操作顺序为:D
A.蒸馏水洗涤
B.装入滴定液至零刻度以上
C.调整滴定液液面至零刻度或零刻度以下
D.检漏
E.排除气泡
F.用滴定液润洗2至3次
G.记录起始读数,滴定到终点,记录滴定所消耗的草酸溶液的体积;
若终点时读数如图所示,则滴定结果

⑦再重复实验2次,实验所消耗草酸溶液的体积平均值为12.38mL。
(2)计算该居室内空气中甲醛的浓度
a.将锥形瓶置于酸式滴定管下,锥形瓶下垫一张白纸;
b.分别取25.00mL酸、碱滴定管各一支,洗涤并用待装液润洗;
c.打开酸式滴定管旋塞开始滴定直到终点,记录下终点时滴定管上的读数;
d.取一个用蒸馏水洗净的锥形瓶,从碱式滴定管中放出20.00mL待测碱液于锥形瓶中,滴入2至3滴酚酞试液;
e.碱式滴定管中加入待测烧碱溶液,酸式滴定管中加入0.1000mol·L-1的稀盐酸标准溶液,并将两支滴定管尖嘴部分的气泡均赶尽,记下液面刻度;
f.再重复上述操作2次。
三次测定获得的数据如下表:
| 实验次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 0.45 | 24.40 |
| 2 | 20.00 | 2.20 | 26.25 |
| 3 | 20.00 | 0.10 | 17.10 |
(2)实验中,除用酚酞作指示剂外,还可以选用
(3)如何判断滴定达到了终点?
(4)根据实验数据,计算待测碱液的浓度为
(5)下列操作中可能使所测烧碱溶液的浓度数值偏低的是
A.操作b中,未润洗酸式滴定管
B.操作e中,碱式滴定管尖嘴处的气泡未赶出,而取液后其尖嘴处的气泡消失了
C.操作d中,装碱液时,锥形瓶中还有少量蒸馏水
D.操作c中,滴定终点时发现酸式滴定管尖嘴处悬挂着一滴溶液
E.酸式滴定管读数时,滴定前仰视读数,滴定结束时俯视读数
I.制备次磷酸钙[Ca(H2PO2)2]溶液:
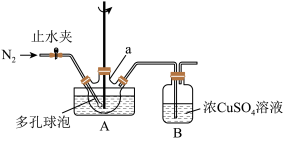
(1)实验前,经检验装置的气密性良好。其中仪器a的名称是
(2)将一定量的白磷和过量的熟石灰依次投入仪器a中,加水调成稀浆状,搅拌下加热升温到90℃,至无PH3,气体放出时停止反应。则a中发生反应的化学方程式是
II.制备次磷酸钠(NaH2PO2)溶液:
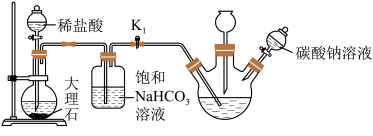
(3)过滤除去未反应的固体物质,然后通入二氧化碳,其目的是使溶解在滤液中的氢氧化钙转化成碳酸钙沉淀而除去,再向次磷酸钙溶液中加入碳酸钠溶液,判断次磷酸钙完全反应的方法是
III.制备次磷酸钠晶体:
(4)过滤除去碳酸钙后将滤液蒸发浓缩,该操作需在
IV.测定次磷酸钠纯度:
(5)测量步骤:称取8.8g样品溶于水配成25mL溶液置于锥形瓶中,再加盐酸25mL,准确加入c1mol∙L-1碘标准溶液V1mL,盖好瓶塞,放在暗处30min。打开瓶塞,用少量蒸馏水洗瓶颈及瓶塞后,以淀粉溶液作指示剂,用c2mol∙L-1硫代硫酸钠标准溶液进行滴定,消耗硫代硫酸钠溶液的体积为V2mL(已知I2+2Na2S2O3=Na2S4O6+2NaI)。
①判断达到滴定终点的现象是
②晶体中NaH2PO2的质量分数是



