以锌灰(含ZnO及少量PbO、CuO、Fe2O3、SiO2)和Fe2(SO4)3为原料制备的ZnFe2O4脱硫剂,可用于脱除煤气中的H2S。脱硫剂的制备过程可表示为
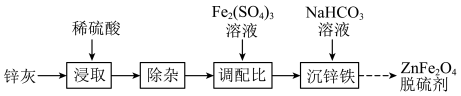
(1)“浸取”时需不断通入高温水蒸气,其目的是___________ 。
(2)“除杂”包括:向浸取后的滤液中加足量锌粉、过滤、加H2O2氧化等步骤。过滤所得滤渣的成分为(填化学式)___________ 。
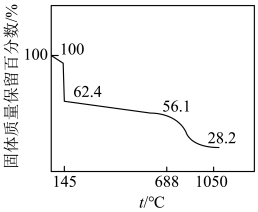
(3)ZnSO4溶液经结晶可得ZnSO4∙7H2O固体。加热该固体,固体质量保留百分数与温度的关系如图所示。温度从688℃升高到1050℃时,分解生成的产物中有两种气体(只有一种是氧化物),该过程中发生反应的化学方程式为___________ 。
(4)400℃时,将一定比例H2、H2S的混合气体以一定流速通过装有ZnFe2O4脱硫剂的硫化反应器进行硫化。已知:硫化过程中ZnFe2O4反应后生成ZnS和FeS,该过程中发生的化学反应方程式为______________________ 。
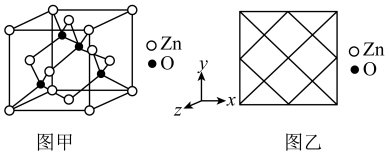
(5)①氧化锌晶体的一种晶胞是如图甲所示的立方晶胞,其中与Zn原子距离最近的O原子数目有___________ 个,请在图乙中画出该晶胞沿y轴方向的平面投影图___________ 。
②Zn2+能形成多种配离子,已知Zn2+形成的一种配离子[Zn(NH3)2(H2O)2]2+只有一种空间结构,则[Zn(NH3)4]2+的空间结构为___________ 。

(1)“浸取”时需不断通入高温水蒸气,其目的是
(2)“除杂”包括:向浸取后的滤液中加足量锌粉、过滤、加H2O2氧化等步骤。过滤所得滤渣的成分为(填化学式)
(3)ZnSO4溶液经结晶可得ZnSO4∙7H2O固体。加热该固体,固体质量保留百分数与温度的关系如图所示。温度从688℃升高到1050℃时,分解生成的产物中有两种气体(只有一种是氧化物),该过程中发生反应的化学方程式为

(4)400℃时,将一定比例H2、H2S的混合气体以一定流速通过装有ZnFe2O4脱硫剂的硫化反应器进行硫化。已知:硫化过程中ZnFe2O4反应后生成ZnS和FeS,该过程中发生的化学反应方程式为
(5)①氧化锌晶体的一种晶胞是如图甲所示的立方晶胞,其中与Zn原子距离最近的O原子数目有

②Zn2+能形成多种配离子,已知Zn2+形成的一种配离子[Zn(NH3)2(H2O)2]2+只有一种空间结构,则[Zn(NH3)4]2+的空间结构为
更新时间:2024-04-04 08:45:06
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】 是一种强氧化剂,具有高效、广谱、安全的杀菌消毒能力。但是液体
是一种强氧化剂,具有高效、广谱、安全的杀菌消毒能力。但是液体 具有强烈刺激性、不稳定性、高浓度易爆等特点,可通过如图(加热及夹持装置已省略)装置制备稳定性
具有强烈刺激性、不稳定性、高浓度易爆等特点,可通过如图(加热及夹持装置已省略)装置制备稳定性 。回答下列问题:
。回答下列问题:
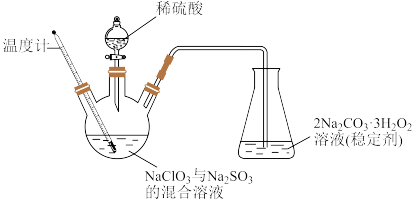
(1)盛装稀硫酸的仪器名称为___________ ;控制温度为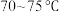 ,缓慢滴加稀硫酸,则该过程中适宜的加热方式为
,缓慢滴加稀硫酸,则该过程中适宜的加热方式为___________ ;写出生成 反应的化学方程式:
反应的化学方程式:___________ 。
(2)长导管的作用为___________ 。
(3)使用过碳酸钠( ,在水中转化为
,在水中转化为 和
和 )溶液作稳定剂时,
)溶液作稳定剂时, 被还原成较稳定的
被还原成较稳定的 ,可较长时间保存,写出锥形瓶中
,可较长时间保存,写出锥形瓶中 与
与 反应的离子方程式:
反应的离子方程式:___________ 。
(4)稳定液中的 并不能起到杀菌的作用,因此在实际应用中,必须对其进行活化,使
并不能起到杀菌的作用,因此在实际应用中,必须对其进行活化,使 转化成
转化成 释放出来。
释放出来。 活化率与不同活化剂(浓度均为
活化率与不同活化剂(浓度均为 )用量的关系如表。
)用量的关系如表。
①请分析盐酸活化效果最好的原因:___________ 。
②使用盐酸作活化剂时发生反应的离子方程式为___________ 。
 是一种强氧化剂,具有高效、广谱、安全的杀菌消毒能力。但是液体
是一种强氧化剂,具有高效、广谱、安全的杀菌消毒能力。但是液体 具有强烈刺激性、不稳定性、高浓度易爆等特点,可通过如图(加热及夹持装置已省略)装置制备稳定性
具有强烈刺激性、不稳定性、高浓度易爆等特点,可通过如图(加热及夹持装置已省略)装置制备稳定性 。回答下列问题:
。回答下列问题:
(1)盛装稀硫酸的仪器名称为
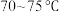 ,缓慢滴加稀硫酸,则该过程中适宜的加热方式为
,缓慢滴加稀硫酸,则该过程中适宜的加热方式为 反应的化学方程式:
反应的化学方程式:(2)长导管的作用为
(3)使用过碳酸钠(
 ,在水中转化为
,在水中转化为 和
和 )溶液作稳定剂时,
)溶液作稳定剂时, 被还原成较稳定的
被还原成较稳定的 ,可较长时间保存,写出锥形瓶中
,可较长时间保存,写出锥形瓶中 与
与 反应的离子方程式:
反应的离子方程式:(4)稳定液中的
 并不能起到杀菌的作用,因此在实际应用中,必须对其进行活化,使
并不能起到杀菌的作用,因此在实际应用中,必须对其进行活化,使 转化成
转化成 释放出来。
释放出来。 活化率与不同活化剂(浓度均为
活化率与不同活化剂(浓度均为 )用量的关系如表。
)用量的关系如表。活化剂用量 活化率 活化剂 | 5mL | 10mL | 15mL | 20mL | 25mL |
盐酸 | 29.32% | 58.02% | 86.91% | 99.57% | 100.00% |
醋酸 | 26.75% | 55.52% | 79.01% | 97.22% | 97.53% |
柠檬酸 | 20.03% | 41.22% | 52.13% | 53.76% | 59.80% |
②使用盐酸作活化剂时发生反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】钛酸钡(BaTiO3)是一种强介电化合物,是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶 瓷工业的支柱”。
Ⅰ、固相合成法是钛酸钡的传统制备方法,典型的工艺是将等物质的量的碳酸钡和二氧化钛混合,在1500℃下反应 24 小时。
(1)写出发生反应的化学方程式:_____ 。
(2)该工艺的优点为工艺简单,不足之处为_____ 。
Ⅱ、工业上还可以 BaCO3、TiCl4为原料,采用草酸盐共沉淀法制备草酸氧钛钡晶体[BaTiO(C2O4)2•4H2O],再高温煅烧制得钛酸钡粉末,其制备工业流程如图所示。
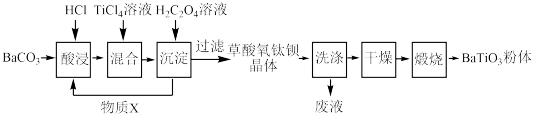
(3)为提高 BaCO3的酸浸率,可采取的措施为_____ (任答一点)。
(4)加入 H2C2O4溶液时,可循环使用的物质 X 是_____ 。
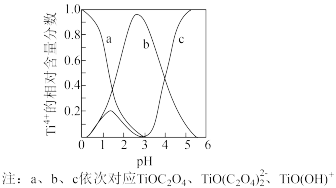
(5)研究表明,钛离子在不同 pH 下可以 TiO(OH)+、TiOC2O4或 TiO(C2O4)2等形式存在(如图),所以在制备草酸氧钛钡晶体时要用到氨水调节混合溶液的 pH. 请结合图示信息分析,混合溶液的最佳 pH 为_____ 左右。
(6)高温煅烧草酸氧钛钡晶体[BaTiO(C2O4)2•4H2O]得到 BaTiO3 的同时,生成高温气体产物有 CO、_____ 和_____ 。成都七中某兴趣小组在实验室里模拟“高温煅烧”操作时所使用的陶瓷仪器有_____ 。
(7)将 TiCl4水解产物加热脱水可生成 TiO2,写出 TiCl4 水解的化学方程式:_____ 。
Ⅰ、固相合成法是钛酸钡的传统制备方法,典型的工艺是将等物质的量的碳酸钡和二氧化钛混合,在1500℃下反应 24 小时。
(1)写出发生反应的化学方程式:
(2)该工艺的优点为工艺简单,不足之处为
Ⅱ、工业上还可以 BaCO3、TiCl4为原料,采用草酸盐共沉淀法制备草酸氧钛钡晶体[BaTiO(C2O4)2•4H2O],再高温煅烧制得钛酸钡粉末,其制备工业流程如图所示。

(3)为提高 BaCO3的酸浸率,可采取的措施为
(4)加入 H2C2O4溶液时,可循环使用的物质 X 是
(5)研究表明,钛离子在不同 pH 下可以 TiO(OH)+、TiOC2O4或 TiO(C2O4)2等形式存在(如图),所以在制备草酸氧钛钡晶体时要用到氨水调节混合溶液的 pH. 请结合图示信息分析,混合溶液的最佳 pH 为

(6)高温煅烧草酸氧钛钡晶体[BaTiO(C2O4)2•4H2O]得到 BaTiO3 的同时,生成高温气体产物有 CO、
(7)将 TiCl4水解产物加热脱水可生成 TiO2,写出 TiCl4 水解的化学方程式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】工业合成氨是20世纪的伟大成就之一,但化肥的过度使用、硝酸工业废气和机动车尾气的排放,给水体和大气带来了一定程度的污染,需要进行综合处理。
Ⅰ.合成氨
(1)工业合成氨反应为: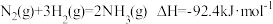 。下列说法正确的是_______。
。下列说法正确的是_______。
(2)一种电化学合成氨的原理如图所示。产生 的电极反应式是
的电极反应式是_______ 。

Ⅱ.含氮污染的处理
(3)水体中氨氮处理:在微生物作用下,废水中 经两步反应被氧化成
经两步反应被氧化成 :
:


则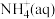 全部氧化成
全部氧化成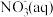 的热化学方程式是
的热化学方程式是_______ 。
(4)大气中NO处理:电解 溶液(调节起始
溶液(调节起始 约为9)获得
约为9)获得 溶液,可用于去除大气中NO。其他条件相同,电解所得溶液中相关成分的浓度与电流强度的关系如图所示。
溶液,可用于去除大气中NO。其他条件相同,电解所得溶液中相关成分的浓度与电流强度的关系如图所示。

①用电解所得 溶液氧化NO生成
溶液氧化NO生成 和
和 ,其离子方程式为
,其离子方程式为_______ 。
②电流强度大于4A,随着电流强度增大,电解所得溶液对NO去除率下降,其原因是_______ 。
Ⅰ.合成氨
(1)工业合成氨反应为:
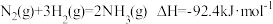 。下列说法正确的是_______。
。下列说法正确的是_______。| A.采用高温以提高反应的平衡转化率 |
B.采用高压以加快反应速率,提高 的产量 的产量 |
C.为提高 转化率,可适当增大 转化率,可适当增大 的浓度 的浓度 |
D.生产过程中将 液化分离,有利于氨的合成 液化分离,有利于氨的合成 |
 的电极反应式是
的电极反应式是
Ⅱ.含氮污染的处理
(3)水体中氨氮处理:在微生物作用下,废水中
 经两步反应被氧化成
经两步反应被氧化成 :
:

则
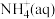 全部氧化成
全部氧化成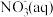 的热化学方程式是
的热化学方程式是(4)大气中NO处理:电解
 溶液(调节起始
溶液(调节起始 约为9)获得
约为9)获得 溶液,可用于去除大气中NO。其他条件相同,电解所得溶液中相关成分的浓度与电流强度的关系如图所示。
溶液,可用于去除大气中NO。其他条件相同,电解所得溶液中相关成分的浓度与电流强度的关系如图所示。
①用电解所得
 溶液氧化NO生成
溶液氧化NO生成 和
和 ,其离子方程式为
,其离子方程式为②电流强度大于4A,随着电流强度增大,电解所得溶液对NO去除率下降,其原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】 在现代工业生产中应用广泛,查阅资料得:无水
在现代工业生产中应用广泛,查阅资料得:无水 在空气中易潮解,加热易升华。
在空气中易潮解,加热易升华。
(1)用丁达尔效应鉴别 胶体和
胶体和 溶液的操作是
溶液的操作是____________ (写出具体实验操作、结论)。
(2)电子工业中用 溶液腐蚀敷在绝缘板上的铜,从而制造印刷电路板,写出
溶液腐蚀敷在绝缘板上的铜,从而制造印刷电路板,写出 溶液与铜反应的离子方程式:
溶液与铜反应的离子方程式:__________________ 。该反应的还原剂是______ 。
(3)硫化氢( )是一种有毒的气体,可用
)是一种有毒的气体,可用 溶液吸收,生成单质硫(S)沉淀。
溶液吸收,生成单质硫(S)沉淀。 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为____________ 。该反应中氧化产物与还原产物的物质的量之比为______ 。
(4)某小组同学设计了制备无水) 的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
步骤Ⅰ.检验装置的气密性;
步骤Ⅱ.通入干燥的 ,赶尽装置中的空气;
,赶尽装置中的空气;
步骤Ⅲ.用酒精灯在铁屑下方加热至反应完成;
步骤Ⅳ.体系冷却后,停止通入 ,并用干燥的
,并用干燥的 赶尽
赶尽 ,将收集器密封。
,将收集器密封。
①装置A中发生反应的化学方程式为__________________ 。
②装置B中冷水浴的作用为____________ 。
 在现代工业生产中应用广泛,查阅资料得:无水
在现代工业生产中应用广泛,查阅资料得:无水 在空气中易潮解,加热易升华。
在空气中易潮解,加热易升华。(1)用丁达尔效应鉴别
 胶体和
胶体和 溶液的操作是
溶液的操作是(2)电子工业中用
 溶液腐蚀敷在绝缘板上的铜,从而制造印刷电路板,写出
溶液腐蚀敷在绝缘板上的铜,从而制造印刷电路板,写出 溶液与铜反应的离子方程式:
溶液与铜反应的离子方程式:(3)硫化氢(
 )是一种有毒的气体,可用
)是一种有毒的气体,可用 溶液吸收,生成单质硫(S)沉淀。
溶液吸收,生成单质硫(S)沉淀。 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为(4)某小组同学设计了制备无水)
 的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
步骤Ⅰ.检验装置的气密性;
步骤Ⅱ.通入干燥的
 ,赶尽装置中的空气;
,赶尽装置中的空气;步骤Ⅲ.用酒精灯在铁屑下方加热至反应完成;
步骤Ⅳ.体系冷却后,停止通入
 ,并用干燥的
,并用干燥的 赶尽
赶尽 ,将收集器密封。
,将收集器密封。①装置A中发生反应的化学方程式为
②装置B中冷水浴的作用为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】金属钛(Ti)广泛应用于航空、军工、医疗等领域。以钛铁矿(主要含有FeTiO3及少量SiO2、FeO、Fe2O3、CaO)制备金属Ti的工艺流程如下:
(1)“酸浸”前钛铁矿需要粉碎研磨,其目的是_______ 。
(2)FeTiO3中Ti的化合价为_______ ,“滤渣”中主要含有SiO2和_______ (填化学式)。
(3)“酸浸”中发生主要反应的化学方程式为_______ 。
(4)试剂X为_______ (填化学式),其作用是_______ 。
(5)“高温冶炼”过程需在氩气气氛中进行,其原因是_______ 。
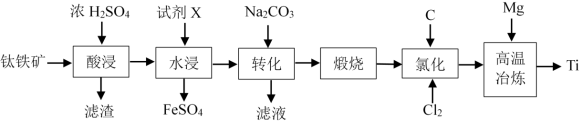
(1)“酸浸”前钛铁矿需要粉碎研磨,其目的是
(2)FeTiO3中Ti的化合价为
(3)“酸浸”中发生主要反应的化学方程式为
(4)试剂X为
(5)“高温冶炼”过程需在氩气气氛中进行,其原因是
您最近一年使用:0次
【推荐3】氧化锌在工业和生活中的运用非常广泛,以闪锌矿(主要成分为ZnS,含有少量FeS和SiO2)为原料制备活性氧化锌的工艺流程如下,请回答下列问题:
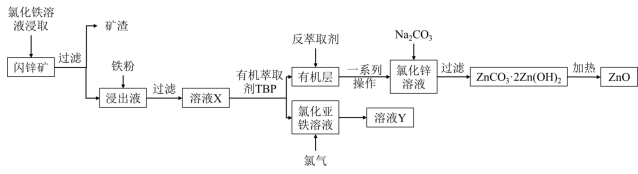
(1)浸取前,将闪锌矿粉碎的目的是_________ 。
(2)矿渣中除了有淡黄色的物质,还有_________ (填化学式);浸取时FeS发生反应的离子方程式为_________ 。
(3)加入铁粉的目的是_________ ,能循环利用的无机物是_________ (填化学式)。
(4)生成ZnCO3·2Zn(OH)2的离子方程式为_________ 。
(5)有机萃取剂TBP能将氯化亚铁和氯化锌分离的原因是_________ 。

(1)浸取前,将闪锌矿粉碎的目的是
(2)矿渣中除了有淡黄色的物质,还有
(3)加入铁粉的目的是
(4)生成ZnCO3·2Zn(OH)2的离子方程式为
(5)有机萃取剂TBP能将氯化亚铁和氯化锌分离的原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】钯(Pd)、锌及其化合物在合成酮类物质中有极其重要的作用,如图为合成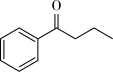 的反应过程:
的反应过程:
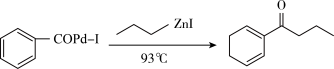
回答下列问题:
(1)O原子价电子排布图为___ ,其能量最高的能级是__ (填能层符号)。
(2)N、C、O三种元素的第一电离能由大到小的顺序为__ 。
(3) 中碳原子的杂化方式为
中碳原子的杂化方式为__ 。
(4)ZnCl2溶液中加入足量氨水,发生的反应为ZnCl2+4NH3·H2O=[Zn(NH3)4]Cl2+4H2O。
①上述反应涉及的物质中,固态时属于分子晶体的是__ 。
②NH3的空间构型为__ 。
③1mol[Zn(NH3)4]Cl2中含有__ 个σ键。
(5)Zn和Cu可形成金属互化物(ZnCu),该金属互化物中所有金属原子均按面心立方最密堆积,若所有Cu均位于晶胞的面心,则Zn位于晶胞的___ 。
(6)金属钯的堆积方式如图所示:

①该晶胞中原子的空间利用率为___ (用含π的式子表示)。
②若该晶胞参数a=638pm,则该晶胞密度为___ (列出计算表达式)g·cm-3。
 的反应过程:
的反应过程:
回答下列问题:
(1)O原子价电子排布图为
(2)N、C、O三种元素的第一电离能由大到小的顺序为
(3)
 中碳原子的杂化方式为
中碳原子的杂化方式为(4)ZnCl2溶液中加入足量氨水,发生的反应为ZnCl2+4NH3·H2O=[Zn(NH3)4]Cl2+4H2O。
①上述反应涉及的物质中,固态时属于分子晶体的是
②NH3的空间构型为
③1mol[Zn(NH3)4]Cl2中含有
(5)Zn和Cu可形成金属互化物(ZnCu),该金属互化物中所有金属原子均按面心立方最密堆积,若所有Cu均位于晶胞的面心,则Zn位于晶胞的
(6)金属钯的堆积方式如图所示:

①该晶胞中原子的空间利用率为
②若该晶胞参数a=638pm,则该晶胞密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】A、 B、 C、 D、 E、 F 为前四周期元素且原子序数依次增大,其中基态 A 原子的电子分布在 3 个能级,且每个能级所含的电子数相同; C 的原子核外最外层有 6 个运动状态不同的电子; D 是短周期元素中电负性最小的元素; E 的最高价氧化物的水化物酸性最强; 基态 F 原子核外最外层只有一个电子, 其余能层均充满电子。 G 元素与 D 元素同主族,且相差 3 个周期。
(1)元素 A、 B、 C 的第一电离能由小到大的是____________________ (用元素符号表示)。
(2)E的最高价含氧酸中 E 原子的杂化方式为_____________ 。 基态 E 原子中,核外电子占据最高能级的电子云轮廓形状为____________________________ 。
(3)F原子的外围电子排布式为_______________________ , F 单质晶体中原子的堆积方式是下图中的_______ (填写“甲”、 “乙”或“丙”) ,该晶体的空间利用率为_____________ 。(保留两位有效数字)

(4)已知元素 A、B形成的(AB)2分子中所有原子都满足 8电子稳定结构,则其分子中 σ键与 π键数目之比为__________ 。
(5)通常情况下, D 单质的熔沸点比 G 单质高,原因是_________________________ 。
(6)已知 DE 晶体的晶胞如下图所示:

若将 DE 晶胞中的所有 E 离子去掉,并将 D 离子全部换为 A 原子,再在其中的 4 个“小立方体”中心各放置一个A 原子,且这 4 个“小立方体”不相邻。位于“小立方体”中的 A 原子与最近的 4 个 A 原子以单键相连,由此表示 A的一种晶体的晶胞(已知 A—A 键的键长为 a cm, NA表示阿伏伽德罗常数),则该晶胞中含有_________ 个 A 原子,该晶体的密度是______________ g·cm-3(列式表示) 。
(1)元素 A、 B、 C 的第一电离能由小到大的是
(2)E的最高价含氧酸中 E 原子的杂化方式为
(3)F原子的外围电子排布式为

(4)已知元素 A、B形成的(AB)2分子中所有原子都满足 8电子稳定结构,则其分子中 σ键与 π键数目之比为
(5)通常情况下, D 单质的熔沸点比 G 单质高,原因是
(6)已知 DE 晶体的晶胞如下图所示:

若将 DE 晶胞中的所有 E 离子去掉,并将 D 离子全部换为 A 原子,再在其中的 4 个“小立方体”中心各放置一个A 原子,且这 4 个“小立方体”不相邻。位于“小立方体”中的 A 原子与最近的 4 个 A 原子以单键相连,由此表示 A的一种晶体的晶胞(已知 A—A 键的键长为 a cm, NA表示阿伏伽德罗常数),则该晶胞中含有
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】氮族元素和卤族元素都能形成许多种物质。
(1)基态Br原子的价电子排布式为_______ 。
(2)HCN的电子式为_______ ;其中心C原子的杂化类型为_______ ;磷、氟两种元素的电负性由大到小的顺序_______ (用元素符号表示)。
(3)已知PCl3是不稳定的无色液体,遇水易水解且可生成两种酸,所得含氧酸(电离常数Ka1=1.6×10-2和Ka2=7×10-7)和足量的NaOH溶液反应生成盐的化学式为_______ 。
(4)表中提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是_______ 。
(5)已知KCl、MgO、CaO这三种晶体的结构与NaCl晶体结构相似。如表给出了两种晶体的晶格能数据:四种晶体的熔点从高到低的顺序为_______ 。
(6)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构与NaCl相同(如图所示)。据此可判断该钙的氧化物的化学式为_______ 。已知该氧化物的密度是ρg·cm-3,则晶胞内最近的两个钙离子间的距离为_______ cm(只要求列出算式,不必计算出数值结果,阿伏加德罗常数的值为NA)。
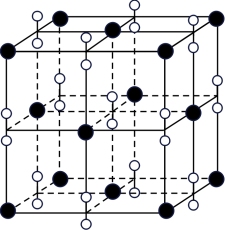
(1)基态Br原子的价电子排布式为
(2)HCN的电子式为
(3)已知PCl3是不稳定的无色液体,遇水易水解且可生成两种酸,所得含氧酸(电离常数Ka1=1.6×10-2和Ka2=7×10-7)和足量的NaOH溶液反应生成盐的化学式为
(4)表中提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是
| 元素 | F | Cl | Br | I |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
| 晶体 | NaCl | CaO |
| 晶格能(kJ/mol) | 786 | 3401 |

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】实验室需要制备纯净的氯化钾。现有含少量KBr和K2SO4的氯化钾样品,按照下图所示的实验方案进行提纯。
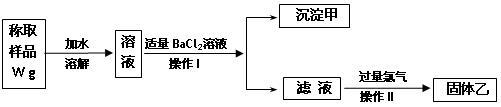
请回答下列问题:
(1)操作I的名称为________________ ,操作II所需要的玻璃仪器有_____________ 。
(2)若用硝酸钡来代替氯化钡,是否可行?请说明理由。
___________________ 。
(3)若实验所得固体甲、乙的质量分别为W1g和W2g,则样品中KBr的质量分数计算式为________________ 。
(4)某同学对该实验方案提出质疑,他认为加适量氯化钡溶液不容易控制,应该加入过量氯化钡溶液,请你按照他的思路,用上述实验流程图表示出他后面的实验过程,要注明所用试剂和所得产物的化学式以及相应操作的名称。__________

请回答下列问题:
(1)操作I的名称为
(2)若用硝酸钡来代替氯化钡,是否可行?请说明理由。
(3)若实验所得固体甲、乙的质量分别为W1g和W2g,则样品中KBr的质量分数计算式为
(4)某同学对该实验方案提出质疑,他认为加适量氯化钡溶液不容易控制,应该加入过量氯化钡溶液,请你按照他的思路,用上述实验流程图表示出他后面的实验过程,要注明所用试剂和所得产物的化学式以及相应操作的名称。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】氯气是一种重要的化工原料,广泛应用于制备含氯化合物。现用如图装置(夹持装置省略)制备少量漂白粉。

已知:①多孔球泡能使经过的气体变成更多的小气泡,使气体与液体充分接触;
②在温度较高时,将氯气通入石灰乳中会发生反应:6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O。
(1)将氯气通入石灰乳中制备漂白粉的化学方程式为___________ 。
(2)装置②的作用是___________ 。
(3)装置③中用了多孔球泡,其目的是___________ 。由于装置③中发生的反应会放出热量,因此为防止副反应的发生,装置③应如何改进?___________ 。
(4)装置④中盛装的溶液为___________ (填试剂名称),目的是___________ 。
(5)若石灰乳(足量)中吸收了标准状况下2.24LCl2,充分反应后测得生成的CaCl2的质量为6.66g,最终得到的生成物中Ca(ClO)2的质量为___________ g。

已知:①多孔球泡能使经过的气体变成更多的小气泡,使气体与液体充分接触;
②在温度较高时,将氯气通入石灰乳中会发生反应:6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O。
(1)将氯气通入石灰乳中制备漂白粉的化学方程式为
(2)装置②的作用是
(3)装置③中用了多孔球泡,其目的是
(4)装置④中盛装的溶液为
(5)若石灰乳(足量)中吸收了标准状况下2.24LCl2,充分反应后测得生成的CaCl2的质量为6.66g,最终得到的生成物中Ca(ClO)2的质量为
您最近一年使用:0次
【推荐3】钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:

根据以上工艺流程图,回答下列问题:
(1)提高焙烧效率的方法有_____________ 。(写任意一种即可)
(2) “焙烧”时MoS2转化为MoO3,该反应的氧化产物是________ 。
(3) “碱浸”时生成CO2的电子式为________ ,“碱浸”时含钼化合物发生的主要反应的离子方程式为_________ 。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为____________ 。
(5)钼精矿在酸性条件下,加入NaNO3溶液,也可以制备钼酸钠,同时有SO 生成,该反应的离子方程式为
生成,该反应的离子方程式为________ 。
(6)测得“除重金属离子”中部分离子的浓度:c(MoO )=0.20 mol·L-1,c(SO
)=0.20 mol·L-1,c(SO )=0.01 mol·L-1。“结晶”前应先除去SO
)=0.01 mol·L-1。“结晶”前应先除去SO ,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,去除的SO
,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,去除的SO 的质量分数为
的质量分数为________ %。[已知Ksp(BaSO4)=1×10-10,Ksp(BaMoO4)=2.0×10-8]

根据以上工艺流程图,回答下列问题:
(1)提高焙烧效率的方法有
(2) “焙烧”时MoS2转化为MoO3,该反应的氧化产物是
(3) “碱浸”时生成CO2的电子式为
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为
(5)钼精矿在酸性条件下,加入NaNO3溶液,也可以制备钼酸钠,同时有SO
 生成,该反应的离子方程式为
生成,该反应的离子方程式为(6)测得“除重金属离子”中部分离子的浓度:c(MoO
 )=0.20 mol·L-1,c(SO
)=0.20 mol·L-1,c(SO )=0.01 mol·L-1。“结晶”前应先除去SO
)=0.01 mol·L-1。“结晶”前应先除去SO ,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,去除的SO
,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,去除的SO 的质量分数为
的质量分数为
您最近一年使用:0次



