常温下,分别向体积均为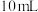 、浓度均为
、浓度均为 的
的 和
和 溶液中滴加
溶液中滴加 的
的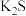 溶液,滴加过程中溶液
溶液,滴加过程中溶液 和
和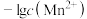 与滴入
与滴入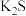 溶液体积(
溶液体积( )的关系如图所示。[已知:
)的关系如图所示。[已知: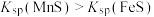 ,
, ,忽略溶液混合时温度和体积的变化],下列说法错误的是
,忽略溶液混合时温度和体积的变化],下列说法错误的是
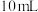 、浓度均为
、浓度均为 的
的 和
和 溶液中滴加
溶液中滴加 的
的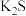 溶液,滴加过程中溶液
溶液,滴加过程中溶液 和
和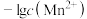 与滴入
与滴入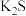 溶液体积(
溶液体积( )的关系如图所示。[已知:
)的关系如图所示。[已知: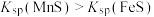 ,
, ,忽略溶液混合时温度和体积的变化],下列说法错误的是
,忽略溶液混合时温度和体积的变化],下列说法错误的是
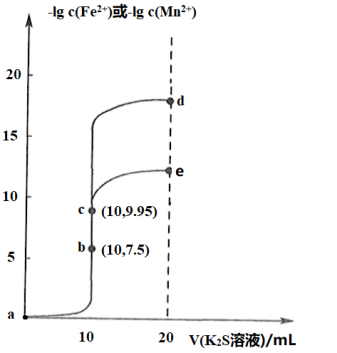
A.加入过量难溶 可除去 可除去 溶液中混有的 溶液中混有的 |
| B.e点纵坐标约为13.5 |
C.d点钾离子的物质的量浓度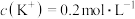 |
| D.溶液的pH:d>c>a |
更新时间:2021/03/20 09:11:21
|
相似题推荐
多选题
|
较难
(0.4)
名校
解题方法
【推荐1】室温下,以酚酞为指示剂,用0.10 mol·L−1 NaOH溶液滴定20.00 mL 0.10 mol·L−1二元酸H2A溶液。溶液pH随滴加NaOH溶液体积VNaOH的变化关系如下图所示。已知H2A的电离过程为:H2A=H++HA-,HA- H++A2-。
H++A2-。

下列叙述正确的是
 H++A2-。
H++A2-。
下列叙述正确的是
| A.室温下,0.10 mol·L−1H2A溶液pH<1 |
| B.滴定过程中,水的电离程度一直在增大 |
| C.VNaOH=20.00 mL时,溶液中c(H+)=c (OH-)+c (A2-) |
| D.滴定终点时,溶液中c (Na+)<c (HA-)+2c(A2-) |
您最近一年使用:0次
多选题
|
较难
(0.4)
【推荐2】25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
| A.pH=8的次NaClO2溶液中:c(Na+)>c(OH-) >c(ClO2-) >c(H+) |
| B.0.1mol/LNa2CO3溶液与0.1mol/LNaHCO3溶液等体积混合:c(CO32-)+c(OH-)=c(HCO3-)+3c(H2CO3)+c(H+) |
| C.0.4mol/LCH3COOH溶液和0.2mol/LNaOH溶液等体积混合(pH<7):c(CH3COO-)>c(Na+)>c(CH3COO—)>c(H+)> c(OH-) |
| D.0.1mol•L-1Na2C2O4溶液与0.1mol•L-1HCl溶液等体积混合(草酸为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
您最近一年使用:0次
【推荐1】某温度下,分别向10mL浓度均为0.1mol·L-1的CuCl2和ZnCl2溶液中滴加0.1mol·L-1的Na2S溶液,滴加过程中溶液中-lgc(Cu2+)和-lgc(Zn2+)与Na2S溶液体积(V)的关系如图所示。[已知:Ksp(ZnS)>Ksp(CuS), 1g3≈0.5],下列说法正确的是
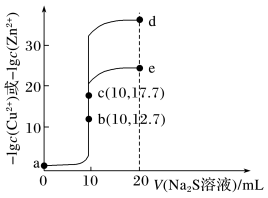

| A.a点的ZnCl2溶液中:c(Cl-)<2[c(Zn2+)+c(H+)] |
| B.由图象可以计算得出该温度下Ksp(ZnS)=10-35.4 |
| C.a—b—e为滴定CuCl2溶液的曲线 |
| D.d点纵坐标约为33.9 |
您最近一年使用:0次
多选题
|
较难
(0.4)
【推荐2】下列图示与对应的叙述符合的是
A.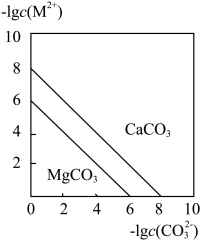 表示一定温度下,两种碳酸盐MCO3的沉淀溶解平衡曲线,则Ksp(MgCO3)>Ksp(CaCO3) 表示一定温度下,两种碳酸盐MCO3的沉淀溶解平衡曲线,则Ksp(MgCO3)>Ksp(CaCO3) |
B.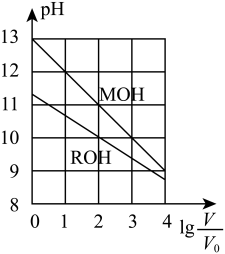 表示浓度均为0.10 mol·L−1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg( 表示浓度均为0.10 mol·L−1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg(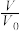 )的变化,MOH的碱性弱于ROH的碱性 )的变化,MOH的碱性弱于ROH的碱性 |
C.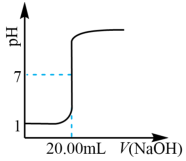 表示室温下,用0.100 0 mol·L−1NaOH溶液滴定25.00 mL盐酸的滴定曲线 表示室温下,用0.100 0 mol·L−1NaOH溶液滴定25.00 mL盐酸的滴定曲线 |
D.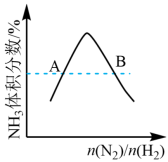 表示反应N2(g)+3H2(g) 表示反应N2(g)+3H2(g) 2NH3(g)达平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)<αB(H2) 2NH3(g)达平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)<αB(H2) |
您最近一年使用:0次
多选题
|
较难
(0.4)
【推荐1】常温下,将 CuS 固体浸入一定浓度的 NaCN 溶液中,固体部分溶解。发生如下反应:2CuS+10CN− =2[Cu(CN)4]3−+2S2−+(CN)2↑。已知:25℃Ka(HCN)=6.2×10−10。下列说法正确的是
| A.1 个HCN 分子中σ键的数目为 2 |
| B.NaCN 溶液中一定存在:c(Na+)>c(CN-)>c(HCN) |
| C.反应后的上层清液中存在:c(S2-)·c(Cu2+)<Ksp(CuS) |
| D.取反应后的上层清液,加水稀释,溶液中c(S2-)/c(HS-)的值变小 |
您最近一年使用:0次
【推荐2】地壳中各种物质存在各种转化,如金属铜的硫化物经生物氧化会转化为 ,流经
,流经 或
或 等含硫矿石又可以转化为
等含硫矿石又可以转化为 ,[已知
,[已知 ,
, ]。下列说法不正确的是
]。下列说法不正确的是
 ,流经
,流经 或
或 等含硫矿石又可以转化为
等含硫矿石又可以转化为 ,[已知
,[已知 ,
, ]。下列说法不正确的是
]。下列说法不正确的是
A.工业上可用 处理含有 处理含有 、 、 等金属硫化物的废水 等金属硫化物的废水 |
B.当溶液中有 和 和 共存时,溶液中 共存时,溶液中 |
C.基态 的价电子排布式为 的价电子排布式为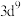 |
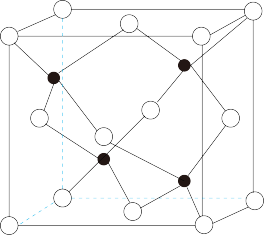
D. 的晶胞结构如图所示,晶胞中与S紧邻的Fe为4个 的晶胞结构如图所示,晶胞中与S紧邻的Fe为4个 |
您最近一年使用:0次

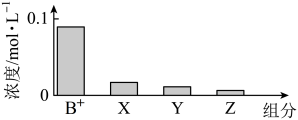
 计测定浓度均为
计测定浓度均为 的
的 溶液和
溶液和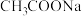 溶液的
溶液的 和
和 的酸性强弱
的酸性强弱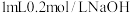 溶液的试管中滴加2滴
溶液的试管中滴加2滴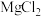 溶液,产生白色沉淀后,再滴加2滴
溶液,产生白色沉淀后,再滴加2滴 溶液,又产生红褐色沉淀
溶液,又产生红褐色沉淀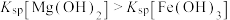
 粉加入
粉加入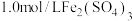 溶液中
溶液中 的金属性强弱
的金属性强弱 溶液,再分别加入相同体积、不同浓度的稀硫酸
溶液,再分别加入相同体积、不同浓度的稀硫酸 的
的 ,
, ,溶液中平衡时相关离子浓度的关系如图所示。下列说法错误的是
,溶液中平衡时相关离子浓度的关系如图所示。下列说法错误的是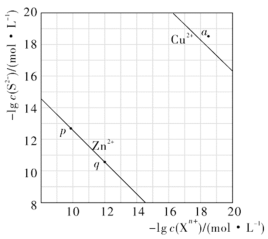
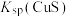 的数量级为
的数量级为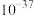
 固体,溶液组成由p向q方向移动
固体,溶液组成由p向q方向移动 平衡常数很大,反应趋于完全
平衡常数很大,反应趋于完全

