NO和NO2是常见的氮氧化物,研究它们的综合利用有重要意义。
(1)K. F. Greene的研究发现:硝酸与金属反应时,最容易生成亚硝酸(HNO2,弱酸),然后才转化成NO2,如果溶液中存在更强的氧化剂,如过氧化氢,它完全有能力将新产生的亚硝酸再氧化成硝酸。研究发现金属在不同浓度的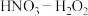 混合溶液中的溶解速率和生成NOx的体积V如图所示,请回答下列问题:
混合溶液中的溶解速率和生成NOx的体积V如图所示,请回答下列问题:

①最佳溶解金属的混合溶液中HNO3的质量分数为_______ ,理由是_______ 。
②过氧化氢与亚硝酸反应的化学方程式为_______ 。
③酸性高锰酸钾溶液是一种强氧化剂,它也可将亚硝酸氧化,因而也可消除氮氧化物。写出该反应的离子方程式:_______ 。
(2)氧化-还原法消除氮氧化物的转化如下:

①反应I为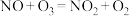 ,生成11.2 L(标准状况)O2时,转移电子的物质的量是
,生成11.2 L(标准状况)O2时,转移电子的物质的量是_______ mol。
②反应II中,当 时,反应的化学方程式为
时,反应的化学方程式为_______ 。
(3)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应如下:
① ;②
;② 。反应①中SO2
。反应①中SO2_______ (填“作还原剂”、“作氧化剂”或“既不作还原剂,也不作氧化剂”)。
(1)K. F. Greene的研究发现:硝酸与金属反应时,最容易生成亚硝酸(HNO2,弱酸),然后才转化成NO2,如果溶液中存在更强的氧化剂,如过氧化氢,它完全有能力将新产生的亚硝酸再氧化成硝酸。研究发现金属在不同浓度的
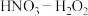 混合溶液中的溶解速率和生成NOx的体积V如图所示,请回答下列问题:
混合溶液中的溶解速率和生成NOx的体积V如图所示,请回答下列问题:
①最佳溶解金属的混合溶液中HNO3的质量分数为
②过氧化氢与亚硝酸反应的化学方程式为
③酸性高锰酸钾溶液是一种强氧化剂,它也可将亚硝酸氧化,因而也可消除氮氧化物。写出该反应的离子方程式:
(2)氧化-还原法消除氮氧化物的转化如下:

①反应I为
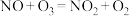 ,生成11.2 L(标准状况)O2时,转移电子的物质的量是
,生成11.2 L(标准状况)O2时,转移电子的物质的量是②反应II中,当
 时,反应的化学方程式为
时,反应的化学方程式为(3)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应如下:
①
 ;②
;② 。反应①中SO2
。反应①中SO2
更新时间:2021-03-27 14:31:41
|
相似题推荐
【推荐1】(1)配平下列方程式,用双线桥法表示出电子转移的数目。 Fe2O3 + KNO3 + KOH = K2FeO4 + KNO2 + H2O ,____________ ,氧化剂 ________ ,氧化产物 __________
(2)用单线桥法表示下列氧化还原反应的关系, 并标出电子转移的数目。用MnO2氧化密度为1.19 g/cm3,溶质质量分数为36.5%的HCl溶液,反应得到澄清溶液。反应的化学方程式为: MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
①该反应的离子方程式为:_____________________________________________ ,该盐酸的物质的量浓度为___________ mol/L。
②氧化剂与还原剂物质的量之比为_______________
③8.7gMnO2与足量浓盐酸反应能使________ molHCl被氧化;其中,还原过程为:________→_______,__________ 。
④如果该反应转移1mol电子,则生成标准状况下的气体体积为___________ L。
(2)用单线桥法表示下列氧化还原反应的关系, 并标出电子转移的数目。用MnO2氧化密度为1.19 g/cm3,溶质质量分数为36.5%的HCl溶液,反应得到澄清溶液。反应的化学方程式为: MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O①该反应的离子方程式为:
②氧化剂与还原剂物质的量之比为
③8.7gMnO2与足量浓盐酸反应能使
④如果该反应转移1mol电子,则生成标准状况下的气体体积为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子的电子式为__________ ,其中氮的化合价为______ 。
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的离子方程式____________ 。
(3)联氨和N2O4可作为火箭推进剂,其反应的产物均无污染。其氧化产物和还原产物之比为_______ 。
(4)联氨为二元弱碱,在水中的电离方程式与氨相似。联氨与硫酸形成的酸式盐的化学式为______________ 。
(1)联氨分子的电子式为
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的离子方程式
(3)联氨和N2O4可作为火箭推进剂,其反应的产物均无污染。其氧化产物和还原产物之比为
(4)联氨为二元弱碱,在水中的电离方程式与氨相似。联氨与硫酸形成的酸式盐的化学式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】过氧化氢H2O2,(氧的化合价为-1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2+H2O
C.2H2O2=2H2O+O2
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是(填代号)_________________ 。
(2)H2O2既体现氧化性又体现还原性的反应是(填代号)_____________ 。
(3)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO +5e-+8H+===Mn2++4H2O
+5e-+8H+===Mn2++4H2O
写出该氧化还原反应的化学方程式:_______________________ 。
(4)请配平以下化学方程式:
 Al+
Al+ NaNO3+
NaNO3+ NaOH===
NaOH=== NaAlO2+
NaAlO2+ N2↑+
N2↑+ H2O
H2O
____________________
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2+H2O
C.2H2O2=2H2O+O2
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是(填代号)
(2)H2O2既体现氧化性又体现还原性的反应是(填代号)
(3)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO
 +5e-+8H+===Mn2++4H2O
+5e-+8H+===Mn2++4H2O写出该氧化还原反应的化学方程式:
(4)请配平以下化学方程式:
 Al+
Al+ NaNO3+
NaNO3+ NaOH===
NaOH=== NaAlO2+
NaAlO2+ N2↑+
N2↑+ H2O
H2O
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】回答下列问题:
(1)已知活泼金属可以与水反应,如 ↑,而单质硅(
↑,而单质硅( )通常不与水反应,但单质硅能够溶解在
)通常不与水反应,但单质硅能够溶解在 溶液中并产生H2。请写出该反应可能的化学方程式
溶液中并产生H2。请写出该反应可能的化学方程式___________ 。
(2)已知 在常温无氧条件下可以分解产生
在常温无氧条件下可以分解产生 和一种气体单质,请写出可能的化学方程式
和一种气体单质,请写出可能的化学方程式___________ 。
(3)CuCl2溶液呈绿色的原因可认为是CuCl2溶解后生成了个数比 的两种离子,其中一种是蓝色的
的两种离子,其中一种是蓝色的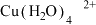 ,另一种离子显黄色,请写出该离子可能的化学式
,另一种离子显黄色,请写出该离子可能的化学式___________ 。
(4)尿素 是一种常见的氮肥,在较高温度下可以与水反应生成两种常见的气体,请写出可能的化学方程式
是一种常见的氮肥,在较高温度下可以与水反应生成两种常见的气体,请写出可能的化学方程式___________ 。
(1)已知活泼金属可以与水反应,如
 ↑,而单质硅(
↑,而单质硅( )通常不与水反应,但单质硅能够溶解在
)通常不与水反应,但单质硅能够溶解在 溶液中并产生H2。请写出该反应可能的化学方程式
溶液中并产生H2。请写出该反应可能的化学方程式(2)已知
 在常温无氧条件下可以分解产生
在常温无氧条件下可以分解产生 和一种气体单质,请写出可能的化学方程式
和一种气体单质,请写出可能的化学方程式(3)CuCl2溶液呈绿色的原因可认为是CuCl2溶解后生成了个数比
 的两种离子,其中一种是蓝色的
的两种离子,其中一种是蓝色的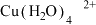 ,另一种离子显黄色,请写出该离子可能的化学式
,另一种离子显黄色,请写出该离子可能的化学式(4)尿素
 是一种常见的氮肥,在较高温度下可以与水反应生成两种常见的气体,请写出可能的化学方程式
是一种常见的氮肥,在较高温度下可以与水反应生成两种常见的气体,请写出可能的化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】一般用K2Cr2O7滴定分析法测定还原铁粉纯度。实验步骤:称取一定量样品,用过量稀硫酸溶解,用标准K2Cr2O7溶液滴定其中的Fe2+。反应式:  +6Fe2++14H+=2Cr3++6Fe3++7H2O某次实验称取0.2800g样品,滴定时消耗浓度为0.03000mol·L-1的K2Cr2O7溶液25.10mL,则样品中铁含量为
+6Fe2++14H+=2Cr3++6Fe3++7H2O某次实验称取0.2800g样品,滴定时消耗浓度为0.03000mol·L-1的K2Cr2O7溶液25.10mL,则样品中铁含量为_______ %。
 +6Fe2++14H+=2Cr3++6Fe3++7H2O某次实验称取0.2800g样品,滴定时消耗浓度为0.03000mol·L-1的K2Cr2O7溶液25.10mL,则样品中铁含量为
+6Fe2++14H+=2Cr3++6Fe3++7H2O某次实验称取0.2800g样品,滴定时消耗浓度为0.03000mol·L-1的K2Cr2O7溶液25.10mL,则样品中铁含量为
您最近一年使用:0次
【推荐3】按要求填空。
(1)配平下面氧化还原离子方程式:_______ 。
______Cu+___H++___ =____Cu2+____NO↑+____
=____Cu2+____NO↑+____
(2)已知KMnO4与浓盐酸室温下可发生如下反应: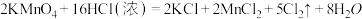
①用“双线桥法”标出上述反应的电子转移情况_______ ;
②此反应体现HCl的_______ 性和_______ 性;
③该反应中,被氧化的氯原子个数与未被氧化的氯原子个数比为_______ 。
④已知:KMnO4溶液酸化采用硫酸而不用盐酸,能结合上述化学方程式,用文字解释酸化KMnO4为什么不用盐酸?_______ 。
(1)配平下面氧化还原离子方程式:
______Cu+___H++___
 =____Cu2+____NO↑+____
=____Cu2+____NO↑+____
(2)已知KMnO4与浓盐酸室温下可发生如下反应:
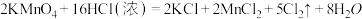
①用“双线桥法”标出上述反应的电子转移情况
②此反应体现HCl的
③该反应中,被氧化的氯原子个数与未被氧化的氯原子个数比为
④已知:KMnO4溶液酸化采用硫酸而不用盐酸,能结合上述化学方程式,用文字解释酸化KMnO4为什么不用盐酸?
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】Cl2是一种重要的化工原料,结合氯气的相关知识解决下列问题。
(1)工业上将氯气通入消石灰中制取漂白粉,写出该反应的化学方程式__________ 。
(2)漂白粉的有效成分是(填化学式)_________ 。
(3)氯水与二氧化硫均具有漂白性,若将两者按适当比例混合则漂白性很差,用离子方程式表示其原因____ 。
(4)实验室可以用KMnO4与浓盐酸在常温下制备Cl2。高锰酸钾溶液常用于物质的定性检验与定量分析。某化学兴趣小组在实验室里用0.1mol/LKMnO4溶液与300ml0.2mol/L的KI溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的体积为________ ml。(已知MnO4-在此条件下被还原为Mn2+)
(1)工业上将氯气通入消石灰中制取漂白粉,写出该反应的化学方程式
(2)漂白粉的有效成分是(填化学式)
(3)氯水与二氧化硫均具有漂白性,若将两者按适当比例混合则漂白性很差,用离子方程式表示其原因
(4)实验室可以用KMnO4与浓盐酸在常温下制备Cl2。高锰酸钾溶液常用于物质的定性检验与定量分析。某化学兴趣小组在实验室里用0.1mol/LKMnO4溶液与300ml0.2mol/L的KI溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的体积为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】化学工作者一直在积极探索影响大气质量的因素及改善措施。
(1)硫酸盐是大气中可吸入颗粒物的主要成分之一,是在含水的气溶胶液滴中通过化学反应产生的。
①气溶胶属于胶体分散系。当日光射入充满气溶胶的暗室时,可观察到_______ 效应。
②大气中的SO2 转化为硫酸盐的过程中,以下物质能起氧化作用的是_____ (填字母序号)。
a.O2 b.H2S c.NH3 d.O3
③有研究者发现特定条件下,大气中的NOx会成为氧化SO2 的主要物质,于是认为,当城市大气中的可吸入颗粒物严重超标时,应采取汽车限行措施。原因是_________ 。
(2)燃煤烟气中含有NOx和SO2。工业上常用亚氯酸钠(NaClO2)对燃煤烟气进行脱硝和脱硫处理。
已知: 酸性条件下,ClO2-会转化成ClO2和Cl-。ClO2是黄绿色、易溶于水的气体,具有强氧化性,可氧化NOx或SO2。
I.在实验室模拟脱硝过程:调节NaClO2 吸收液的pH 为5,向其中通入含NO 的模拟烟气。
①测得脱硝反应后,溶液中的阴离子为NO3-和Cl-,则脱硝反应的离子方程式为_______ 。
②测得脱硝效率(即NO 的吸收率)随温度变化的曲线如下图所示。结合已知信息分析,温度大于50℃时,随温度升高脱硝效率下降的原因是____________ 。

Ⅱ.在实验室模拟同时脱硝、脱硫过程: 调节NaClO2吸收液的pH为5,向其中通入含SO2 和 NO (体积比2 :1)的模拟烟气。
③测得脱硝、脱硫反应后,溶液中的阴离子为NO3-、SO42- 和Cl-,其中c(SO42-)= a mol/L,c(Cl-)=bmol/L,已知脱硫效率为100%,计算脱硝效率为_________ 。
(1)硫酸盐是大气中可吸入颗粒物的主要成分之一,是在含水的气溶胶液滴中通过化学反应产生的。
①气溶胶属于胶体分散系。当日光射入充满气溶胶的暗室时,可观察到
②大气中的SO2 转化为硫酸盐的过程中,以下物质能起氧化作用的是
a.O2 b.H2S c.NH3 d.O3
③有研究者发现特定条件下,大气中的NOx会成为氧化SO2 的主要物质,于是认为,当城市大气中的可吸入颗粒物严重超标时,应采取汽车限行措施。原因是
(2)燃煤烟气中含有NOx和SO2。工业上常用亚氯酸钠(NaClO2)对燃煤烟气进行脱硝和脱硫处理。
已知: 酸性条件下,ClO2-会转化成ClO2和Cl-。ClO2是黄绿色、易溶于水的气体,具有强氧化性,可氧化NOx或SO2。
I.在实验室模拟脱硝过程:调节NaClO2 吸收液的pH 为5,向其中通入含NO 的模拟烟气。
①测得脱硝反应后,溶液中的阴离子为NO3-和Cl-,则脱硝反应的离子方程式为
②测得脱硝效率(即NO 的吸收率)随温度变化的曲线如下图所示。结合已知信息分析,温度大于50℃时,随温度升高脱硝效率下降的原因是

Ⅱ.在实验室模拟同时脱硝、脱硫过程: 调节NaClO2吸收液的pH为5,向其中通入含SO2 和 NO (体积比2 :1)的模拟烟气。
③测得脱硝、脱硫反应后,溶液中的阴离子为NO3-、SO42- 和Cl-,其中c(SO42-)= a mol/L,c(Cl-)=bmol/L,已知脱硫效率为100%,计算脱硝效率为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】铁及其化合物在生产、生活中有及其重要的用途,请回答下列问题:
(1)FeCl3溶液呈黄色,FeCl3溶液的分散质是_________ ,分散剂是___________ 。
(2)Fe(OH)3是难溶于水的固体,那么分离Fe(OH)3与水的悬浊液常用的方法是_______
(3)Fe(OH)3胶体呈红褐色,具有良好的净水效果.由饱和FeCl3溶液制备Fe(OH)3胶体的方法是______________________ 。离子方程式是___________________________ 。
(4)鉴别FeCl3溶液和Fe(OH)3胶体,除了可通过观察颜色以外,还有的方法是__________ 。
(5)下列关于Fe(OH)3胶体和Fe(OH)3悬浊液的描述,正确的是_________
A.两者颜色相同 B.两者稳定性相同
C.两者的分子直径均大于100nm D.滴加稀盐酸后,两者现象完全相同
(6)高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,主要用于饮用水处理,工业制备高铁酸钠有多种方法,其中一种方法的原理可用离子方程式表示为
3ClO—+2Fe3++10OH—= 2 +3Cl—+5H2O,则Na2FeO4中铁元素的化合价为
+3Cl—+5H2O,则Na2FeO4中铁元素的化合价为_______ ,该离子反应中氧化剂与还原剂的个数比为_____ ,生成1个高铁酸钠转移____ 个电子
(1)FeCl3溶液呈黄色,FeCl3溶液的分散质是
(2)Fe(OH)3是难溶于水的固体,那么分离Fe(OH)3与水的悬浊液常用的方法是
(3)Fe(OH)3胶体呈红褐色,具有良好的净水效果.由饱和FeCl3溶液制备Fe(OH)3胶体的方法是
(4)鉴别FeCl3溶液和Fe(OH)3胶体,除了可通过观察颜色以外,还有的方法是
(5)下列关于Fe(OH)3胶体和Fe(OH)3悬浊液的描述,正确的是
A.两者颜色相同 B.两者稳定性相同
C.两者的分子直径均大于100nm D.滴加稀盐酸后,两者现象完全相同
(6)高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,主要用于饮用水处理,工业制备高铁酸钠有多种方法,其中一种方法的原理可用离子方程式表示为
3ClO—+2Fe3++10OH—= 2
 +3Cl—+5H2O,则Na2FeO4中铁元素的化合价为
+3Cl—+5H2O,则Na2FeO4中铁元素的化合价为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】亚硝酸钠是一种具有咸味、有毒的工业用盐,工业上常用作防腐剂。
(1)NaNO2中N的化合价为_______ ,由N的化合价推测NaNO2具有_______ (填“氧化性”、“还原性”或“氧化性、还原性”)。
(2)NaNO2易溶于水,水溶液显碱性。写出HNO2的电离方程式_______ 。
(3)酸性条件下, 能与
能与 反应得到
反应得到 ,写出此反应的离子方程式
,写出此反应的离子方程式_______ 。
(4)NaNO2与HI反应:2NaNO2+4HI =2NO↑+I2+2NaI+2H2O,若有0.5 mol氧化剂被还原,则被氧化的还原剂的物质的量是_______ mol。
(5)工业废水中含有亚硝酸盐,以氯化铵处理亚硝酸盐的新工艺已在工业上广泛使用。该反应的生成物不会给环境带来任何污染,写出反应的离子方程式_______ ,理论上53.5 kg NH4Cl可除去废水中的
_______ mol。
(1)NaNO2中N的化合价为
(2)NaNO2易溶于水,水溶液显碱性。写出HNO2的电离方程式
(3)酸性条件下,
 能与
能与 反应得到
反应得到 ,写出此反应的离子方程式
,写出此反应的离子方程式(4)NaNO2与HI反应:2NaNO2+4HI =2NO↑+I2+2NaI+2H2O,若有0.5 mol氧化剂被还原,则被氧化的还原剂的物质的量是
(5)工业废水中含有亚硝酸盐,以氯化铵处理亚硝酸盐的新工艺已在工业上广泛使用。该反应的生成物不会给环境带来任何污染,写出反应的离子方程式

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】化学与生产、生活及科研密切相关,随着生产力的发展,科学技术的进步,化学与人们生活也越来越密切。化学在人类的生产和生活中发挥了不可估量的作用,生活中随处可见化学知识。
(1)科学家经过研究发现中国霾呈中性,其主要原因如图所示:

A中含有___________ 元素,带有___________ 电荷(填“正”或“负”)。
(2)据文献报道,难溶于水的 粉尘可在
粉尘可在 溶液中“溶解”,“溶解”后硫元素都以
溶液中“溶解”,“溶解”后硫元素都以 的形式存在。若要检验“溶解”后溶液中
的形式存在。若要检验“溶解”后溶液中 ,简要写出相关的实验操作
,简要写出相关的实验操作___________ 。
(3)硫循环在自然界和人类生活生产中均起到重要作用。如图是自然界中硫的循环图,下列关于这两种循环的说法正确的是___________。

(4)图中所示氮循环中,不属于氮的固定的有___________。

(5)工业废气中的氮氧化物(如 等,用通式
等,用通式 表示)是主要的大气污染物之一,为了保护环境,工业上常通入氨气与之发生如下反应:
表示)是主要的大气污染物之一,为了保护环境,工业上常通入氨气与之发生如下反应: 来消除污染。有关此反应下列说法中错误的是______
来消除污染。有关此反应下列说法中错误的是______
(1)科学家经过研究发现中国霾呈中性,其主要原因如图所示:

A中含有
(2)据文献报道,难溶于水的
 粉尘可在
粉尘可在 溶液中“溶解”,“溶解”后硫元素都以
溶液中“溶解”,“溶解”后硫元素都以 的形式存在。若要检验“溶解”后溶液中
的形式存在。若要检验“溶解”后溶液中 ,简要写出相关的实验操作
,简要写出相关的实验操作(3)硫循环在自然界和人类生活生产中均起到重要作用。如图是自然界中硫的循环图,下列关于这两种循环的说法正确的是___________。

| A.火山喷口附近容易见到单质硫 |
| B.硫循环过程无生物圈参与 |
| C.人类对化石燃料的过度开采对硫循环造成巨大影响 |
| D.硫循环对环境的影响是导致酸雨的产生 |
(4)图中所示氮循环中,不属于氮的固定的有___________。

A. 转化为氨态氮 转化为氨态氮 | B.硝化过程 |
| C.反硝化过程 | D. 转化为硝态氮 转化为硝态氮 |
(5)工业废气中的氮氧化物(如
 等,用通式
等,用通式 表示)是主要的大气污染物之一,为了保护环境,工业上常通入氨气与之发生如下反应:
表示)是主要的大气污染物之一,为了保护环境,工业上常通入氨气与之发生如下反应: 来消除污染。有关此反应下列说法中错误的是______
来消除污染。有关此反应下列说法中错误的是______A. 既是氧化产物又是还原产物 既是氧化产物又是还原产物 |
B.当 时,每生成 时,每生成 ,被氧化的气体有 ,被氧化的气体有 |
C.当 时,有 时,有 气体被还原,转移电子 气体被还原,转移电子 |
D.反应通式配平表示为: |
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
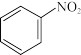
【推荐3】硝基苯(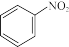 )是一种化学稳定性好、毒性高、难以生物降解的污染物。用化学方法降解水中硝基苯已成为污水处理领域的重要研究方向。
)是一种化学稳定性好、毒性高、难以生物降解的污染物。用化学方法降解水中硝基苯已成为污水处理领域的重要研究方向。
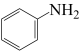
(1)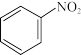 与Fe、盐酸反应生成可生物降解的苯胺(
与Fe、盐酸反应生成可生物降解的苯胺(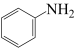 )、
)、 和
和 。
。
①理论上,1mol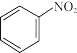 转化为
转化为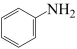 转移的电子的物质的量为
转移的电子的物质的量为_______ 。
②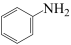 在水中的溶解度大于
在水中的溶解度大于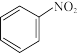 的原的原因是
的原的原因是_______ 。
(2)在酸性条件下,铁炭混合物处理污水中硝基苯时,硝基苯转化过程如下:

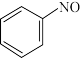

①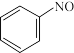 转化为
转化为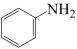 的电极反应式:
的电极反应式:_______ 。
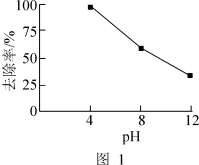
②在其他条件一定,反应相同时间,硝基苯的去除率与pH的关系如图1所示。pH越大,硝基苯的去除率越低的原因是_______ 。
(3)向含 和苯胺(
和苯胺(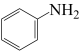 )的酸性溶液中加入双氧水,发生如下反应:
)的酸性溶液中加入双氧水,发生如下反应:
①HO·具有强氧化性,能将溶液中的苯胺氧化成 和
和 。该反应的离子方程式为
。该反应的离子方程式为_______ 。
② 也具有氧化性,设计验证苯胺是被HO·氧化而不是被
也具有氧化性,设计验证苯胺是被HO·氧化而不是被 氧化的实验方案:
氧化的实验方案:_______ 。
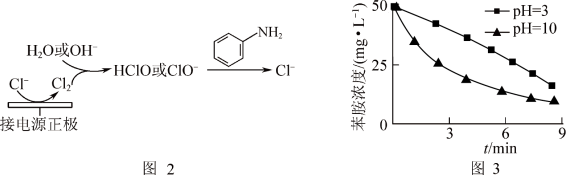
(4)利用电解原理也可以间接氧化处理含苯胺的污水,其原理如图2所示。其他条件一定,测得不同初始pH条件下,溶液中苯胺的浓度与时间的关系如图3所示。反应相同时间,初始溶液pH=3时苯胺浓度大于pH=10时的原因是_______ 。(已知: 随着pH减小,氧化性增强)
随着pH减小,氧化性增强)
 )是一种化学稳定性好、毒性高、难以生物降解的污染物。用化学方法降解水中硝基苯已成为污水处理领域的重要研究方向。
)是一种化学稳定性好、毒性高、难以生物降解的污染物。用化学方法降解水中硝基苯已成为污水处理领域的重要研究方向。(1)
 与Fe、盐酸反应生成可生物降解的苯胺(
与Fe、盐酸反应生成可生物降解的苯胺( )、
)、 和
和 。
。①理论上,1mol
 转化为
转化为 转移的电子的物质的量为
转移的电子的物质的量为②
 在水中的溶解度大于
在水中的溶解度大于 的原的原因是
的原的原因是(2)在酸性条件下,铁炭混合物处理污水中硝基苯时,硝基苯转化过程如下:





①
 转化为
转化为 的电极反应式:
的电极反应式:②在其他条件一定,反应相同时间,硝基苯的去除率与pH的关系如图1所示。pH越大,硝基苯的去除率越低的原因是

(3)向含
 和苯胺(
和苯胺( )的酸性溶液中加入双氧水,发生如下反应:
)的酸性溶液中加入双氧水,发生如下反应: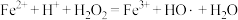
①HO·具有强氧化性,能将溶液中的苯胺氧化成
 和
和 。该反应的离子方程式为
。该反应的离子方程式为②
 也具有氧化性,设计验证苯胺是被HO·氧化而不是被
也具有氧化性,设计验证苯胺是被HO·氧化而不是被 氧化的实验方案:
氧化的实验方案:(4)利用电解原理也可以间接氧化处理含苯胺的污水,其原理如图2所示。其他条件一定,测得不同初始pH条件下,溶液中苯胺的浓度与时间的关系如图3所示。反应相同时间,初始溶液pH=3时苯胺浓度大于pH=10时的原因是
 随着pH减小,氧化性增强)
随着pH减小,氧化性增强)
您最近一年使用:0次



