微量元素硼(B)对人体健康有着十分重要的作用,其化合物也应用广泛。请回答下列问题:
(1)B的核外电子排布式为___ ,其第一电离能比Be___ (填“大”或“小”)。
(2)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。NH3BH3分子中,N—B键是配位键,其空轨道由___ 提供(填元素符号)。写出一种与氨硼烷互为等电子体的分子___ (填分子式)。
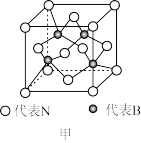
(3)硼酸晶体是片层结构,图甲中表示的是其中一层的结构,每一层内存在的作用力有___ 。
(4)①乙硼烷(B2H6)具有强还原性,它和氢化锂反应生成硼氢化锂(LiBH4),硼氢化锂常用于有机合成。LiBH4由Li+和BH 构成,BH
构成,BH 中B原子的杂化轨道类型为
中B原子的杂化轨道类型为___ ,BH 的空间构型为
的空间构型为___ 。
②B的三卤化物熔点如表所示,自BF3至BI3熔点依次升高的原因是___ 。
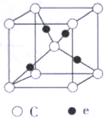
(5)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图乙所示。立方氮化硼属于___ 晶体,其中氮原子的配位数为___ 。已知:立方氮化硼密度为ρg·cm-3,B原子半径为anm,N原子半径为bnm,阿伏加德罗常数的值为NA,则该晶胞中原子的空间利用率为___ (用含字母的代数式表示)。
(1)B的核外电子排布式为
(2)氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。NH3BH3分子中,N—B键是配位键,其空轨道由
(3)硼酸晶体是片层结构,图甲中表示的是其中一层的结构,每一层内存在的作用力有


(4)①乙硼烷(B2H6)具有强还原性,它和氢化锂反应生成硼氢化锂(LiBH4),硼氢化锂常用于有机合成。LiBH4由Li+和BH
 构成,BH
构成,BH 中B原子的杂化轨道类型为
中B原子的杂化轨道类型为 的空间构型为
的空间构型为②B的三卤化物熔点如表所示,自BF3至BI3熔点依次升高的原因是
| 化合物 | BF3 | BCl3 | BBr3 | BI3 |
| 熔点/℃ | -126.8 | -107.3 | -46 | 44.9 |
(5)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图乙所示。立方氮化硼属于
更新时间:2021-04-14 13:10:10
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】近日,科学家利用铁配合物催化氮气选择性转化成肼。如图所示(Et为乙基)。

回答下列问题:
(1)基态Fe原子最外层电子排布式为_______ 。基态N原子有_______ 种空间运动状态不同的电子。
(2)Fe(depe)(N2)所含元素中,电负性最大的元素是_______ 。P原子的杂化类型是_______ 。Fe(depe)(N2)中σ键数目和π键数目之比为_______ 。
(3)N2H4和H2S的相对分子质量相同,但是常温常压下,N2H4呈液态,而H2S呈气态,其主要原因是_______ 。
(4)NH3的VSEPR模型为_______ 。1molN2H4最多能与_______ molH+反应。
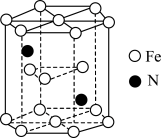
(5)铁和氮形成一种晶胞如图所示。已知:NA为阿伏加德罗常数的值,六棱柱底边的边长为apm,高为bpm,该晶体中Fe、N原子个数最简比为_______ 。该晶体的密度为_______ g·cm-3(只列计算式)。

回答下列问题:
(1)基态Fe原子最外层电子排布式为
(2)Fe(depe)(N2)所含元素中,电负性最大的元素是
(3)N2H4和H2S的相对分子质量相同,但是常温常压下,N2H4呈液态,而H2S呈气态,其主要原因是
(4)NH3的VSEPR模型为
(5)铁和氮形成一种晶胞如图所示。已知:NA为阿伏加德罗常数的值,六棱柱底边的边长为apm,高为bpm,该晶体中Fe、N原子个数最简比为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】A、B、C、D、E、F为前四周期的元素。其中,A元素和B元素的原子都有一个未成对电子,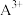 比
比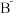 少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为红色固体,可通过“湿法治金”而得。请回答下列问题:
少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为红色固体,可通过“湿法治金”而得。请回答下列问题:
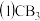 分子中心原子的杂化类型是
分子中心原子的杂化类型是 ______ 。
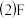 元素的原子的外围电子排布式为
元素的原子的外围电子排布式为 ______ ;如图所示为F与Au以3:1形成的合金晶胞图,在图中的括号内对应的元素符号a: _____ 、b:_____ 。

 、D元素最高价氧化物对应的水化物的酸性强弱:
、D元素最高价氧化物对应的水化物的酸性强弱: ______ 
______  填化学式
填化学式 。
。
 用导线将A和F的单质做成的电极连接起来,插入到盛有C的最高价氧化物的水化物的浓溶液中构成原电池,试写出在单质A表面发生反应的电极反应式:
用导线将A和F的单质做成的电极连接起来,插入到盛有C的最高价氧化物的水化物的浓溶液中构成原电池,试写出在单质A表面发生反应的电极反应式: ______ 。
 分子R是由C元素与氢元素形成的18电子分子,R的电子式为
分子R是由C元素与氢元素形成的18电子分子,R的电子式为 ______ 。
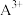 比
比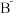 少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为红色固体,可通过“湿法治金”而得。请回答下列问题:
少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为红色固体,可通过“湿法治金”而得。请回答下列问题: 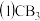 分子中心原子的杂化类型是
分子中心原子的杂化类型是 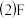 元素的原子的外围电子排布式为
元素的原子的外围电子排布式为 
 、D元素最高价氧化物对应的水化物的酸性强弱:
、D元素最高价氧化物对应的水化物的酸性强弱: 
 填化学式
填化学式 。
。 用导线将A和F的单质做成的电极连接起来,插入到盛有C的最高价氧化物的水化物的浓溶液中构成原电池,试写出在单质A表面发生反应的电极反应式:
用导线将A和F的单质做成的电极连接起来,插入到盛有C的最高价氧化物的水化物的浓溶液中构成原电池,试写出在单质A表面发生反应的电极反应式:  分子R是由C元素与氢元素形成的18电子分子,R的电子式为
分子R是由C元素与氢元素形成的18电子分子,R的电子式为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】《物质结构与性质》
(1)下列粒子的立体构型不是平面三角形的是___________ 。
A.CO32- B.NH3 C.BF3 D.SO3
(2)下列分子中,属于含极性键的非极性分子的是___________ 。
A.CH4 B.H2S C.C60 D.HCl
(3)现有四种离子晶体的晶胞,其离子排列方式如下列图所示,其中化学式不属于Mn型的是______ 。

(4)联合制碱法又称侯氏制碱法,其原理为:第一步NaCl+ NH3 + CO2+H2O=NaHCO3 + NH4Cl,第二步加热NaHCO3使其分解。关于第一步反应所包含的各物质中:
①属于离子化合物的是_________________ (填化学式);
②中心原子是sp杂化的分子是_________________ (填化学式);
③NaCl晶体中Na+的配位数为___________ ;
④写出H2O的任意一种等电子体的化学式___________ 。
(5)周期表前四周期的五种元素a、b、c、d、e,其核电荷数依次增大。a原子的核外电子总数与其周期数相同,b原子的最外层电子中有3个未成对电子,c原子的最外层电子数是其内层电子数的3倍,d与c同主族,e的价电子排布为3d104s1。
①b、c元素的第一电离能大小为:b_______ c(填“>"或“<”)
②d的基态原子的电子排布式为___________ ; a2d的VSKPK模型为___________ 。
③ba3和a2c两种分子键角较大的是___________ ;ba3极易溶于a2c的原因,除了两种分子都是极性
分子外,还因为____________________________ 。
④e和c能形成一种化合物,其晶胞结构如右图所示,若设阿伏伽德罗常数值为NA,晶体的密度为d g/cm3,则晶胞参数a=_______ nm(用含d、NA的代数式表示)。
(1)下列粒子的立体构型不是平面三角形的是
A.CO32- B.NH3 C.BF3 D.SO3
(2)下列分子中,属于含极性键的非极性分子的是
A.CH4 B.H2S C.C60 D.HCl
(3)现有四种离子晶体的晶胞,其离子排列方式如下列图所示,其中化学式不属于Mn型的是

(4)联合制碱法又称侯氏制碱法,其原理为:第一步NaCl+ NH3 + CO2+H2O=NaHCO3 + NH4Cl,第二步加热NaHCO3使其分解。关于第一步反应所包含的各物质中:
①属于离子化合物的是
②中心原子是sp杂化的分子是
③NaCl晶体中Na+的配位数为
④写出H2O的任意一种等电子体的化学式
(5)周期表前四周期的五种元素a、b、c、d、e,其核电荷数依次增大。a原子的核外电子总数与其周期数相同,b原子的最外层电子中有3个未成对电子,c原子的最外层电子数是其内层电子数的3倍,d与c同主族,e的价电子排布为3d104s1。
①b、c元素的第一电离能大小为:b
②d的基态原子的电子排布式为
③ba3和a2c两种分子键角较大的是
分子外,还因为
④e和c能形成一种化合物,其晶胞结构如右图所示,若设阿伏伽德罗常数值为NA,晶体的密度为d g/cm3,则晶胞参数a=

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为___________ 。
(2)《中华本草》等中医典籍中,记载了炉甘石( )可入药。
)可入药。 中,阴离子空间构型为
中,阴离子空间构型为___________ ,C原子的杂化形式为___________ 。
(3) 具有较高的熔点(872℃),其化学键类型是
具有较高的熔点(872℃),其化学键类型是___________ ; 不溶于有机溶剂
不溶于有机溶剂 、
、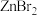 、
、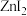 能够溶于乙醇、乙醚等有机溶剂,原因是
能够溶于乙醇、乙醚等有机溶剂,原因是___________ 。
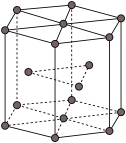
(4)金属Zn晶体中的原子堆积方式如图所示,六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为 ,Zn的密度为
,Zn的密度为___________  (列出计算式)。
(列出计算式)。
(5)铜转炉烟灰(主要成分为ZnO),加入氯化铵和氨水,浸出液中锌浸出液中锌以 形式存在,则浸取时反应的离子方程式为
形式存在,则浸取时反应的离子方程式为___________ 。氨分子的VSEPR模型为___________ 。
(6) 能活化ZnS,地表层原生铜的硫化物经氧化、淋滤作用后变成
能活化ZnS,地表层原生铜的硫化物经氧化、淋滤作用后变成 溶液,在地下深层遇到难溶的ZnS,慢慢转变为铜蓝(CuS),试推测其原因是
溶液,在地下深层遇到难溶的ZnS,慢慢转变为铜蓝(CuS),试推测其原因是___________ 。
(7)取m g活性氧化锌样品,预处理后配成待测液,加入指示剂3~4滴,再加入适量六亚甲基四胺,用a EDTA标准液进行滴定,消耗标准液V mL。若与1.0mL EDTA标准液[
EDTA标准液进行滴定,消耗标准液V mL。若与1.0mL EDTA标准液[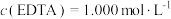 ]相当的以克表示的氧化锌质量为0.08139g,则样品中氧化锌的质量分数为
]相当的以克表示的氧化锌质量为0.08139g,则样品中氧化锌的质量分数为___________ (用代数式表示)。
(1)Zn原子核外电子排布式为
(2)《中华本草》等中医典籍中,记载了炉甘石(
 )可入药。
)可入药。 中,阴离子空间构型为
中,阴离子空间构型为(3)
 具有较高的熔点(872℃),其化学键类型是
具有较高的熔点(872℃),其化学键类型是 不溶于有机溶剂
不溶于有机溶剂 、
、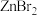 、
、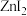 能够溶于乙醇、乙醚等有机溶剂,原因是
能够溶于乙醇、乙醚等有机溶剂,原因是(4)金属Zn晶体中的原子堆积方式如图所示,六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为
 ,Zn的密度为
,Zn的密度为 (列出计算式)。
(列出计算式)。
(5)铜转炉烟灰(主要成分为ZnO),加入氯化铵和氨水,浸出液中锌浸出液中锌以
 形式存在,则浸取时反应的离子方程式为
形式存在,则浸取时反应的离子方程式为(6)
 能活化ZnS,地表层原生铜的硫化物经氧化、淋滤作用后变成
能活化ZnS,地表层原生铜的硫化物经氧化、淋滤作用后变成 溶液,在地下深层遇到难溶的ZnS,慢慢转变为铜蓝(CuS),试推测其原因是
溶液,在地下深层遇到难溶的ZnS,慢慢转变为铜蓝(CuS),试推测其原因是(7)取m g活性氧化锌样品,预处理后配成待测液,加入指示剂3~4滴,再加入适量六亚甲基四胺,用a
 EDTA标准液进行滴定,消耗标准液V mL。若与1.0mL EDTA标准液[
EDTA标准液进行滴定,消耗标准液V mL。若与1.0mL EDTA标准液[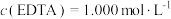 ]相当的以克表示的氧化锌质量为0.08139g,则样品中氧化锌的质量分数为
]相当的以克表示的氧化锌质量为0.08139g,则样品中氧化锌的质量分数为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】酞菁锌具有液晶的性质,在信息材料学领域有广泛应用,其结构如图所示。回答下列问题:

(1)基态Zn的价电子轨道表示式为____ ,C、N、O第一电离能由小到大的顺序是____ 。
(2)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。1mol八氧基酞菁锌中通过螯合作用形成的配位键有____ mol,该螯合物中N的杂化方式有____ 种。
(3)离子型ZnO与ZnS熔沸点高低比较ZnO____ ZnS(填高于、低于),判断理由____ 。
(4)ZnS常用作分析试剂、荧光体、光导体材料。立方ZnS晶体晶胞结构如图所示:
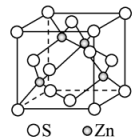
①在立方体体对角线的一维空间上S2-、Zn2+的分布规律正确的是____ (填选项)。
a. b.
b. 
c. d.
d.
②已知晶体密度为dg•cm-3,阿伏加德罗常数为NA,则Zn2+和S2-之间的最短核间距(x)为____ nm(用代数式表示),一个Zn2+周围与其距离最近的Zn2+的数目为____ 。

(1)基态Zn的价电子轨道表示式为
(2)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。1mol八氧基酞菁锌中通过螯合作用形成的配位键有
(3)离子型ZnO与ZnS熔沸点高低比较ZnO
(4)ZnS常用作分析试剂、荧光体、光导体材料。立方ZnS晶体晶胞结构如图所示:

①在立方体体对角线的一维空间上S2-、Zn2+的分布规律正确的是
a.
 b.
b. 
c.
 d.
d.
②已知晶体密度为dg•cm-3,阿伏加德罗常数为NA,则Zn2+和S2-之间的最短核间距(x)为
您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
名校
【推荐3】化合物Q是一种药物的中间体,可利用如下合成路线制备化合物Q;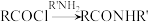
(1)有机物A的化学名称为__________ ;有机物C中官能团的名称为__________ 。
(2)反应①中加入 的作用是
的作用是____________________ ;合成路线中设计反应①和⑤目的是____________________ 。反应⑦的化学方程式为______________________________ 。下列关于反应③的说法,错误的是__________ (填标号)。
A.反应前后N原子的杂化方式未发生变化
B.反应类型为还原反应,当生成1molB时转移6mol电子
C.可以利用酸性 溶液鉴别物质A和B
溶液鉴别物质A和B
(3)有机物D的同分异构体中,同时含有苯环和硝基的共__________ 种(考虑立体异构);其中核磁共振氢谱显示含3组吸收峰,且吸收峰面积比为6:2:1的同分异构体的结构简式为__________ 。
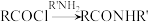
Ⅱ.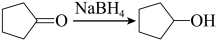
(1)有机物A的化学名称为
(2)反应①中加入
 的作用是
的作用是A.反应前后N原子的杂化方式未发生变化
B.反应类型为还原反应,当生成1molB时转移6mol电子
C.可以利用酸性
 溶液鉴别物质A和B
溶液鉴别物质A和B(3)有机物D的同分异构体中,同时含有苯环和硝基的共
您最近一年使用:0次
【推荐1】氮及其化合物与我们的生产、生活联系非常密切。
(1)工业上以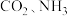 为原料生产尿素
为原料生产尿素 ,反应分两步进行:
,反应分两步进行:
Ⅰ:
Ⅱ: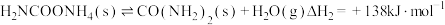
已知: 。
。
①请写出以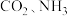 为原料,合成尿素和液态水的热化学方程式:
为原料,合成尿素和液态水的热化学方程式:___________ 。
② 时,在
时,在 的密闭容器中充入
的密闭容器中充入 和
和 模拟工业生产,
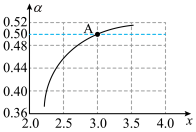
模拟工业生产, ,如图是
,如图是 平衡转化率
平衡转化率 与x的关系,计算图中A点
与x的关系,计算图中A点 的平衡转化率
的平衡转化率
___________ (填分数)。 转变为
转变为 ,其工作原理如图,M极接电源的
,其工作原理如图,M极接电源的___________ 极,N极的电极反应式为___________ 。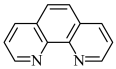 ,简写为phen,遇
,简写为phen,遇 溶液生成橙红色配合物
溶液生成橙红色配合物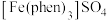 ,其中
,其中 的配位数为6。
的配位数为6。
① 中,phen的
中,phen的___________ 个N参与配位;
② 中,
中,___________ 提供空轨道,___________ 提供孤对电子。
(1)工业上以
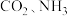 为原料生产尿素
为原料生产尿素 ,反应分两步进行:
,反应分两步进行:Ⅰ:

Ⅱ:
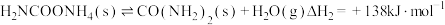
已知:
 。
。①请写出以
 为原料,合成尿素和液态水的热化学方程式:
为原料,合成尿素和液态水的热化学方程式:②
 时,在
时,在 的密闭容器中充入
的密闭容器中充入 和
和 模拟工业生产,
模拟工业生产, ,如图是
,如图是 平衡转化率
平衡转化率 与x的关系,计算图中A点
与x的关系,计算图中A点 的平衡转化率
的平衡转化率
 转变为
转变为 ,其工作原理如图,M极接电源的
,其工作原理如图,M极接电源的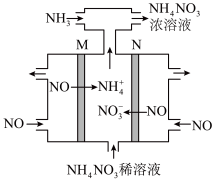
 ,简写为phen,遇
,简写为phen,遇 溶液生成橙红色配合物
溶液生成橙红色配合物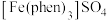 ,其中
,其中 的配位数为6。
的配位数为6。①
 中,phen的
中,phen的②
 中,
中,
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)铬元素基态原子的电子排布式为_________ ;硫酸铜溶于氨水,形成[Cu(NH3)4]SO4溶液,[Cu(NH3)4]SO4中阴离子的立体构型是______ ,_________ 接受孤对电子对;金属铜的堆积方式为______ 。
(2)制备Cr2O2Cl2的反应式为K2Cr2O2+3CCl4=2KCl+2Cr2O2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由小到大的顺序是_____________ (用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中中心原子的杂化方式为________ ,COCl2分子中ɑ键和π键的个数比为__________ 。
③NiO、FeO的晶体结构均与氯化钠的晶体结构相同。其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO_________ FeO(填“>”、“<”或“=”)。
(4)Cu和Ca的合金呈粉末状,极易被氧化,其晶胞结构如图所示:
①该晶体的化学式为_________ ,铜和钙两种金属相比铜的熔点比钙高,其原因是_______ 。
②已知该晶胞的密度为dg·cm-3,Ca半径为r1cm,Cu半径为r2cm,设NA为阿伏伽德罗常数,则该晶胞的空间利用率为________ (用含d、r1、r2、NA的代数式表示)。
(1)铬元素基态原子的电子排布式为
(2)制备Cr2O2Cl2的反应式为K2Cr2O2+3CCl4=2KCl+2Cr2O2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由小到大的顺序是
②COCl2分子中所有原子均满足8电子构型,COCl2分子中中心原子的杂化方式为
③NiO、FeO的晶体结构均与氯化钠的晶体结构相同。其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO
(4)Cu和Ca的合金呈粉末状,极易被氧化,其晶胞结构如图所示:

①该晶体的化学式为
②已知该晶胞的密度为dg·cm-3,Ca半径为r1cm,Cu半径为r2cm,设NA为阿伏伽德罗常数,则该晶胞的空间利用率为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】某小组探究不同阴离子与 的结合倾向并分析相关转化。
的结合倾向并分析相关转化。
资料:i. 和
和 均为白色,难溶于水。
均为白色,难溶于水。
ii. 与
与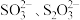 能生成
能生成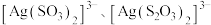
iii.与 结合倾向
结合倾向 。
。
(1)探究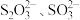 与
与 的结合倾向
的结合倾向
①由实验I推测:与 结合倾向
结合倾向
___________  (填“>”或“<”)。
(填“>”或“<”)。
②取两等份 浊液,分别滴加等浓度、等体积的
浊液,分别滴加等浓度、等体积的 和
和 溶液,前者无明显现象,后者浊液变澄清,澄清溶液中
溶液,前者无明显现象,后者浊液变澄清,澄清溶液中 价银的存在形式
价银的存在形式___________ (填化学式),推测:与 结合倾向
结合倾向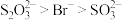 。
。
查阅资料:证实了上述推测。
(2) 的转化
的转化
①写出实验III中白色沉淀消失的离子方程式___________ 。
②查阅资料:实验IV中黑色沉淀是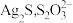 中
中 元素的化合价分别为
元素的化合价分别为 和
和 ,写出实验IV中白色沉淀变为黑色的化学方程式
,写出实验IV中白色沉淀变为黑色的化学方程式___________ 。
③ 溶液可用作定影液。向
溶液可用作定影液。向 溶液溶解
溶液溶解 之后的废定影液中,加入
之后的废定影液中,加入___________ (填试剂),可使定影液再生。
(3)资料显示: 原子与
原子与 结合比
结合比 原子更稳定。
原子更稳定。 与
与 结构相似,但与
结构相似,但与 结合倾向:
结合倾向: ,试从微粒空间结构角度解释原因
,试从微粒空间结构角度解释原因___________ 。
 的结合倾向并分析相关转化。
的结合倾向并分析相关转化。资料:i.
 和
和 均为白色,难溶于水。
均为白色,难溶于水。ii.
 与
与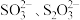 能生成
能生成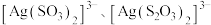
iii.与
 结合倾向
结合倾向 。
。(1)探究
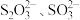 与
与 的结合倾向
的结合倾向 | 实验 | 滴管 | 试管 | 现象 |
| Ⅰ | 10滴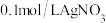 溶液 溶液 | 等浓度的 和 和 溶液 溶液 | 黄色沉淀 | |
| Ⅱ | 等浓度的 和 和 溶液 溶液 | 黄色沉淀 |
 结合倾向
结合倾向
 (填“>”或“<”)。
(填“>”或“<”)。②取两等份
 浊液,分别滴加等浓度、等体积的
浊液,分别滴加等浓度、等体积的 和
和 溶液,前者无明显现象,后者浊液变澄清,澄清溶液中
溶液,前者无明显现象,后者浊液变澄清,澄清溶液中 价银的存在形式
价银的存在形式 结合倾向
结合倾向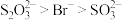 。
。查阅资料:证实了上述推测。
(2)
 的转化
的转化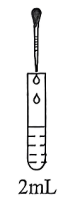 | 实验 | 滴管 | 试管 | 现象 |
| Ⅲ | 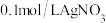 溶液 溶液 | 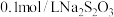 溶液 溶液 | 白色沉淀,振荡后消失 | |
| Ⅳ | 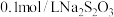 溶液 溶液 | 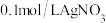 溶液 溶液 | 白色沉淀,逐渐变为灰色,最终为黑色沉淀 |
②查阅资料:实验IV中黑色沉淀是
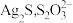 中
中 元素的化合价分别为
元素的化合价分别为 和
和 ,写出实验IV中白色沉淀变为黑色的化学方程式
,写出实验IV中白色沉淀变为黑色的化学方程式③
 溶液可用作定影液。向
溶液可用作定影液。向 溶液溶解
溶液溶解 之后的废定影液中,加入
之后的废定影液中,加入(3)资料显示:
 原子与
原子与 结合比
结合比 原子更稳定。
原子更稳定。 与
与 结构相似,但与
结构相似,但与 结合倾向:
结合倾向: ,试从微粒空间结构角度解释原因
,试从微粒空间结构角度解释原因
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】X、Y、Z、W、M、N是原子序数依次增大的前四周期元素,X的核外电子总数与其电子层数相同;Z和M同主族,W的原子序数为Y原子价电子数的3倍;基态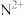 的d轨道中含有7个电子。由上述元素中的四种组成的两种化合物常用于合成阻燃材料,其结构简式如图所示。
的d轨道中含有7个电子。由上述元素中的四种组成的两种化合物常用于合成阻燃材料,其结构简式如图所示。
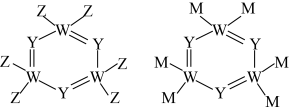
回答下列问题:
(1)基态W原子的价电子排布图为_______ ,其中电子占据最高能级的电子云轮廓图为_______ 形。
(2)W、M形成的一种化合物以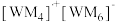 的形式存在,其中
的形式存在,其中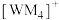 的空间结构为
的空间结构为_______ ;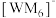 中心原子的价层电子对数为
中心原子的价层电子对数为_______ 。
(3)YX3极易溶于水,其原因是_______ 。
(4)N2+能形成配离子为八面体的配合物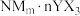 ,在该配合物中,
,在该配合物中,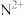 位于八面体的中心。若含0.5mol该配合物的溶液与足量
位于八面体的中心。若含0.5mol该配合物的溶液与足量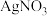 溶液反应可生成71.75g白色沉淀,则该配合物的化学式为
溶液反应可生成71.75g白色沉淀,则该配合物的化学式为_______ 。
(5)WM5能形成离子晶体,该晶体的立方晶胞如图所示:
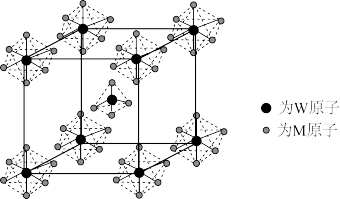
其阴离子的空间构型为_______ ,若晶胞边长为a pm,NA为阿伏加德罗常数的值,则该晶体的密度为_______ (写出计算式即可)。
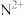 的d轨道中含有7个电子。由上述元素中的四种组成的两种化合物常用于合成阻燃材料,其结构简式如图所示。
的d轨道中含有7个电子。由上述元素中的四种组成的两种化合物常用于合成阻燃材料,其结构简式如图所示。
回答下列问题:
(1)基态W原子的价电子排布图为
(2)W、M形成的一种化合物以
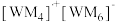 的形式存在,其中
的形式存在,其中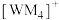 的空间结构为
的空间结构为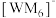 中心原子的价层电子对数为
中心原子的价层电子对数为(3)YX3极易溶于水,其原因是
(4)N2+能形成配离子为八面体的配合物
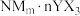 ,在该配合物中,
,在该配合物中,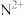 位于八面体的中心。若含0.5mol该配合物的溶液与足量
位于八面体的中心。若含0.5mol该配合物的溶液与足量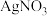 溶液反应可生成71.75g白色沉淀,则该配合物的化学式为
溶液反应可生成71.75g白色沉淀,则该配合物的化学式为(5)WM5能形成离子晶体,该晶体的立方晶胞如图所示:

其阴离子的空间构型为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】回答下列问题:
(1)咪唑结构为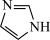 ,噻唑结构与咪唑很相似,结构为
,噻唑结构与咪唑很相似,结构为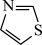 ,噻唑的熔沸点
,噻唑的熔沸点___________ 咪唑,原因是___________ 。
(2)基态镍原子d轨道中成对电子与单电子的数目比为___________ ,下列现象与原子核外电子跃迁有关的是___________ (填序号)。
a.焰火 b.LED灯光 c.金属导电 d.核辐射
(3)下列粒子的VSEPR模型为四面体且其空间结构为V形的是___________。
(4)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种 与EDTA形成的螯合物的结构如图所示,1个该配合物中通过螯合作用形成的配位键有
与EDTA形成的螯合物的结构如图所示,1个该配合物中通过螯合作用形成的配位键有___________ 个,其中提供孤对电子的原子为___________ (写元素符号)。
(5) 的晶胞结构示意图如(a)所示。其中O围绕
的晶胞结构示意图如(a)所示。其中O围绕 和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有
和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有 的单元数有
的单元数有___________ 个。
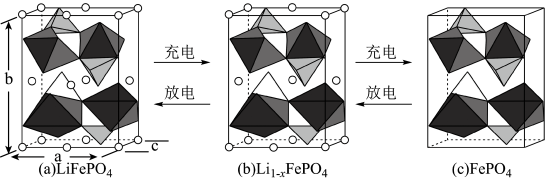
电池充电时, 脱出部分
脱出部分 ,形成
,形成 ,结构示意图如(b)所示,则x=
,结构示意图如(b)所示,则x=___________ ,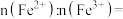
___________ 。
(6) 具有
具有 型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得
型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得 的晶胞参数为
的晶胞参数为 ,则
,则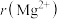 为
为___________ nm, 的晶体结构也与
的晶体结构也与 相同,
相同, 最邻近的
最邻近的 的核间距为
的核间距为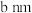 ,
, 的晶体的密度为
的晶体的密度为___________  (设
(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)咪唑结构为
 ,噻唑结构与咪唑很相似,结构为
,噻唑结构与咪唑很相似,结构为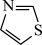 ,噻唑的熔沸点
,噻唑的熔沸点(2)基态镍原子d轨道中成对电子与单电子的数目比为
a.焰火 b.LED灯光 c.金属导电 d.核辐射
(3)下列粒子的VSEPR模型为四面体且其空间结构为V形的是___________。
A. | B. | C. | D. |
 与EDTA形成的螯合物的结构如图所示,1个该配合物中通过螯合作用形成的配位键有
与EDTA形成的螯合物的结构如图所示,1个该配合物中通过螯合作用形成的配位键有
(5)
 的晶胞结构示意图如(a)所示。其中O围绕
的晶胞结构示意图如(a)所示。其中O围绕 和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有
和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有 的单元数有
的单元数有
电池充电时,
 脱出部分
脱出部分 ,形成
,形成 ,结构示意图如(b)所示,则x=
,结构示意图如(b)所示,则x=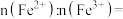
(6)
 具有
具有 型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得
型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得 的晶胞参数为
的晶胞参数为 ,则
,则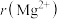 为
为 的晶体结构也与
的晶体结构也与 相同,
相同, 最邻近的
最邻近的 的核间距为
的核间距为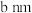 ,
, 的晶体的密度为
的晶体的密度为 (设
(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】Cu、Zn及其化合物在生产、生活中有着重要作用。请回答:
(1)Cu、Zn在周期表中________ 区,焰色反应时Cu的4s电子会跃迁至4p轨道,写出Cu的激发态电子排布式___________ 。
(2)分别向CuSO4、MgSO4溶液加氨水至过量,前者为深蓝色溶液,后者为白色沉淀。
①NH3与Cu2+形成配合物的能力大于Mg2+的原因为_________________ 。
②溶液中的水存在H3O+、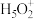 等微粒形式,
等微粒形式,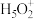 可看作是H3O+与H2O通过氢键形成的离子,则
可看作是H3O+与H2O通过氢键形成的离子,则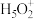 的结构式为
的结构式为___________ 。
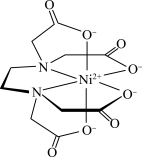
(3)Zn的某种化合物M是很好的补锌剂,结构式如图:
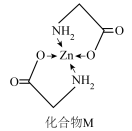
①1 mol M含有的σ键的数目为___________ 。
②常见含氮的配体有 H2NCH2 COOˉ、NH3、 等,NH3的分子空间构型为
等,NH3的分子空间构型为____________ , 的中心氮原子杂化方式为
的中心氮原子杂化方式为__________ 。
③M在人体内吸收率高的原因可能是锌形成配合物后,电荷__________ (填“变多”“变少”或“不变”),可在消化道内维持良好的稳定性。
(4)卤化锌的熔点如表:
则ZnX2熔点如表变化的原因是____________________ 。
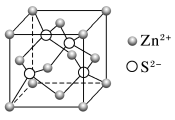
(5)Zn的某种硫化物的晶胞如图所示。已知S2-和Zn2+的半径分别为r1 pm、r2 pm,且S2-与Zn2+相切,NA为阿伏加 德罗常数的值。则该晶体的密度为________ g·cm-3(写计算表达式)。
(1)Cu、Zn在周期表中
(2)分别向CuSO4、MgSO4溶液加氨水至过量,前者为深蓝色溶液,后者为白色沉淀。
①NH3与Cu2+形成配合物的能力大于Mg2+的原因为
②溶液中的水存在H3O+、
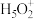 等微粒形式,
等微粒形式,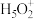 可看作是H3O+与H2O通过氢键形成的离子,则
可看作是H3O+与H2O通过氢键形成的离子,则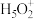 的结构式为
的结构式为(3)Zn的某种化合物M是很好的补锌剂,结构式如图:

①1 mol M含有的σ键的数目为
②常见含氮的配体有 H2NCH2 COOˉ、NH3、
 等,NH3的分子空间构型为
等,NH3的分子空间构型为 的中心氮原子杂化方式为
的中心氮原子杂化方式为③M在人体内吸收率高的原因可能是锌形成配合物后,电荷
(4)卤化锌的熔点如表:
| 卤化锌/ ZnX2 | ZnF2 | ZnCl2 | ZnBr2 |
| 熔点/℃ | 872 | 283 | 394 |
(5)Zn的某种硫化物的晶胞如图所示。已知S2-和Zn2+的半径分别为r1 pm、r2 pm,且S2-与Zn2+相切,NA为阿伏加 德罗常数的值。则该晶体的密度为

您最近一年使用:0次



