 和
和 都是锂离子电池的电极材料,可利用钛铁矿(主要成分为
都是锂离子电池的电极材料,可利用钛铁矿(主要成分为 ,还含有少量MgO、
,还含有少量MgO、 等杂质)来制备。工艺流程如下;
等杂质)来制备。工艺流程如下;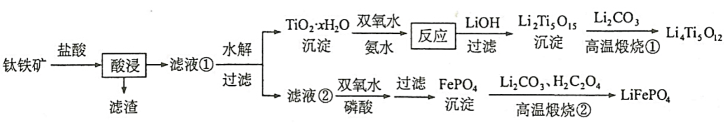
回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如图所示。由图可知,当铁的浸出率为80%时,所采用的实验条件为
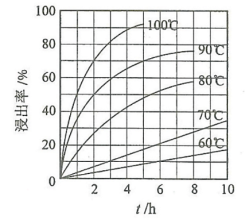
(2)“酸浸”后,钛主要以
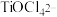 形式存在,写出相应反应的离子方程式
形式存在,写出相应反应的离子方程式(3)
 沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
沉淀与双氧水、氨水反应40min所得实验结果如下表所示:| 温度/℃ | 30 | 35 | 40 | 45 | 50 |
 转化率/% 转化率/% | 92 | 95 | 97 | 93 | 88 |
 转化率最高的原因
转化率最高的原因(4)若“滤液②”中
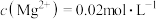 ,加入双氧水和磷酸(设溶液体积增加1倍),使
,加入双氧水和磷酸(设溶液体积增加1倍),使 恰好沉淀完全即溶液中
恰好沉淀完全即溶液中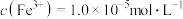 ,此时是否有
,此时是否有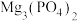 沉淀生成?
沉淀生成? 、
、 的
的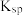 分别为
分别为 、
、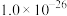 ].
].(5)写出“高温煅烧②”中由
 制备
制备 的化学方程式
的化学方程式(6)一种钛酸锂二次电池原理如图,放电时
 由N极层状材料中脱出经由电解质嵌入M极层状材料中,充电时N极电极反应方程式为
由N极层状材料中脱出经由电解质嵌入M极层状材料中,充电时N极电极反应方程式为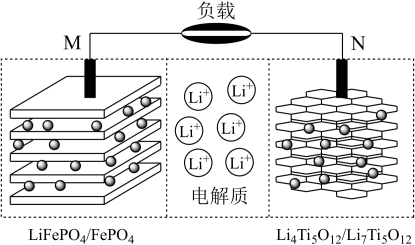
更新时间:2021/05/23 15:02:44
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】Ni常被镀在金属制品上以保护金属不生锈。
(1)镀镍的方法有:方法Ⅰ: 电镀镍。以NiSO4为电镀液。
①待镀零件与电源___________ 相连。
方法Ⅱ:化学镀。将待镀零件浸泡在含有Ni2+和H2PO2-的溶液中,在酸性等条件下发生下述反应:
(a)____Ni2++____H2PO2-+_____→___Ni++______H2PO3-+____,
(b)6H2PO2-+ 2H+= 2P+ 4H2PO3-+ 3H2↑
上述反应可在塑料镀件表面沉积镍—磷合金,从而达到化学镀镍的目的。
②写出并配平反应式(a)。______________
(2)LiNiO2是一种前景很好的锂离子电池正极材料。当温度高于850℃时,LiNiO2会分解。工业上用Ni(OH)2与LiOH的混合物在空气流中加热到700~800℃制得 LiNiO2,该反应的化学方程式为________________ ,加热温度不宜过高的原因是________________________ ,工业上也可用LiNO3代替上述工艺中的LiOH,存在的缺点可能是____________ 。
(3)以废旧二次电池为原料回收利用合成Ni(OH)2的工艺:
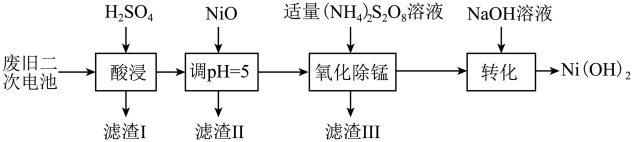
已知:酸浸后滤液中含有Ni2+、Al3+、Fe3+、Mn2+;Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.0×10-33,Ksp[Ni(OH)2]=1.6×10-14;
①“氧化除锰”是将锰元素最终转化为MnO2而除去,反应历程如下:
i.5S2O82-+2Mn2++8H2O=2MnO4-+10SO42-+16H+;
ii._____________________________________ (用离子方程式表示)。
②调pH=5操作时,已知溶液中Ni2+浓度为2.0mol/L,则“滤渣II”中是否存在Ni(OH)2沉淀?____________ (列式计算,并使用必要的文字说明)。
(1)镀镍的方法有:方法Ⅰ: 电镀镍。以NiSO4为电镀液。
①待镀零件与电源
方法Ⅱ:化学镀。将待镀零件浸泡在含有Ni2+和H2PO2-的溶液中,在酸性等条件下发生下述反应:
(a)____Ni2++____H2PO2-+_____→___Ni++______H2PO3-+____,
(b)6H2PO2-+ 2H+= 2P+ 4H2PO3-+ 3H2↑

上述反应可在塑料镀件表面沉积镍—磷合金,从而达到化学镀镍的目的。
②写出并配平反应式(a)。
(2)LiNiO2是一种前景很好的锂离子电池正极材料。当温度高于850℃时,LiNiO2会分解。工业上用Ni(OH)2与LiOH的混合物在空气流中加热到700~800℃制得 LiNiO2,该反应的化学方程式为
(3)以废旧二次电池为原料回收利用合成Ni(OH)2的工艺:

已知:酸浸后滤液中含有Ni2+、Al3+、Fe3+、Mn2+;Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.0×10-33,Ksp[Ni(OH)2]=1.6×10-14;
①“氧化除锰”是将锰元素最终转化为MnO2而除去,反应历程如下:
i.5S2O82-+2Mn2++8H2O=2MnO4-+10SO42-+16H+;
ii.
②调pH=5操作时,已知溶液中Ni2+浓度为2.0mol/L,则“滤渣II”中是否存在Ni(OH)2沉淀?
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】CoCO3可用作选矿剂、催化剂及伪装涂料的颜料。以含钴废渣(主要成CoO、Co2O3,还含有Al2O3、ZnO 等杂质)为原料制备CoCO3的一种工艺流程如下:

下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0mol·L-1计算):
(1)写出“酸溶”时发生氧化还原反应的化学方程式_________________ 。
(2)“除铝”过程中需要调节溶液pH 的范围为______________ ,形成沉渣时发生反应的离子方程式为_____________________ 。
(3)在实验室里,萃取操作用到的玻璃仪器主要有____________ ;上述“萃取”过程可表示为ZnSO4(水层)+2HX(有机层)  ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是_________________________ 。
(4)“沉钴”时,Na2CO3溶液滴加过快会导致产品不纯,请解释原因_________________ 。
(5)在空气中煅烧CoCO3生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672 L(标准状况),则该钴氧化物的化学式为____________________ 。

下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0mol·L-1计算):
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Co2+ | 7.6 | 9.4 |
| Al3+ | 3.0 | 5.0 |
| Zn2+ | 5.4 | 8.0 |
(1)写出“酸溶”时发生氧化还原反应的化学方程式
(2)“除铝”过程中需要调节溶液pH 的范围为
(3)在实验室里,萃取操作用到的玻璃仪器主要有
 ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是
ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是(4)“沉钴”时,Na2CO3溶液滴加过快会导致产品不纯,请解释原因
(5)在空气中煅烧CoCO3生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为0.672 L(标准状况),则该钴氧化物的化学式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
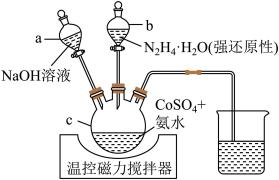
【推荐3】同济大学程传伟教授发现了一种高效的氮杂碳纳米片阵列负载的超薄Co(OH)2纳米片自支撑空气正极材料。实验室可用如图所示装置制得微米级Co(OH)2。
已知:①Co的化合价有+2价和+3价, 、
、 易与
易与 形成络合物,
形成络合物, 的还原性强于
的还原性强于 和
和 。
。
②沉淀的生成速率越快,颗粒越小,呈凝乳状或胶体,不易过滤。请回答下列问题:
(1)仪器 的名称是
的名称是_______ ;使用仪器 的第一步操作名称是
的第一步操作名称是_______ 。
(2) 时,先在不断搅拌下,向
时,先在不断搅拌下,向 中
中 溶液中加入氨水,调节
溶液中加入氨水,调节 至6,加入氨水的作用是
至6,加入氨水的作用是_______ 。
(3)加入氨水后,应先打开滴液漏斗_______ (填“a”或“b”);其理由是_______ 。
(4)将实验所得沉淀过滤、用热水洗涤、干燥,检验产品是否洗净的实验操作是_______ 。
(5)实验室还可以用废旧锂电池正极材料(含 ,以及少量
,以及少量 )为原料制备微米级
)为原料制备微米级 。已知:酸性条件下的氧化性强弱顺序为
。已知:酸性条件下的氧化性强弱顺序为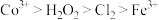 ;
; 可溶于水;下表是部分金属离子生成氢氧化物沉淀的
可溶于水;下表是部分金属离子生成氢氧化物沉淀的 。
。
请补充完整实验方案:取一定量废旧锂电池正极材料,粉碎后与 溶液配成悬浊液;在搅拌下,先加入
溶液配成悬浊液;在搅拌下,先加入_______ 到固体完全溶解;_______ 到溶液的颜色不再加深(或开始产生大量气泡),再向其中加入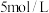 氮水调整溶液
氮水调整溶液 ,使
,使 形成
形成 沉淀,然后过滤,除去难溶性杂质
沉淀,然后过滤,除去难溶性杂质 ;
;_______ ,调节 至9.5,过滤、洗涤,真空㤨干得到微米级
至9.5,过滤、洗涤,真空㤨干得到微米级 。[实验中可选用的试剂:
。[实验中可选用的试剂: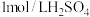 溶液、
溶液、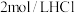 溶液、
溶液、 溶液、30%
溶液、30% 溶液]。
溶液]。
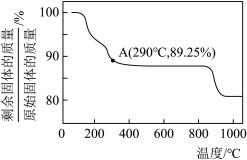
(6) 在空气中加热时,固体残留率随温度的变化如图所示,则在A点时,剩余固体的成分为
在空气中加热时,固体残留率随温度的变化如图所示,则在A点时,剩余固体的成分为_______ (填化学式)。

已知:①Co的化合价有+2价和+3价,
 、
、 易与
易与 形成络合物,
形成络合物, 的还原性强于
的还原性强于 和
和 。
。②沉淀的生成速率越快,颗粒越小,呈凝乳状或胶体,不易过滤。请回答下列问题:
(1)仪器
 的名称是
的名称是 的第一步操作名称是
的第一步操作名称是(2)
 时,先在不断搅拌下,向
时,先在不断搅拌下,向 中
中 溶液中加入氨水,调节
溶液中加入氨水,调节 至6,加入氨水的作用是
至6,加入氨水的作用是(3)加入氨水后,应先打开滴液漏斗
(4)将实验所得沉淀过滤、用热水洗涤、干燥,检验产品是否洗净的实验操作是
(5)实验室还可以用废旧锂电池正极材料(含
 ,以及少量
,以及少量 )为原料制备微米级
)为原料制备微米级 。已知:酸性条件下的氧化性强弱顺序为
。已知:酸性条件下的氧化性强弱顺序为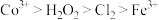 ;
; 可溶于水;下表是部分金属离子生成氢氧化物沉淀的
可溶于水;下表是部分金属离子生成氢氧化物沉淀的 。
。| 金属离子 |  |  |  |
开始沉淀的 | 7.6 | 7.6 | 2.7 |
沉淀完全的 | 9.2 | 9.6 | 3.7 |
 溶液配成悬浊液;在搅拌下,先加入
溶液配成悬浊液;在搅拌下,先加入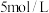 氮水调整溶液
氮水调整溶液 ,使
,使 形成
形成 沉淀,然后过滤,除去难溶性杂质
沉淀,然后过滤,除去难溶性杂质 ;
; 至9.5,过滤、洗涤,真空㤨干得到微米级
至9.5,过滤、洗涤,真空㤨干得到微米级 。[实验中可选用的试剂:
。[实验中可选用的试剂: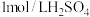 溶液、
溶液、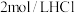 溶液、
溶液、 溶液、30%
溶液、30% 溶液]。
溶液]。(6)
 在空气中加热时,固体残留率随温度的变化如图所示,则在A点时,剩余固体的成分为
在空气中加热时,固体残留率随温度的变化如图所示,则在A点时,剩余固体的成分为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
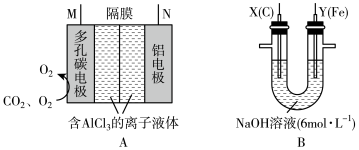
【推荐1】 具有强氧化性,能够消毒杀菌,同时能够吸附水中悬浮杂质。可用电解法制备
具有强氧化性,能够消毒杀菌,同时能够吸附水中悬浮杂质。可用电解法制备 ,采用的装置如图B所示,以
,采用的装置如图B所示,以 辅助的
辅助的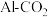 电池(如图A)为电源进行电解。
电池(如图A)为电源进行电解。
(1) 的电子式为
的电子式为___________ 。
(2)图A中正极反应式为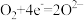 、
、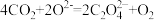 ,则该电池的总反应方程式为
,则该电池的总反应方程式为___________ 。
(3)图A中N极名称是___________ (填“正极”或“负极”),M极与图B___________ (填“X”或“Y”)极相连。
(4)电解过程中,图BX极区溶液的pH___________ (填“增大”“减小”或“不变”)。
(5)图B中两极均有气体产生,若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况下的气体体积),则Y电极质量减小___________ g。
 具有强氧化性,能够消毒杀菌,同时能够吸附水中悬浮杂质。可用电解法制备
具有强氧化性,能够消毒杀菌,同时能够吸附水中悬浮杂质。可用电解法制备 ,采用的装置如图B所示,以
,采用的装置如图B所示,以 辅助的
辅助的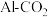 电池(如图A)为电源进行电解。
电池(如图A)为电源进行电解。
(1)
 的电子式为
的电子式为(2)图A中正极反应式为
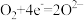 、
、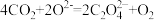 ,则该电池的总反应方程式为
,则该电池的总反应方程式为(3)图A中N极名称是
(4)电解过程中,图BX极区溶液的pH
(5)图B中两极均有气体产生,若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况下的气体体积),则Y电极质量减小
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】熔融碳酸盐燃料电池具有联合循环发电、燃料利用率高等优点。
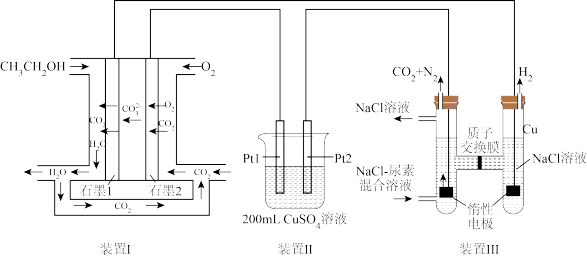
(1)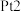 极为
极为__________ (填“阳”或“阴”)极,石墨2极发生___________ (填“氧化”或“还原”)反应。
(2)石墨1极的电极反应式为_________________ 。
(3)若装置Ⅰ中消耗标准状况下 ,则装置Ⅱ烧杯中溶液的
,则装置Ⅱ烧杯中溶液的 为
为_________ 。
(4)利用装置Ⅰ和装置Ⅱ进行电解精炼铜,则应把Pt1换成_________ (填“粗铜”或“精铜”),阴极质量增大 ,转移的电子数为
,转移的电子数为_________ 。
(5)装置Ⅲ中尿素 与
与 发生反应的化学方程式为
发生反应的化学方程式为__________________ ,除去 尿素,则产生标准状况下
尿素,则产生标准状况下 的体积为
的体积为________  。
。

(1)
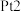 极为
极为(2)石墨1极的电极反应式为
(3)若装置Ⅰ中消耗标准状况下
 ,则装置Ⅱ烧杯中溶液的
,则装置Ⅱ烧杯中溶液的 为
为(4)利用装置Ⅰ和装置Ⅱ进行电解精炼铜,则应把Pt1换成
 ,转移的电子数为
,转移的电子数为(5)装置Ⅲ中尿素
 与
与 发生反应的化学方程式为
发生反应的化学方程式为 尿素,则产生标准状况下
尿素,则产生标准状况下 的体积为
的体积为 。
。
您最近一年使用:0次
【推荐3】二氧化碳的排放受到环境和能源领域的关注,其综合利用是研究的重要课题。
(1)合成尿素[CO(NH2)2]是利用 CO2的途径之一、尿素合成主要通过下列反应实现:
反应 I:2NH3(g)+CO2 (g)=NH2COONH4(s) △H1=−272 kJ·mol−1
反应Ⅱ:NH2COONH4(s)=CO(NH2)2(1)+H2O(g) △H2=+138kJ·mol−1
二氧化碳和氨气合成尿素的反应自发进行的条件是___________ ( 填“低温”“高温”或“任意条件”)。
(2)利用CO2和 H2合成乙烯:2CO2(g)+6H2 (g) CH2=CH2 (g)+4H2O(g)。
CH2=CH2 (g)+4H2O(g)。
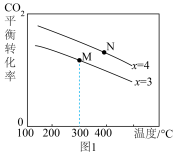
①在恒容密闭容器中,起始压强相同,反应温度、投料比[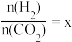 ]对CO2平衡转化 率的影响如图1所示。则△H
]对CO2平衡转化 率的影响如图1所示。则△H_____ (填“>”或“<”,下同)0;M、N 两点的化学平衡 常数KM _______ KN。
②300℃时,向1L恒容密闭容器中充入2mol CO2、6 mol H2,平衡时 CO2转化率为 50%,K=___________ (写出计算式即可)。
(3)用电化学方法还原CO2将其转化为其他化学产品可以实现对CO2的综合利用。图2是在酸性条件下电化学还原CO2的装置。
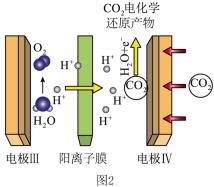
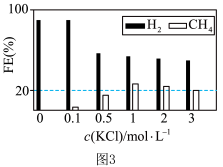
已知:法拉第效率(FE) 表示为 。控制pH=1、电解液中存在KCl 时,电化学还原CO2过程中CH4(其他含碳产物未标出)和 H2的法拉第效率变化如图3所示。
。控制pH=1、电解液中存在KCl 时,电化学还原CO2过程中CH4(其他含碳产物未标出)和 H2的法拉第效率变化如图3所示。
①写出阴极产生CH4的电极反应式:___________
②结合图3的变化规律,推测KCl的作用可能是___________ 。
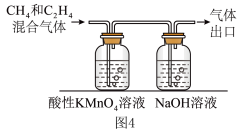
③c(KCl)=3mol/L 时,22.4L(已折合为标准状况,下同)CO₂ 被完全吸收并还原为CH4和C2H4,分离 H2后,将CH4和 C2H4的混合气体通入如图4所承装置(反应完全),出口处收集到气体8.96 L(不考虑水蒸气),则FE(C2H4)=___________ 。
(1)合成尿素[CO(NH2)2]是利用 CO2的途径之一、尿素合成主要通过下列反应实现:
反应 I:2NH3(g)+CO2 (g)=NH2COONH4(s) △H1=−272 kJ·mol−1
反应Ⅱ:NH2COONH4(s)=CO(NH2)2(1)+H2O(g) △H2=+138kJ·mol−1
二氧化碳和氨气合成尿素的反应自发进行的条件是
(2)利用CO2和 H2合成乙烯:2CO2(g)+6H2 (g)
 CH2=CH2 (g)+4H2O(g)。
CH2=CH2 (g)+4H2O(g)。①在恒容密闭容器中,起始压强相同,反应温度、投料比[
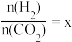 ]对CO2平衡转化 率的影响如图1所示。则△H
]对CO2平衡转化 率的影响如图1所示。则△H
②300℃时,向1L恒容密闭容器中充入2mol CO2、6 mol H2,平衡时 CO2转化率为 50%,K=
(3)用电化学方法还原CO2将其转化为其他化学产品可以实现对CO2的综合利用。图2是在酸性条件下电化学还原CO2的装置。

已知:法拉第效率(FE) 表示为
 。控制pH=1、电解液中存在KCl 时,电化学还原CO2过程中CH4(其他含碳产物未标出)和 H2的法拉第效率变化如图3所示。
。控制pH=1、电解液中存在KCl 时,电化学还原CO2过程中CH4(其他含碳产物未标出)和 H2的法拉第效率变化如图3所示。
①写出阴极产生CH4的电极反应式:
②结合图3的变化规律,推测KCl的作用可能是
③c(KCl)=3mol/L 时,22.4L(已折合为标准状况,下同)CO₂ 被完全吸收并还原为CH4和C2H4,分离 H2后,将CH4和 C2H4的混合气体通入如图4所承装置(反应完全),出口处收集到气体8.96 L(不考虑水蒸气),则FE(C2H4)=

您最近一年使用:0次
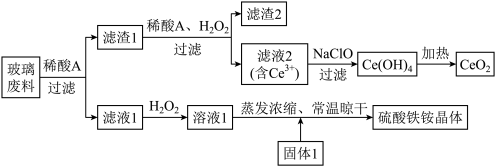
【推荐1】铈及其化合物在工业生产中应用广泛。以某玻璃废料(主要成分为CeO2、SiO2、Fe2O3、FeO等)为原料制备CeO2和NH4Fe(SO4)2·12H2O(硫酸铁铵晶体),其流程如下(已知CeO2既不溶于稀硫酸,也不溶于氢氧化钠溶液):
(1)浸取玻璃废料选用的“稀酸A”为____________ (填“稀硫酸”或“稀盐酸”)。
(2)向滤渣1加入H2O2的目的是_________ (用离子方程式表示)。为了提高溶解“滤渣1”的速率,常采用加热措施,但温度高于60℃时溶解速率减慢,其主要原因是____________ 。
(3)为了不引入杂质,所选用固体1的化学式为_______________ 。
(4)制备2mol CeO2需要NaClO的质量为____________ 。
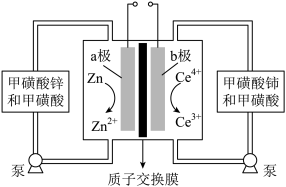
(5)锌铈液流电池放电时的工作原理如图所示。____________________ 。
②充电时,当a极增重6.5g时,有_________ mol离子通过交换膜以平衡电荷。
(1)浸取玻璃废料选用的“稀酸A”为
(2)向滤渣1加入H2O2的目的是
(3)为了不引入杂质,所选用固体1的化学式为
(4)制备2mol CeO2需要NaClO的质量为
(5)锌铈液流电池放电时的工作原理如图所示。
②充电时,当a极增重6.5g时,有
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】汽车让人们的生活越来越便捷。请回答以下问题:
(1)汽车尾气主要含有CO、 、NO等物质,是造成城市空气污染的主要因素之一,
、NO等物质,是造成城市空气污染的主要因素之一, 和
和 反应生成NO的能量变化如图所示,则由该反应生成1mol NO时,应
反应生成NO的能量变化如图所示,则由该反应生成1mol NO时,应_________ (填“释放”或“吸收”)_________ kJ能量。
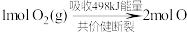
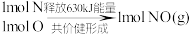
(2)汽车受到猛烈碰撞时,安全气囊内的NaN3固体迅速分解,产生氮气和金属钠,该过程中的能量变化如图所示。下列说法错误的是_________。
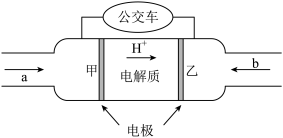
(3)近年来广州首批15辆氢燃料电池公交车已经投入运营,标志着广州公交进入氢能产业时代,如图是某种氢氧燃料电池的内部结构示意图,该电池工作时,正极反应方程式为_____________ ,标况下消耗11.2L空气,整个电路中转移的电子数约为_________ NA。
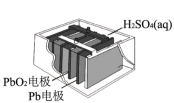
(4)铅酸蓄电池自1859年由普兰特发明以来,至今已有150多年的历史,技术十分成熟,是全球上使用最广泛的化学电源。目前最常见还是应用于汽车、柴油机车、摩托车等的启动电源。总反应式为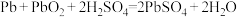 ,使用铅蓄电池时,其正极为
,使用铅蓄电池时,其正极为_________ ,负极电极反应式为____________ 。
(1)汽车尾气主要含有CO、
 、NO等物质,是造成城市空气污染的主要因素之一,
、NO等物质,是造成城市空气污染的主要因素之一, 和
和 反应生成NO的能量变化如图所示,则由该反应生成1mol NO时,应
反应生成NO的能量变化如图所示,则由该反应生成1mol NO时,应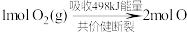
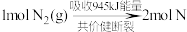
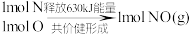
(2)汽车受到猛烈碰撞时,安全气囊内的NaN3固体迅速分解,产生氮气和金属钠,该过程中的能量变化如图所示。下列说法错误的是_________。

| A.NaN3属于离子化合物 |
| B.NaN3的分解反应属于吸热反应 |
C. 表示 表示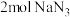 固体的能量 固体的能量 |
| D.NaN3作为安全气囊的气体发生剂,具有产气快、产气量大等优点 |
(3)近年来广州首批15辆氢燃料电池公交车已经投入运营,标志着广州公交进入氢能产业时代,如图是某种氢氧燃料电池的内部结构示意图,该电池工作时,正极反应方程式为

(4)铅酸蓄电池自1859年由普兰特发明以来,至今已有150多年的历史,技术十分成熟,是全球上使用最广泛的化学电源。目前最常见还是应用于汽车、柴油机车、摩托车等的启动电源。总反应式为
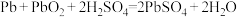 ,使用铅蓄电池时,其正极为
,使用铅蓄电池时,其正极为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】I.铅蓄电池是典型的可充型电池,它的正负极隔板是惰性材料,电池总反应式为:Pb+PbO2+2 H2SO4 2PbSO4+2H2O,请完成下列问题:
2PbSO4+2H2O,请完成下列问题:
(1)放电时:正极的电极反应式是____________________ ;电解液中H2SO4的浓度将变_______ (填“大”或者“小”);当外电路通过1 mol电子时,理论上负极板的质量增加_________________ g。
(2)在完全放电耗尽PbO2和Pb时,若按如下图1连接,充电一段时间后,则在A电极上生成__________ 、B电极上生成__________ ,这种充电连接方式是否正确?_______ (填“是”或者“否”)
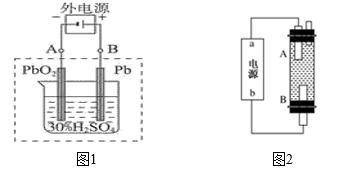
(3)某同学设计利用电解法制取漂白液或Fe(OH)2的实验装置如上图2所示。若通过电解饱和食盐水来制漂白液,则b为电源的_____ 极,该装置中发生的总反应方程式为_____________________
若用于制Fe(OH)2,使用硫酸钠作电解质溶液,阳极选用_____________ 材料作电极。
II.已知一种锌铁电池的反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时,正极反应式为
3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时,正极反应式为_______________________
 2PbSO4+2H2O,请完成下列问题:
2PbSO4+2H2O,请完成下列问题:(1)放电时:正极的电极反应式是
(2)在完全放电耗尽PbO2和Pb时,若按如下图1连接,充电一段时间后,则在A电极上生成

(3)某同学设计利用电解法制取漂白液或Fe(OH)2的实验装置如上图2所示。若通过电解饱和食盐水来制漂白液,则b为电源的
若用于制Fe(OH)2,使用硫酸钠作电解质溶液,阳极选用
II.已知一种锌铁电池的反应为:3Zn+2K2FeO4+8H2O
 3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时,正极反应式为
3Zn(OH)2+2Fe(OH)3+4KOH,该电池放电时,正极反应式为
您最近一年使用:0次



