苯乙烯是一种重要的化工原料,可采用乙苯催化脱氢法制备,反应原理如下:
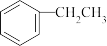 (g)⇌
(g)⇌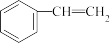 (g)+H2(g) ∆H
(g)+H2(g) ∆H
(1)已知:
计算上述反应的∆H=_____ 。
(2)生产过程中,在600℃时向乙苯中掺入高温水蒸气,保持体系总压为105.6kPa催化反应。若投料比n(乙苯)/n(H2O)=1:8,达平衡时乙苯的转化率为60%,则p(H2O)=____ kPa,平衡常数Kp=____ (Kp为以分压表示的平衡常数,气体分压=气体总压×体积分数)。若其他条件不变,将上述起始反应物置于某恒容密闭容器中,则乙苯的平衡转化率___ (填“>”“<”或“=”)60%。
(3)利用膜反应新技术,可以实现边反应边分离出生成的氢气。不同温度下,1.00mol乙苯在容积为1.00L的密闭容器中反应,氢气移出率α与乙苯平衡转化率关系如图所示:(氢气移出率 )
)
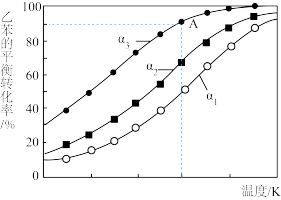
①同温度时α1、α2、α3依次____ (填“增大”或“减小”),理由是____ 。
②A点平衡常数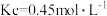 ,则α为
,则α为___ 。
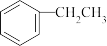 (g)⇌
(g)⇌ (g)+H2(g) ∆H
(g)+H2(g) ∆H(1)已知:
| 化学键 | C—H | C—C | C=C | H—H |
键能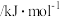 | 412 | 348 | 612 | 436 |
(2)生产过程中,在600℃时向乙苯中掺入高温水蒸气,保持体系总压为105.6kPa催化反应。若投料比n(乙苯)/n(H2O)=1:8,达平衡时乙苯的转化率为60%,则p(H2O)=
(3)利用膜反应新技术,可以实现边反应边分离出生成的氢气。不同温度下,1.00mol乙苯在容积为1.00L的密闭容器中反应,氢气移出率α与乙苯平衡转化率关系如图所示:(氢气移出率
 )
)
①同温度时α1、α2、α3依次
②A点平衡常数
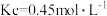 ,则α为
,则α为
更新时间:2021-05-27 21:05:11
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】化学反应有物质的变化过程中还有能量的转化,据此回答下列问题:
(1)已知甲醇的燃烧热为725.8kJ·mol-1,写出表示其燃烧热的热化学方程式:_______ 。
(2)已知反应2HI(g)=H2(g)+I2(g)的△H=+11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI (g)分子中化学键断裂时需吸收的能量为_____ kJ。
(3)已知:CO(g)+2H2(g)→CH3OH(g)△H1=-90.1 kJ·mol-1;3CH3OH(g) CH3CH=CH2(g)+H2O(g)△H2=-31.0 kJ·mol-1则CO与H2合成CH3CH=CH2的热化学方程式为
CH3CH=CH2(g)+H2O(g)△H2=-31.0 kJ·mol-1则CO与H2合成CH3CH=CH2的热化学方程式为________ 。
(4)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池。其工作原理示意如图:
则其负极反应式为____________ 。
(1)已知甲醇的燃烧热为725.8kJ·mol-1,写出表示其燃烧热的热化学方程式:
(2)已知反应2HI(g)=H2(g)+I2(g)的△H=+11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI (g)分子中化学键断裂时需吸收的能量为
(3)已知:CO(g)+2H2(g)→CH3OH(g)△H1=-90.1 kJ·mol-1;3CH3OH(g)
 CH3CH=CH2(g)+H2O(g)△H2=-31.0 kJ·mol-1则CO与H2合成CH3CH=CH2的热化学方程式为
CH3CH=CH2(g)+H2O(g)△H2=-31.0 kJ·mol-1则CO与H2合成CH3CH=CH2的热化学方程式为(4)甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池。其工作原理示意如图:

则其负极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①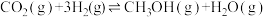
 ;
;
②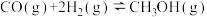
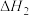 ;
;
③
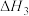 ;
;
回答下列问题:
(1)已知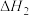 =-99 kJ·mol-1,则根据上表相关的化学键键能(“C
=-99 kJ·mol-1,则根据上表相关的化学键键能(“C O”表示CO的化学键)计算X=
O”表示CO的化学键)计算X=_______ kJ·mol-1
(2)反应①、②、③对应 、
、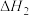 、
、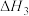 的关系
的关系 =
=_______ 平衡常数K1、K2、K3之间的关系式为K1=_______ 。
(3)根据化学反应原理,分析增大压强对反应③的影响为_______ 。(要求:从对反应速率、平衡状态、转化率角度回答)
①
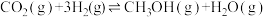
 ;
;②
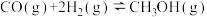
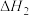 ;
;③

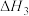 ;
;| 化学键 | H-H | C-O | C O O | H-O | C-H |
| E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | X |
(1)已知
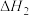 =-99 kJ·mol-1,则根据上表相关的化学键键能(“C
=-99 kJ·mol-1,则根据上表相关的化学键键能(“C O”表示CO的化学键)计算X=
O”表示CO的化学键)计算X=(2)反应①、②、③对应
 、
、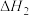 、
、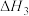 的关系
的关系 =
=(3)根据化学反应原理,分析增大压强对反应③的影响为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】甲醇既是重要的化工原料,又可作为燃料。利用CO2、CO与H2在一定条件下可反应生成甲醇。研究表明,在某催化剂作用下,发生的主要反应如下:
反应I:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H1=-59kJ·mol-1
反应II:CO2(g)+H2(g)⇌CO(g)+H2O(g) △H2
反应III:CO(g)+2H2(g)⇌CH3OH(g) △H3
其中,有关物质化学键的键能如表所示:
请回答下列问题:
(1)仅考虑反应I,有利于提高该反应平衡转化率的条件是___________。
(2)反应II的△H2=___________ 。
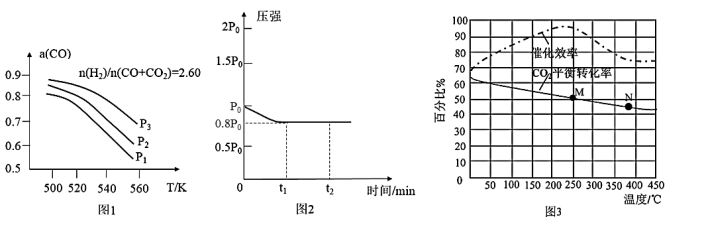
(3)当CO2、CO与H2以n(H2)/n(CO+CO2)=2.60的组成比通入时,体系中CO平衡转化率(a)与压强的关系如图1所示。请指出图1中压强由大到小顺序是___________ ,判断理由是___________ 。
(4)某温度下,向1L固定容积的密闭容器中加入2.5molCO2(g)和2.5molH2(g),仅发生反应I,达到平衡,测得容器内气体的压强随着时间的变化如图2所示。
①请计算该温度下,反应I的平衡常数K=___________ (用具体数值表示);
②若保持其他条件不变,继续向容器中投入2.5molCO2(g)和2.5molH2(g),再次达到平衡,此时,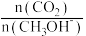 的值与原平衡相比,将
的值与原平衡相比,将___________ (填“增大”、“减小”或“不变”)。
③若采用0.5L固定容积的密闭容器,投料量(仍为2.5molCO2和2.5molH2)、催化剂和反应温度均保持不变,请在图2中画出0~t2时刻,体系内的压强随时间变化的曲线___________ 。
(5)在一定压强下,按n(CO2):n(H2)=1:3(总物质的量为4amol)的投料比充入密闭容器中仅发生反应I。测定温度对的CO2的平衡转化率和催化剂催化效率影响情况如图3所示。下列说法不正确的是___________ 。
A.生成CH3OH的速率:ʋ(M)可能大于ʋ(N)
B.平衡常数:KM>KN
C.其他条件相同时,适当增大催化剂的表面积,可提高CO2的平衡转化率
D.若投料比不变,温度越低,反应一定时间后CO2的转化率一定较高
E.若其他条件不变,投料比改为n(CO2)∶n(H2)=1∶4,可以提高CO2的平衡转化率
反应I:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H1=-59kJ·mol-1
反应II:CO2(g)+H2(g)⇌CO(g)+H2O(g) △H2
反应III:CO(g)+2H2(g)⇌CH3OH(g) △H3
其中,有关物质化学键的键能如表所示:
| 化学键 | C=O | H-H | C-O | C≡O | H-O | C-H |
| 键能/(kJ∙mol-1) | 805 | 436 | 343 | 1076 | 465 | 413 |
请回答下列问题:
(1)仅考虑反应I,有利于提高该反应平衡转化率的条件是___________。
| A.高温高压 | B.低温低压 | C.高温低压 | D.低温高压 |
(3)当CO2、CO与H2以n(H2)/n(CO+CO2)=2.60的组成比通入时,体系中CO平衡转化率(a)与压强的关系如图1所示。请指出图1中压强由大到小顺序是

(4)某温度下,向1L固定容积的密闭容器中加入2.5molCO2(g)和2.5molH2(g),仅发生反应I,达到平衡,测得容器内气体的压强随着时间的变化如图2所示。
①请计算该温度下,反应I的平衡常数K=
②若保持其他条件不变,继续向容器中投入2.5molCO2(g)和2.5molH2(g),再次达到平衡,此时,
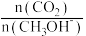 的值与原平衡相比,将
的值与原平衡相比,将③若采用0.5L固定容积的密闭容器,投料量(仍为2.5molCO2和2.5molH2)、催化剂和反应温度均保持不变,请在图2中画出0~t2时刻,体系内的压强随时间变化的曲线
(5)在一定压强下,按n(CO2):n(H2)=1:3(总物质的量为4amol)的投料比充入密闭容器中仅发生反应I。测定温度对的CO2的平衡转化率和催化剂催化效率影响情况如图3所示。下列说法不正确的是
A.生成CH3OH的速率:ʋ(M)可能大于ʋ(N)
B.平衡常数:KM>KN
C.其他条件相同时,适当增大催化剂的表面积,可提高CO2的平衡转化率
D.若投料比不变,温度越低,反应一定时间后CO2的转化率一定较高
E.若其他条件不变,投料比改为n(CO2)∶n(H2)=1∶4,可以提高CO2的平衡转化率
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,回答下列问题:
(1)已知某温度下某反应的化学平衡常数表达式为:K=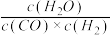 ,它所对应的化学反应为:
,它所对应的化学反应为:__________________ 。
(2)已知在一定温度下,
①C(s)+CO2(g) 2CO(g) ΔH1=a kJ/mol 平衡常数K1;
2CO(g) ΔH1=a kJ/mol 平衡常数K1;
②CO(g)+H2O(g) H2(g)+CO2(g) ΔH2=b kJ/mol 平衡常数K2;
H2(g)+CO2(g) ΔH2=b kJ/mol 平衡常数K2;
③C(s)+H2O(g) CO(g)+H2(g) ΔH3 平衡常数K3。
CO(g)+H2(g) ΔH3 平衡常数K3。
则K1、K2、K3之间的关系是________ ,ΔH3=__________________ (用含a、b的代数式表示)。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
该反应的正反应方向是______ 反应(填“吸热”或“放热”),若在500 ℃时进行,设起始时CO和H2O的起始浓度均为0.020 mol/L,在该条件下,CO的平衡转化率为________ 。
(4)高炉炼铁产生的废气中的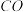 可进行回收,使其在一定条件下和
可进行回收,使其在一定条件下和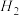 反应制备甲醇:
反应制备甲醇: 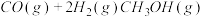 。请回答下列问题;
。请回答下列问题;
①若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
则下列关系正确的是__________ 。
a. b.
b.  c.
c. 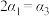 d.
d. 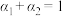
e.该反应若生成1
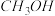 ,则放出(
,则放出(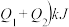 热量
热量
②若在一体积可变的密闭容器中充入1
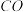 、2
、2
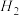 和1
和1
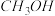 ,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向
,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向__________ (填“正”或“逆”)反应方向移动。
(1)已知某温度下某反应的化学平衡常数表达式为:K=
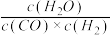 ,它所对应的化学反应为:
,它所对应的化学反应为:(2)已知在一定温度下,
①C(s)+CO2(g)
 2CO(g) ΔH1=a kJ/mol 平衡常数K1;
2CO(g) ΔH1=a kJ/mol 平衡常数K1;②CO(g)+H2O(g)
 H2(g)+CO2(g) ΔH2=b kJ/mol 平衡常数K2;
H2(g)+CO2(g) ΔH2=b kJ/mol 平衡常数K2;③C(s)+H2O(g)
 CO(g)+H2(g) ΔH3 平衡常数K3。
CO(g)+H2(g) ΔH3 平衡常数K3。则K1、K2、K3之间的关系是
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g)
 H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(4)高炉炼铁产生的废气中的
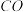 可进行回收,使其在一定条件下和
可进行回收,使其在一定条件下和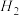 反应制备甲醇:
反应制备甲醇: 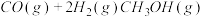 。请回答下列问题;
。请回答下列问题;①若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡时的有关数据如下表:
| 容器 | 反应物投入的量 | 反应物的转化率 | 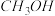 的浓度 的浓度 | 能量变化(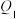 、 、 、 、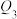 均大于0) 均大于0) |
| 甲 | 1 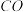 和2 和2 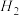 | 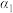 | 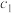 | 放出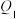 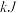 热量 热量 |
| 乙 | 1 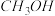 | 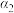 | 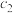 | 放出 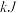 热量 热量 |
| 丙 | 2 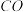 和4 和4 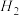 | 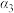 | 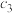 | 放出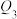 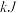 热量 热量 |
a.
 b.
b.  c.
c. 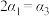 d.
d. 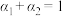
e.该反应若生成1

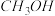 ,则放出(
,则放出(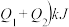 热量
热量②若在一体积可变的密闭容器中充入1

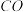 、2
、2
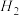 和1
和1
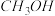 ,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向
,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】Ⅰ.科学家对汽车尾气进行无害化处理反应为:2CO + 2NO 2CO2 + N2。一定条件下,在
2CO2 + N2。一定条件下,在 L密闭容器中充入
L密闭容器中充入 mol CO和
mol CO和 mol NO,一段时间后测得CO、CO2浓度随时间变化如图1所示,CO的平衡转化率与温度、起始投料比m的关系如图2所示,图中起始投料比
mol NO,一段时间后测得CO、CO2浓度随时间变化如图1所示,CO的平衡转化率与温度、起始投料比m的关系如图2所示,图中起始投料比 ,完成问题:
,完成问题:

(1)该反应的化学平衡常数表达式是___________ 。根据图1,用N2表示该反应达平衡过程中的平均反应速率是___________ mol/(L·min)。
(2)已知:反应2CO(g) + 2NO(g) 2CO2(g) + N2(g)中,每生成14克N2时放出373.23kJ热量,试写出上述反应的热化学方程式:
2CO2(g) + N2(g)中,每生成14克N2时放出373.23kJ热量,试写出上述反应的热化学方程式:___________ 。
(3)该反应的正反应是___________ 反应(填“吸热”或“放热”)。图2中a、b、c三点对应的平衡常数Ka、Kb、Kc相对大小关系是___________ 。
(4)写出一条结论,可表明该反应已经达到平衡状态___________ 。
(5)下列关于该可逆反应的说法不正确的是__________ (单选题)
a.其他条件不变,若充入N2,达到新平衡时, 、
、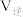 均增大
均增大
b.加入催化剂可提高NO的平衡转化率
c.若适当增大压强,则平衡正向移动
d.其他条件不变,若容器体积扩大一倍,达到新平衡时,c(N2)小于原来的一半
Ⅱ.研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了验证催化剂比表面积对反应速率的影响规律,在温度为T0时,某同学设计了以下实验:
(6)在图3中画出表中实验II条件下混合气体中NO的浓度随时间变化的曲线。________

 2CO2 + N2。一定条件下,在
2CO2 + N2。一定条件下,在 L密闭容器中充入
L密闭容器中充入 mol CO和
mol CO和 mol NO,一段时间后测得CO、CO2浓度随时间变化如图1所示,CO的平衡转化率与温度、起始投料比m的关系如图2所示,图中起始投料比
mol NO,一段时间后测得CO、CO2浓度随时间变化如图1所示,CO的平衡转化率与温度、起始投料比m的关系如图2所示,图中起始投料比 ,完成问题:
,完成问题:
(1)该反应的化学平衡常数表达式是
(2)已知:反应2CO(g) + 2NO(g)
 2CO2(g) + N2(g)中,每生成14克N2时放出373.23kJ热量,试写出上述反应的热化学方程式:
2CO2(g) + N2(g)中,每生成14克N2时放出373.23kJ热量,试写出上述反应的热化学方程式:(3)该反应的正反应是
(4)写出一条结论,可表明该反应已经达到平衡状态
(5)下列关于该可逆反应的说法不正确的是
a.其他条件不变,若充入N2,达到新平衡时,
 、
、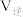 均增大
均增大b.加入催化剂可提高NO的平衡转化率
c.若适当增大压强,则平衡正向移动
d.其他条件不变,若容器体积扩大一倍,达到新平衡时,c(N2)小于原来的一半
Ⅱ.研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了验证催化剂比表面积对反应速率的影响规律,在温度为T0时,某同学设计了以下实验:
| 实验编号 | T(K) | NO的初始浓( ) ) | CO的初始浓度 ( ) ) | 催化剂的比表面积 (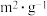 ) ) |
| I | T0 | 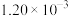 | 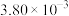 | 75 |
| II | T0 | 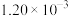 | 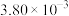 | 50 |

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG) 相似,被誉为“21世纪的清洁燃料”。制备原理如下:
I.由天然气催化制备二甲醚:
①2CH4(g)+O2(g) CH3OCH3(g) +H2O(g) △H1=- 283.6 kJ/mol
CH3OCH3(g) +H2O(g) △H1=- 283.6 kJ/mol
II.由合成气制备二甲醚:
②CO(g) +2H2(g)⇌CH3OH(g) △H2=- 90.7 kJ/mol
③2CH3OH (g)⇌CH3OCH3(g) +H2O(g) △H3
回答下列问题:
(1) 反应③中的相关的化学键键能数据如表:
△H3=_______ kJ/mol。

(2) 制备原理I中,在恒温、恒容的密闭容器中合成,将气体按n(CH4): n(O2) =2: 1混合,能正确反映反应①中CH4的体积分数随温度变化的曲线是_______ 。下列能表明反应①达到化学平衡状态的是________ 。
a.混合气体的密度不变
b.反应容器中二甲醚的百分含量不变
c.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
d.混合气体的压强不变
(3) 有人模拟制备原理II,在500K时的2L 的密闭容器中充入2mol CO和6mol H2,8min达到平衡,平衡时CO 的转化率为80%,c(CH3OCH3)=0.3mol/L,用H2表示反应②的速率是______ ;可逆反应③的平衡常数K=_______ 。若在500K 时,测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v ( 正)______ v (逆),说明原因________________ 。
I.由天然气催化制备二甲醚:
①2CH4(g)+O2(g)
 CH3OCH3(g) +H2O(g) △H1=- 283.6 kJ/mol
CH3OCH3(g) +H2O(g) △H1=- 283.6 kJ/molII.由合成气制备二甲醚:
②CO(g) +2H2(g)⇌CH3OH(g) △H2=- 90.7 kJ/mol
③2CH3OH (g)⇌CH3OCH3(g) +H2O(g) △H3
回答下列问题:
(1) 反应③中的相关的化学键键能数据如表:
| 化学键 | H—H | C—O | H—O(水) | H—O(醇) | C—H |
| E/(kJ/mol ) | 436 | 343 | 465 | 453 | 413 |

(2) 制备原理I中,在恒温、恒容的密闭容器中合成,将气体按n(CH4): n(O2) =2: 1混合,能正确反映反应①中CH4的体积分数随温度变化的曲线是
a.混合气体的密度不变
b.反应容器中二甲醚的百分含量不变
c.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
d.混合气体的压强不变
(3) 有人模拟制备原理II,在500K时的2L 的密闭容器中充入2mol CO和6mol H2,8min达到平衡,平衡时CO 的转化率为80%,c(CH3OCH3)=0.3mol/L,用H2表示反应②的速率是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】为使CO2的利用更具价值,某研究小组设计了如下三种减碳方式。请按要求回答下列问题。
(1)设想1:用太阳能将CO2转化成O2和C(s,石墨烯)如图所示:

①热分解系统中能量转化形式为___________ 。
②在重整系统中的还原剂为:___________ 。
(2)设想2:CO2和CH4反应转化为CH3COOH,其催化反应历程示意图如下(E1与E2的单位为kJ):
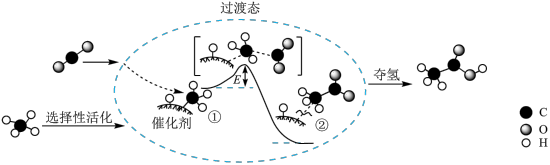
①该催化总反应为___________ 。
②Ⅰ→Ⅲ反应的
___________ kJ/mol。
(3)设想3:CO2与H2在催化剂作用下制取乙烯:在2L密闭容器中分别投入2mol CO2,6mol H2,发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)  ;在不同温度下,用传感技术测出平衡时n(H2)的变化关系如图所示。
;在不同温度下,用传感技术测出平衡时n(H2)的变化关系如图所示。

①该反应的
___________ 0(填“>”“<”或“不能确定”)。
②200℃,5min达平衡,v(C2H4)=___________ ;CO2的平衡转化率为___________ ;该反应平衡常数的值为___________ 。
③其他条件不变,将反应器容积压缩为原来的一半,达新平衡时比原平衡C2H4浓度将___________ (填“增大”“减小”或“不变),判断理由是 ___________ 。
(1)设想1:用太阳能将CO2转化成O2和C(s,石墨烯)如图所示:

①热分解系统中能量转化形式为
②在重整系统中的还原剂为:
(2)设想2:CO2和CH4反应转化为CH3COOH,其催化反应历程示意图如下(E1与E2的单位为kJ):

①该催化总反应为
②Ⅰ→Ⅲ反应的

(3)设想3:CO2与H2在催化剂作用下制取乙烯:在2L密闭容器中分别投入2mol CO2,6mol H2,发生反应:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)  ;在不同温度下,用传感技术测出平衡时n(H2)的变化关系如图所示。
;在不同温度下,用传感技术测出平衡时n(H2)的变化关系如图所示。
①该反应的

②200℃,5min达平衡,v(C2H4)=
③其他条件不变,将反应器容积压缩为原来的一半,达新平衡时比原平衡C2H4浓度将
您最近一年使用:0次
【推荐2】Br2是实验室中常用试剂,也是工业原料。
(1)实验室里液溴一般保存在密封的棕色试剂瓶中,同时还需要___________ 。
(2)工业上常用纯碱法富集从海水中提取的溴元素,第一步,用纯碱溶液吸收热空气吹出的溴蒸气,生成NaBr和NaBrO3;第二步,向吸收液中加入稀硫酸生成Br2.第二步的离子方程式为_______ 。
(3)利用溴化铜制备溴:2CuBr2(s)⇌2CuBr(s)+Br2(g)。在密闭容器中充入足量的CuBr2固体,发生上述反应。在温度为T℃时达到平衡,测得c(Br2)=0.4mol·L-1。保持温度不变,在4min时刻将容器的容积扩大一倍并保持体积不变至10min达到新平衡。

①在如图所示的坐标系中补充4min~10min之间c(Br2)~t关系曲线___________ 。
②下列固体物质的物理量不变时不能表示该反应已达到平衡状态的是___________ (填字母)。
A.总质量 B.总物质的量 C.平均摩尔质量
(4)已知:拟卤素,如(OCN)2、(SCN)2等性质与卤素单质的性质相似。取少量溴水分装A、B两支试管,依次滴加足量的KOCN溶液、KSCN溶液,振荡试管,发现A试管溶液不褪色,B试管溶液褪色。
①由此推知,Br2、(OCN)2、(SCN)2的氧化性强弱排序为_____ 。写出B试管中发生反应的离子方程式:______ 。
②向含淀粉的KI溶液中滴加(OCN)2溶液,可观察到现象是___________ 。
(5)T℃时,HBr(g)催化氧化反应为4HBr(g)+O2(g)⇌2Br2(g)+2H2O(g)。在体积为VL的恒容密闭容器中充入4molHBr(g)和1molO2(g),发生上述反应,达到平衡时产物总浓度与反应物总浓度之比为4:5,气体总压强为4.5kPa。该温度下,上述反应平衡常数KP=___________ (Kp是用气体分压计算的平衡常数,分压=总压×气体的物质的量分数)。
(1)实验室里液溴一般保存在密封的棕色试剂瓶中,同时还需要
(2)工业上常用纯碱法富集从海水中提取的溴元素,第一步,用纯碱溶液吸收热空气吹出的溴蒸气,生成NaBr和NaBrO3;第二步,向吸收液中加入稀硫酸生成Br2.第二步的离子方程式为
(3)利用溴化铜制备溴:2CuBr2(s)⇌2CuBr(s)+Br2(g)。在密闭容器中充入足量的CuBr2固体,发生上述反应。在温度为T℃时达到平衡,测得c(Br2)=0.4mol·L-1。保持温度不变,在4min时刻将容器的容积扩大一倍并保持体积不变至10min达到新平衡。

①在如图所示的坐标系中补充4min~10min之间c(Br2)~t关系曲线
②下列固体物质的物理量不变时不能表示该反应已达到平衡状态的是
A.总质量 B.总物质的量 C.平均摩尔质量
(4)已知:拟卤素,如(OCN)2、(SCN)2等性质与卤素单质的性质相似。取少量溴水分装A、B两支试管,依次滴加足量的KOCN溶液、KSCN溶液,振荡试管,发现A试管溶液不褪色,B试管溶液褪色。
①由此推知,Br2、(OCN)2、(SCN)2的氧化性强弱排序为
②向含淀粉的KI溶液中滴加(OCN)2溶液,可观察到现象是
(5)T℃时,HBr(g)催化氧化反应为4HBr(g)+O2(g)⇌2Br2(g)+2H2O(g)。在体积为VL的恒容密闭容器中充入4molHBr(g)和1molO2(g),发生上述反应,达到平衡时产物总浓度与反应物总浓度之比为4:5,气体总压强为4.5kPa。该温度下,上述反应平衡常数KP=
您最近一年使用:0次
【推荐3】煤的气化是对煤进行深加工的重要方法,其主要反应是碳和水蒸气反应生成水煤气。
(1)已知在101KPa、150℃时,各1mol的碳、一氧化碳和氢气在足量的氧气充分燃烧并恢复至原温度,所放出的热量分别为393.7kJ/mol、283.0kJ/mol、242.0 kJ/mol,请写出煤的气化反应的热化学方程式__________________ ;请从热力学角度简述该反应在某条件下能够正向进行的原因是_______________ 。
(2)在恒容密闭容器里,按物质的量比1:1加入一定量的碳和水蒸气反应生成水煤气。一定条件下达到平衡,当改变反应的某一条件时,下列变化能说明平衡一定向正反应方向移动的是_________ 。(填序号)
A.正反应速率先增大后减少 B.化学平衡常数K减少
C.混合气体的平均相对分子质量减少 D.反应物气体体积分数增大
(3)一定条件下煤的气化产物还可以发生反应,700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) CO2(g)+ H2(g) 反应过程中测定的部分数据见下表:
CO2(g)+ H2(g) 反应过程中测定的部分数据见下表:
请根据表格回答下列问题:
①计算反应在5min内由氢气表示的平均速率为:_____________ 。
②列式并计算该反应在700℃时的化学平衡常数K=__________ ,如果温度升至800℃,上述反应平衡常数为0.64,则正反应为___________ (填“吸热”或“放热”)反应。
③将上表中达平衡后的混合气体恢复至室温,用200mL2mol/LNaOH溶液进行吸收,充分反应后假设溶液体积不变,下列说法不正确的是:(已知HCO3-电离常数约为4 10-11,CaCO3的溶度积常数约为3
10-11,CaCO3的溶度积常数约为3 10-9)___________
10-9)___________
A.c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
B.c(H2CO3)<c(CO32-)
C.c(Na+)+c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D.向该溶液中加入等体积等浓度的CaCl2溶液产生白色沉淀
(1)已知在101KPa、150℃时,各1mol的碳、一氧化碳和氢气在足量的氧气充分燃烧并恢复至原温度,所放出的热量分别为393.7kJ/mol、283.0kJ/mol、242.0 kJ/mol,请写出煤的气化反应的热化学方程式
(2)在恒容密闭容器里,按物质的量比1:1加入一定量的碳和水蒸气反应生成水煤气。一定条件下达到平衡,当改变反应的某一条件时,下列变化能说明平衡一定向正反应方向移动的是
A.正反应速率先增大后减少 B.化学平衡常数K减少
C.混合气体的平均相对分子质量减少 D.反应物气体体积分数增大
(3)一定条件下煤的气化产物还可以发生反应,700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)
 CO2(g)+ H2(g) 反应过程中测定的部分数据见下表:
CO2(g)+ H2(g) 反应过程中测定的部分数据见下表:| 反应时间/ min | n(CO)/ mol | n(H2O)/ mol |
| 0 | 1.20 | 0.60 |
| 5 | 0.80 | |
| 10 | 0.20 |
请根据表格回答下列问题:
①计算反应在5min内由氢气表示的平均速率为:
②列式并计算该反应在700℃时的化学平衡常数K=
③将上表中达平衡后的混合气体恢复至室温,用200mL2mol/LNaOH溶液进行吸收,充分反应后假设溶液体积不变,下列说法不正确的是:(已知HCO3-电离常数约为4
 10-11,CaCO3的溶度积常数约为3
10-11,CaCO3的溶度积常数约为3 10-9)___________
10-9)___________A.c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
B.c(H2CO3)<c(CO32-)
C.c(Na+)+c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D.向该溶液中加入等体积等浓度的CaCl2溶液产生白色沉淀
您最近一年使用:0次



