煤的气化是对煤进行深加工的重要方法,其主要反应是碳和水蒸气反应生成水煤气。
(1)已知在101KPa、150℃时,各1mol的碳、一氧化碳和氢气在足量的氧气充分燃烧并恢复至原温度,所放出的热量分别为393.7kJ/mol、283.0kJ/mol、242.0 kJ/mol,请写出煤的气化反应的热化学方程式__________________ ;请从热力学角度简述该反应在某条件下能够正向进行的原因是_______________ 。
(2)在恒容密闭容器里,按物质的量比1:1加入一定量的碳和水蒸气反应生成水煤气。一定条件下达到平衡,当改变反应的某一条件时,下列变化能说明平衡一定向正反应方向移动的是_________ 。(填序号)
A.正反应速率先增大后减少 B.化学平衡常数K减少
C.混合气体的平均相对分子质量减少 D.反应物气体体积分数增大
(3)一定条件下煤的气化产物还可以发生反应,700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) CO2(g)+ H2(g) 反应过程中测定的部分数据见下表:
CO2(g)+ H2(g) 反应过程中测定的部分数据见下表:
请根据表格回答下列问题:
①计算反应在5min内由氢气表示的平均速率为:_____________ 。
②列式并计算该反应在700℃时的化学平衡常数K=__________ ,如果温度升至800℃,上述反应平衡常数为0.64,则正反应为___________ (填“吸热”或“放热”)反应。
③将上表中达平衡后的混合气体恢复至室温,用200mL2mol/LNaOH溶液进行吸收,充分反应后假设溶液体积不变,下列说法不正确的是:(已知HCO3-电离常数约为4 10-11,CaCO3的溶度积常数约为3
10-11,CaCO3的溶度积常数约为3 10-9)___________
10-9)___________
A.c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
B.c(H2CO3)<c(CO32-)
C.c(Na+)+c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D.向该溶液中加入等体积等浓度的CaCl2溶液产生白色沉淀
(1)已知在101KPa、150℃时,各1mol的碳、一氧化碳和氢气在足量的氧气充分燃烧并恢复至原温度,所放出的热量分别为393.7kJ/mol、283.0kJ/mol、242.0 kJ/mol,请写出煤的气化反应的热化学方程式
(2)在恒容密闭容器里,按物质的量比1:1加入一定量的碳和水蒸气反应生成水煤气。一定条件下达到平衡,当改变反应的某一条件时,下列变化能说明平衡一定向正反应方向移动的是
A.正反应速率先增大后减少 B.化学平衡常数K减少
C.混合气体的平均相对分子质量减少 D.反应物气体体积分数增大
(3)一定条件下煤的气化产物还可以发生反应,700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)
 CO2(g)+ H2(g) 反应过程中测定的部分数据见下表:
CO2(g)+ H2(g) 反应过程中测定的部分数据见下表:| 反应时间/ min | n(CO)/ mol | n(H2O)/ mol |
| 0 | 1.20 | 0.60 |
| 5 | 0.80 | |
| 10 | 0.20 |
请根据表格回答下列问题:
①计算反应在5min内由氢气表示的平均速率为:
②列式并计算该反应在700℃时的化学平衡常数K=
③将上表中达平衡后的混合气体恢复至室温,用200mL2mol/LNaOH溶液进行吸收,充分反应后假设溶液体积不变,下列说法不正确的是:(已知HCO3-电离常数约为4
 10-11,CaCO3的溶度积常数约为3
10-11,CaCO3的溶度积常数约为3 10-9)___________
10-9)___________A.c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
B.c(H2CO3)<c(CO32-)
C.c(Na+)+c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D.向该溶液中加入等体积等浓度的CaCl2溶液产生白色沉淀
更新时间:2017-03-09 22:20:19
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】工业排放物可能对环境和人体健康产生危害,含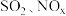 的烟气必须经过处理才可排放。回答下列问题:
的烟气必须经过处理才可排放。回答下列问题:
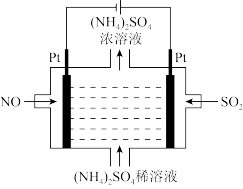
(1)若烟气主要成分为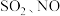 ,可通过电解法除去,其原理如图所示。阳极的电极反应式为
,可通过电解法除去,其原理如图所示。阳极的电极反应式为_______ 。标准状况下,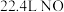 完全反应转移电子数为
完全反应转移电子数为_______ 。
(2)若烟气主要成分为 ,可通入
,可通入 溶液将
溶液将 完全转化为
完全转化为 。
。 溶液中离子浓度从大到小的顺序为
溶液中离子浓度从大到小的顺序为_______ 。
(3)若烟气主要成分为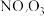 能有效地氧化
能有效地氧化 。
。
① 分子的空间结构与水分子的相似,
分子的空间结构与水分子的相似, 是
是_______ (填“极性”“极性”)分子。
②已知: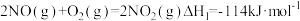
 (活化能
(活化能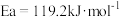 )
)
 ∆H3=
∆H3=_____ kJ/mol(活化能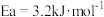 )
)
③ 可经
可经 处理后再用碱液吸收而实现脱除。为分析氧化时温度对
处理后再用碱液吸收而实现脱除。为分析氧化时温度对 脱除率的影响,将
脱除率的影响,将 与
与 混合反应一段时间,再用碱液吸收氧化后的气体。其他条件相同时,
混合反应一段时间,再用碱液吸收氧化后的气体。其他条件相同时, 脱除率随
脱除率随 与
与 混合反应时温度变化情况为,温度在
混合反应时温度变化情况为,温度在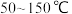 时,随着温度升高,
时,随着温度升高, 脱除率无明显变化;温度超过
脱除率无明显变化;温度超过 时,随着温度升高,
时,随着温度升高, 脱除率下降。其可能原因是
脱除率下降。其可能原因是_______ 。
(4)若烟气主要成分为 ,用
,用 氧化
氧化 时,使用催化剂可提高氧化效率。研究发现
时,使用催化剂可提高氧化效率。研究发现 在某催化剂表面被
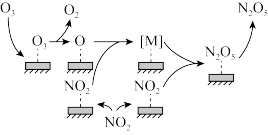
在某催化剂表面被 氧化时反应机理如图所示,反应过程中,氮氧化物[M]与
氧化时反应机理如图所示,反应过程中,氮氧化物[M]与 按物质的量1:1反应生成
按物质的量1:1反应生成 ,[M]的化学式为
,[M]的化学式为_____ 。该催化氧化过程总反应的化学方程式为_______ 。
 的烟气必须经过处理才可排放。回答下列问题:
的烟气必须经过处理才可排放。回答下列问题:(1)若烟气主要成分为
 ,可通过电解法除去,其原理如图所示。阳极的电极反应式为
,可通过电解法除去,其原理如图所示。阳极的电极反应式为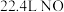 完全反应转移电子数为
完全反应转移电子数为
(2)若烟气主要成分为
 ,可通入
,可通入 溶液将
溶液将 完全转化为
完全转化为 。
。 溶液中离子浓度从大到小的顺序为
溶液中离子浓度从大到小的顺序为(3)若烟气主要成分为
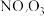 能有效地氧化
能有效地氧化 。
。①
 分子的空间结构与水分子的相似,
分子的空间结构与水分子的相似, 是
是②已知:
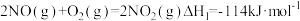
 (活化能
(活化能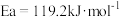 )
) ∆H3=
∆H3=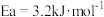 )
)③
 可经
可经 处理后再用碱液吸收而实现脱除。为分析氧化时温度对
处理后再用碱液吸收而实现脱除。为分析氧化时温度对 脱除率的影响,将
脱除率的影响,将 与
与 混合反应一段时间,再用碱液吸收氧化后的气体。其他条件相同时,
混合反应一段时间,再用碱液吸收氧化后的气体。其他条件相同时, 脱除率随
脱除率随 与
与 混合反应时温度变化情况为,温度在
混合反应时温度变化情况为,温度在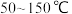 时,随着温度升高,
时,随着温度升高, 脱除率无明显变化;温度超过
脱除率无明显变化;温度超过 时,随着温度升高,
时,随着温度升高, 脱除率下降。其可能原因是
脱除率下降。其可能原因是(4)若烟气主要成分为
 ,用
,用 氧化
氧化 时,使用催化剂可提高氧化效率。研究发现
时,使用催化剂可提高氧化效率。研究发现 在某催化剂表面被
在某催化剂表面被 氧化时反应机理如图所示,反应过程中,氮氧化物[M]与
氧化时反应机理如图所示,反应过程中,氮氧化物[M]与 按物质的量1:1反应生成
按物质的量1:1反应生成 ,[M]的化学式为
,[M]的化学式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】氮及其化合物在生产生活中有广泛应用,请回答下列问题。

(1)N4气态分子结构如图1所示,已知断裂1molN—N吸收l67kJ的热量,生成lmol N N放出942kJ热量。试写出由N4气态分子变成N2气态分子的热化学方程式
N放出942kJ热量。试写出由N4气态分子变成N2气态分子的热化学方程式______________ 。
(2)盐N2H6Cl2是离子化合物,性质与NH4Cl类似,其水溶液呈弱酸性。写出足量金属镁加入N2H6Cl2溶液中所发生反应的化学方程式________________ 。
(3)AlCl3与NaN3在高温下反应可制得高温结构陶瓷氮化铝(AlN)且生成N2。若有8.4 g N2生成,则转移电子数为_______ 。
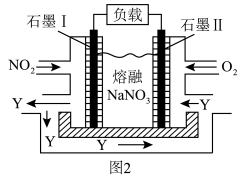
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图2。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为_____________ ;若最终得到1mol Y产品,则理论上需要消耗标准状况下O2的体积为__________ L。


(1)N4气态分子结构如图1所示,已知断裂1molN—N吸收l67kJ的热量,生成lmol N
 N放出942kJ热量。试写出由N4气态分子变成N2气态分子的热化学方程式
N放出942kJ热量。试写出由N4气态分子变成N2气态分子的热化学方程式(2)盐N2H6Cl2是离子化合物,性质与NH4Cl类似,其水溶液呈弱酸性。写出足量金属镁加入N2H6Cl2溶液中所发生反应的化学方程式
(3)AlCl3与NaN3在高温下反应可制得高温结构陶瓷氮化铝(AlN)且生成N2。若有8.4 g N2生成,则转移电子数为
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图2。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】回答下列问题:
(1)微生物作用下, 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如图:
。两步反应的能量变化示意图如图:

1mol (aq)全部氧化成
(aq)全部氧化成 (aq)的热化学方程式是
(aq)的热化学方程式是_______ 。
(2)高能燃料肼N2H4,俗称联氨。在工业生产中用途广泛。已知N2H4(l)+O2(g)=N2(g)+2H2O(l)ΔH=-622kJ·mol-1,计算16gN2H4(l)燃烧生成氮气和液态水(反应①)时放出的热量为_______ kJ。相同条件下,若生成氮气和水蒸气(反应②),则反应②放出的热量比①_______ (填“多”或“少”)。
(3)甲醇是一种重要的化工原料,CO可用于合成甲醇,发生反应:CO(g)+2H2(g)⇌CH3OH(g)。在一容积可变的密闭容器中充有1molCO与2molH2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(ɑ)与温度(T)、压强(p)的关系如图所示。
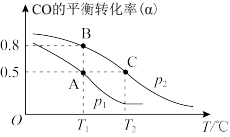
①p1_______ p2(填“>”“<”或“=”)
②A、B、C三点的平衡常数(KA、KB、KC)大小关系为_______ (用“>”“<”或“=”连接,下同)
③A、B、C三点容器内混合气体的平均摩尔质量(MA、MB、MC)大小关系为_______ 。
④下列可作为反应达到化学平衡状态的标志的是_______ (填字母)
A.CO、CH3OH的物质的量之比保持不变
B.生成1molCO的同时生成2molH2
C.CO、H2、CH3OH的物质的量之比为1:2:1
D.CH3OH的体积分数不再变化
(1)微生物作用下,
 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如图:
。两步反应的能量变化示意图如图:
1mol
 (aq)全部氧化成
(aq)全部氧化成 (aq)的热化学方程式是
(aq)的热化学方程式是(2)高能燃料肼N2H4,俗称联氨。在工业生产中用途广泛。已知N2H4(l)+O2(g)=N2(g)+2H2O(l)ΔH=-622kJ·mol-1,计算16gN2H4(l)燃烧生成氮气和液态水(反应①)时放出的热量为
(3)甲醇是一种重要的化工原料,CO可用于合成甲醇,发生反应:CO(g)+2H2(g)⇌CH3OH(g)。在一容积可变的密闭容器中充有1molCO与2molH2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(ɑ)与温度(T)、压强(p)的关系如图所示。

①p1
②A、B、C三点的平衡常数(KA、KB、KC)大小关系为
③A、B、C三点容器内混合气体的平均摩尔质量(MA、MB、MC)大小关系为
④下列可作为反应达到化学平衡状态的标志的是
A.CO、CH3OH的物质的量之比保持不变
B.生成1molCO的同时生成2molH2
C.CO、H2、CH3OH的物质的量之比为1:2:1
D.CH3OH的体积分数不再变化
您最近一年使用:0次
【推荐1】清洁能源的开发、废水的处理都能体现化学学科的应用价值。
Ⅰ. 工业上可利用CO2来制备清洁燃料甲醇,有关化学反应如下:
反应A:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
反应B:CO2(g)+H2⇌H2O(g)+CO(g) △H2=+41kJ·mol-1
⑴ 写出用CO(g)和H2(g)合成CH3OH(g)反应的热化学方程式:__________________ 。
⑵ 反应A可自发进行的温度条件是________ (填“低温”或“高温”) 。
⑶ 写出两个有利于提高反应A中甲醇平衡产率的条件___________ 。
⑷ 在Cu-ZnO/ZrO2催化下,CO2和H2混和气体,体积比1∶3,总物质的量amol进行反应,测得CO2转化率、CH3OH和CO选择性随温度、压强变化情况分别如图所示(选择性:转化的CO2中生成CH3OH或CO的百分比)。______ 。
A. 温度 B. 压强 C. 催化剂
② 如图中M点温度为250℃,CO2的平衡转化率为25%,该温度下反应B的平衡常数为________________ (用分数表示)。
Ⅱ.实验室模拟“间接电化学氧化法”处理氨氮废水中NH4+的装置如图所示。以硫酸铵和去离子水配制成初始的模拟废水,并以NaCl调节溶液中氯离子浓度,阳极产物将氨氮废水中的NH4+氧化成空气中的主要成分。__________________________________ 。
⑹ 除去NH4+的离子反应方程式为________________________________________ 。
Ⅰ. 工业上可利用CO2来制备清洁燃料甲醇,有关化学反应如下:
反应A:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1反应B:CO2(g)+H2⇌H2O(g)+CO(g) △H2=+41kJ·mol-1
⑴ 写出用CO(g)和H2(g)合成CH3OH(g)反应的热化学方程式:
⑵ 反应A可自发进行的温度条件是
⑶ 写出两个有利于提高反应A中甲醇平衡产率的条件
⑷ 在Cu-ZnO/ZrO2催化下,CO2和H2混和气体,体积比1∶3,总物质的量amol进行反应,测得CO2转化率、CH3OH和CO选择性随温度、压强变化情况分别如图所示(选择性:转化的CO2中生成CH3OH或CO的百分比)。

A. 温度 B. 压强 C. 催化剂
② 如图中M点温度为250℃,CO2的平衡转化率为25%,该温度下反应B的平衡常数为
Ⅱ.实验室模拟“间接电化学氧化法”处理氨氮废水中NH4+的装置如图所示。以硫酸铵和去离子水配制成初始的模拟废水,并以NaCl调节溶液中氯离子浓度,阳极产物将氨氮废水中的NH4+氧化成空气中的主要成分。

⑹ 除去NH4+的离子反应方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】氮及其化合物是重要的化工原料。回答下列问题:
(1)已知:
 kJ⋅mol
kJ⋅mol

 kJ⋅mol
kJ⋅mol
则反应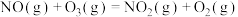 的
的
___________ 。
(2)在不同压强下,向2.0 L恒容密闭容器中通入初始浓度为3.0 mol⋅L-1 NO、1.0 mol⋅L-1 ,使其发生反应:
,使其发生反应: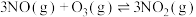
 kJ∙mol-1。测得平衡时
kJ∙mol-1。测得平衡时 的体积百分含量随着温度、压强变化情况如图所示:
的体积百分含量随着温度、压强变化情况如图所示:

① 、
、 、
、 由大到小的顺序为
由大到小的顺序为___________ 。
②下列数据能表明反应处于平衡状态的是___________ (填字母)。
A.混合气体的密度不变 B.混合气体的平均摩尔质量不变
C.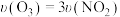 D.混合气体的颜色深浅不变
D.混合气体的颜色深浅不变
③温度为 时,反应的平衡常数
时,反应的平衡常数
___________ (填具体数字)。
(3)对于可逆反应 ,若起始投料
,若起始投料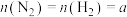 mol,达到平衡后,增大压强,N2的体积分数
mol,达到平衡后,增大压强,N2的体积分数___________ (填“增大”“减小”或“不变”)。
(4)恒容绝热的密闭容器中充入反应物,在一定条件下分别发生四个不同的反应,平衡常数与压强随反应进行变化情况合理,且在高温下能自发进行的是___________ (填字母)。

(1)已知:

 kJ⋅mol
kJ⋅mol

 kJ⋅mol
kJ⋅mol
则反应
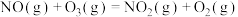 的
的
(2)在不同压强下,向2.0 L恒容密闭容器中通入初始浓度为3.0 mol⋅L-1 NO、1.0 mol⋅L-1
 ,使其发生反应:
,使其发生反应: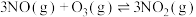
 kJ∙mol-1。测得平衡时
kJ∙mol-1。测得平衡时 的体积百分含量随着温度、压强变化情况如图所示:
的体积百分含量随着温度、压强变化情况如图所示:
①
 、
、 、
、 由大到小的顺序为
由大到小的顺序为②下列数据能表明反应处于平衡状态的是
A.混合气体的密度不变 B.混合气体的平均摩尔质量不变
C.
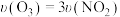 D.混合气体的颜色深浅不变
D.混合气体的颜色深浅不变③温度为
 时,反应的平衡常数
时,反应的平衡常数
(3)对于可逆反应
 ,若起始投料
,若起始投料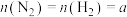 mol,达到平衡后,增大压强,N2的体积分数
mol,达到平衡后,增大压强,N2的体积分数(4)恒容绝热的密闭容器中充入反应物,在一定条件下分别发生四个不同的反应,平衡常数与压强随反应进行变化情况合理,且在高温下能自发进行的是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】生产生活中排放的废气废水有一定量的氨氮化合物,必须通过处理后达到国家规定的排放标准再排放,以下为两种处理氨氮化合物的方法。
Ⅰ.催化氧化法:某学习小组模拟氨气的催化氧化,向恒温恒容密闭容器内充入4mol 和3mol
和3mol ,在加热和催化剂的作用下存在如下反应;
,在加热和催化剂的作用下存在如下反应;
反应①(主);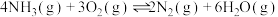
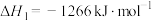
反应②(副):
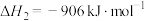
反应③(副):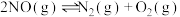

(1)反应③NO在催化剂作用下分解,也是一种消除污染的方法,其 为
为___________  。
。
(2)下列说法正确的是___________ (填标号)。
a.反应①在任何温度下均能自发进行
b.混合气体的密度不变说明体系已达到平衡
c.在实际中,需采用高压氧化,以利于提高 的生成量
的生成量
(3)体系平衡时, 的物质的量为amol,
的物质的量为amol, 的物质的量为bmol。此时,
的物质的量为bmol。此时, 的物质的量为
的物质的量为___________ mol(用含a、b的代数式表示,下同),反应③的平衡常数K=___________ 。
Ⅱ.三维电极法:它是在传统的电解槽两电极之间填充粒状或碎屑状材料,填充的粒子电极表面能带电,成为新的一极(第三极)。如图为用三维电极法处理氨氮废水的原理图,石墨板作为阴、阳极,自制活性炭为填充材料,电解一定浓度的 、
、 与NaCl的酸性混合溶液来进行模拟。
与NaCl的酸性混合溶液来进行模拟。

(4)电解时,阳极的电极反应式为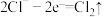 、
、___________ 。
(5)该装置可以生成大量氧化性更强的·OH,写出·OH去除 的离子方程式:
的离子方程式:______________________ 。
(6)相比于传统的二维电极反应系统,三维电极有哪些优点?试述其优点:___________ (答出一种,合理即可)。
Ⅰ.催化氧化法:某学习小组模拟氨气的催化氧化,向恒温恒容密闭容器内充入4mol
 和3mol
和3mol ,在加热和催化剂的作用下存在如下反应;
,在加热和催化剂的作用下存在如下反应;反应①(主);
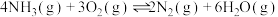
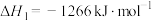
反应②(副):

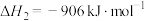
反应③(副):
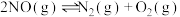

(1)反应③NO在催化剂作用下分解,也是一种消除污染的方法,其
 为
为 。
。(2)下列说法正确的是
a.反应①在任何温度下均能自发进行
b.混合气体的密度不变说明体系已达到平衡
c.在实际中,需采用高压氧化,以利于提高
 的生成量
的生成量(3)体系平衡时,
 的物质的量为amol,
的物质的量为amol, 的物质的量为bmol。此时,
的物质的量为bmol。此时, 的物质的量为
的物质的量为Ⅱ.三维电极法:它是在传统的电解槽两电极之间填充粒状或碎屑状材料,填充的粒子电极表面能带电,成为新的一极(第三极)。如图为用三维电极法处理氨氮废水的原理图,石墨板作为阴、阳极,自制活性炭为填充材料,电解一定浓度的
 、
、 与NaCl的酸性混合溶液来进行模拟。
与NaCl的酸性混合溶液来进行模拟。
(4)电解时,阳极的电极反应式为
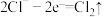 、
、(5)该装置可以生成大量氧化性更强的·OH,写出·OH去除
 的离子方程式:
的离子方程式:(6)相比于传统的二维电极反应系统,三维电极有哪些优点?试述其优点:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】2018年,有的国家退出了《巴定》实工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体 催化合成甲醇技术的工业化量产研究,实现可持续发展。
催化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:
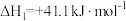
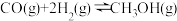
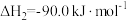
写出 催化合成甲醇蒸气的热化学方程式:
催化合成甲醇蒸气的热化学方程式:_______ 。
(2)某温度时,在恒容密闭容器中由 催化合成
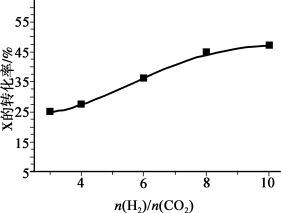
催化合成 。如图为不同投料比[
。如图为不同投料比[ ]时某反应物X平衡转化率变化曲线。反应物X是
]时某反应物X平衡转化率变化曲线。反应物X是_______ (填“ ”或“
”或“ ”),依据是
”),依据是_______ 。
(3)在250℃、体积为2.0L的恒容密闭容器中,加入 、
、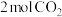 和催化剂,发生
和催化剂,发生 催化氢化合成甲醇的反应。
催化氢化合成甲醇的反应。
①10min时反应达到平衡,测得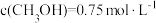 。10min的平均反应速率
。10min的平均反应速率
_______  。平衡常数K=
。平衡常数K=_______ 。
②下列能说明上述反应达到平衡状态的是_______ (填序号)。
A.反应中 与
与 的物质的量浓度之比为1:1
的物质的量浓度之比为1:1
B.混合气体的密度不随时间的变化而变化
C. 的体积分数在混合气体中保持不变
的体积分数在混合气体中保持不变
D.单位时间内消耗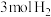 ,消耗
,消耗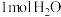
③达平衡时,为了使体系中气体的物质的量减少,可采取的措施有_______ (填序号)。
A.升高温度 B.缩小容器体积 C.再充入 气体 D.使用合适的催化剂
气体 D.使用合适的催化剂
(4)催化剂和反应条件与反应物转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,四组实验数据如下表:
根据上表所给数据,用 生产甲醇的最优选项为
生产甲醇的最优选项为_______ (填实验编号)。
 催化合成甲醇技术的工业化量产研究,实现可持续发展。
催化合成甲醇技术的工业化量产研究,实现可持续发展。(1)已知:

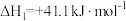
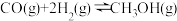
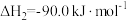
写出
 催化合成甲醇蒸气的热化学方程式:
催化合成甲醇蒸气的热化学方程式:(2)某温度时,在恒容密闭容器中由
 催化合成
催化合成 。如图为不同投料比[
。如图为不同投料比[ ]时某反应物X平衡转化率变化曲线。反应物X是
]时某反应物X平衡转化率变化曲线。反应物X是 ”或“
”或“ ”),依据是
”),依据是
(3)在250℃、体积为2.0L的恒容密闭容器中,加入
 、
、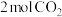 和催化剂,发生
和催化剂,发生 催化氢化合成甲醇的反应。
催化氢化合成甲醇的反应。①10min时反应达到平衡,测得
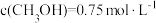 。10min的平均反应速率
。10min的平均反应速率
 。平衡常数K=
。平衡常数K=②下列能说明上述反应达到平衡状态的是
A.反应中
 与
与 的物质的量浓度之比为1:1
的物质的量浓度之比为1:1B.混合气体的密度不随时间的变化而变化
C.
 的体积分数在混合气体中保持不变
的体积分数在混合气体中保持不变D.单位时间内消耗
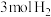 ,消耗
,消耗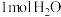
③达平衡时,为了使体系中气体的物质的量减少,可采取的措施有
A.升高温度 B.缩小容器体积 C.再充入
 气体 D.使用合适的催化剂
气体 D.使用合适的催化剂(4)催化剂和反应条件与反应物转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,四组实验数据如下表:
| 实验编号 | 温度(K) | 催化剂 |  转化率(%) 转化率(%) | 甲醇选择性(%) |
| A | 543 | 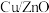 纳米片 纳米片 | 11.9 | 72.7 |
| B | 543 | 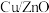 纳米棒 纳米棒 | 12.3 | 42.3 |
| C | 553 | 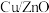 纳米棒 纳米棒 | 15.3 | 39.1 |
| D | 553 | 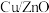 纳米片 纳米片 | 12.0 | 70.6 |
根据上表所给数据,用
 生产甲醇的最优选项为
生产甲醇的最优选项为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】气体之间的反应有其独特的优点,对其研究具有重要意义。
(1)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g) CH3OH(g),CO在不同温度下的平衡转化率(α)与压强的关系如图1所示。
CH3OH(g),CO在不同温度下的平衡转化率(α)与压强的关系如图1所示。
在B点条件下,下列叙述能说明上述反应能达到化学平衡状态的是__ 。
A.H2的消耗速率是CH3OH生成速率的2倍
B. CH3OH的体积分数不再改变
C.混合气体的密度不再改变
D.CO和CH3OH的物质的量之比保持不变
(2)CO(g)+2H2(g) CH3OH(g)在
CH3OH(g)在__ (填“低温”、“高温”或“任意温度”)下能自发进行。
(3)化学平衡常数K(B)、K(C)、K(D)的大小关系是:_ 。
(4)计算图中A点的平衡常数Kp=__ 。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;用P1或P2或P3表示)。
(5)已知NH3(g)+NOx(g)+O2(g) N2(g)+H2O(g)(未配平),为研究NH3选择性催化还原脱硝的反应条件,某科研小组通过一系列实验,得出平衡时的脱硝率与氨氮比的关系[其中NH3/NO2表示氨氮比,O2%表示氧气含量]。
N2(g)+H2O(g)(未配平),为研究NH3选择性催化还原脱硝的反应条件,某科研小组通过一系列实验,得出平衡时的脱硝率与氨氮比的关系[其中NH3/NO2表示氨氮比,O2%表示氧气含量]。
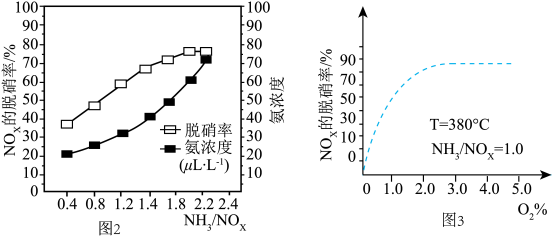 ①图2中,最佳氨氮比为2.0,理由是
①图2中,最佳氨氮比为2.0,理由是__ 。
②请在图3中,用实线画出不使用催化剂情况下(其他条件完全相同)的图示__ 。
(1)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)
 CH3OH(g),CO在不同温度下的平衡转化率(α)与压强的关系如图1所示。
CH3OH(g),CO在不同温度下的平衡转化率(α)与压强的关系如图1所示。
在B点条件下,下列叙述能说明上述反应能达到化学平衡状态的是
A.H2的消耗速率是CH3OH生成速率的2倍
B. CH3OH的体积分数不再改变
C.混合气体的密度不再改变
D.CO和CH3OH的物质的量之比保持不变
(2)CO(g)+2H2(g)
 CH3OH(g)在
CH3OH(g)在(3)化学平衡常数K(B)、K(C)、K(D)的大小关系是:
(4)计算图中A点的平衡常数Kp=
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;用P1或P2或P3表示)。
(5)已知NH3(g)+NOx(g)+O2(g)
 N2(g)+H2O(g)(未配平),为研究NH3选择性催化还原脱硝的反应条件,某科研小组通过一系列实验,得出平衡时的脱硝率与氨氮比的关系[其中NH3/NO2表示氨氮比,O2%表示氧气含量]。
N2(g)+H2O(g)(未配平),为研究NH3选择性催化还原脱硝的反应条件,某科研小组通过一系列实验,得出平衡时的脱硝率与氨氮比的关系[其中NH3/NO2表示氨氮比,O2%表示氧气含量]。 ①图2中,最佳氨氮比为2.0,理由是
①图2中,最佳氨氮比为2.0,理由是②请在图3中,用实线画出不使用催化剂情况下(其他条件完全相同)的图示
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】氨是重要的氮肥,是产量较大的化工产品之一。德国人哈伯因此获得了1918年诺贝尔化学奖。
(1)合成氨工业中采取的下列措施可用勒夏特列原理解释的是___________ 。
A.采用较高压强 B.采用500 ℃的高温
C.用铁触媒作催化剂 D.将生成的氨液化并及时从体系中分离出来
(2)常温下氨气极易溶于水,其水溶液显碱性。请用化学用语 表示氨水显碱性的原因________ 。
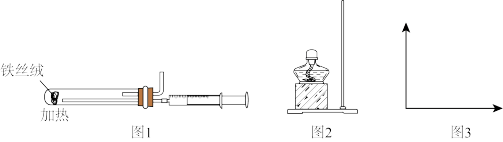
(3)图1是模拟工业合成氨的简易装置,检验有氨气生成的实验操作:______________________ 。
(4)实验室还可利用氯化铵固体和氢氧化钙固体反应制取氨气。请补全图2制氨气的发生装置和收集装置。(夹持装置和药品可以省略)________ 。
(5)依据温度对合成氨反应的影响,在图3坐标系中,画出一定条件下的密闭容器内,从常温下通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。________ 。
(1)合成氨工业中采取的下列措施可用勒夏特列原理解释的是
A.采用较高压强 B.采用500 ℃的高温
C.用铁触媒作催化剂 D.将生成的氨液化并及时从体系中分离出来
(2)常温下氨气极易溶于水,其水溶液显碱性。请用
(3)图1是模拟工业合成氨的简易装置,检验有氨气生成的实验操作:
(4)实验室还可利用氯化铵固体和氢氧化钙固体反应制取氨气。请补全图2制氨气的发生装置和收集装置。(夹持装置和药品可以省略)
(5)依据温度对合成氨反应的影响,在图3坐标系中,画出一定条件下的密闭容器内,从常温下通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】石油化工生产过程中,将石油分馏产物中长链烃的裂解产物进行分离,就可以得到合成纤维工业、塑料工业、橡胶工业等重要的短链烃化工原料。
(1)已知:正丁烷和异丁烷之间转化的能量变化如图1所示。___________ 。
(2)已知: 、
、 、
、 的键能分别为:
的键能分别为: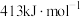 、
、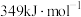 、
、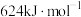 。
。
反应1: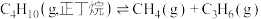

反应2: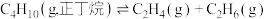

①裂解反应1在___________ (填“高温”、“低温”或“任何温度”)下能自发进行;
②裂解反应2的正反应活化能___________ (填“ ”或“
”或“ ”)逆反应活化能。
”)逆反应活化能。
(3)向密闭容器中投入一定量的正丁烷,发生反应1和反应2,测得正丁烷的平衡转化率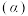 与压强
与压强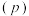 和温度
和温度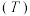 的关系如图2所示。
的关系如图2所示。 、
、 、
、 由大到小的顺序为
由大到小的顺序为___________ 。
②随着温度升高,三种不同压强下正丁烷的平衡转化率趋向相等,原因是___________ 。
(4)温度T°C下,向2L密闭容器中投入正丁烷,同时发生反应1和反应2.6min达到平衡,测得部分物质的浓度与时间的关系如图3所示,平衡时体系的压强为51MPa。
①0~6min内,利用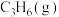 表示的平均反应速率为
表示的平均反应速率为___________  。
。
②7min时改变的条件可能是___________ (填字母)。
A.缩小容器的体积 B.降低温度 C.增大正丁烷的浓度 D.加入催化剂
③温度T°C下,反应2的分压平衡常数
___________ MPa。
(1)已知:正丁烷和异丁烷之间转化的能量变化如图1所示。

(2)已知:
 、
、 、
、 的键能分别为:
的键能分别为: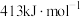 、
、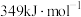 、
、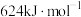 。
。反应1:
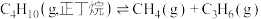

反应2:
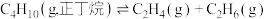

①裂解反应1在
②裂解反应2的正反应活化能
 ”或“
”或“ ”)逆反应活化能。
”)逆反应活化能。(3)向密闭容器中投入一定量的正丁烷,发生反应1和反应2,测得正丁烷的平衡转化率
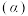 与压强
与压强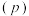 和温度
和温度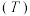 的关系如图2所示。
的关系如图2所示。
 、
、 、
、 由大到小的顺序为
由大到小的顺序为②随着温度升高,三种不同压强下正丁烷的平衡转化率趋向相等,原因是
(4)温度T°C下,向2L密闭容器中投入正丁烷,同时发生反应1和反应2.6min达到平衡,测得部分物质的浓度与时间的关系如图3所示,平衡时体系的压强为51MPa。

①0~6min内,利用
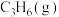 表示的平均反应速率为
表示的平均反应速率为 。
。②7min时改变的条件可能是
A.缩小容器的体积 B.降低温度 C.增大正丁烷的浓度 D.加入催化剂
③温度T°C下,反应2的分压平衡常数

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】Ⅰ.分别取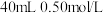 盐酸与
盐酸与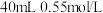 氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热
氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热 。请回答下列问题:
。请回答下列问题:
(1)本实验除烧杯、量筒、温度计外还缺少的玻璃仪器名称为________ 。
(2)若某同学通过该实验测定出中和热 偏大,请分析可能的原因是
偏大,请分析可能的原因是________ (填序号)。
A.用量筒量取盐酸时仰视读数
B.分多次将NaOH溶液倒入盛有盐酸的小烧杯中
C.将盐酸错取为等浓度的醋酸
Ⅱ.为探究化学反应速率的影响因素,设计的实验方案如下表:(已知 溶液、
溶液、 溶液、淀粉三种溶液混合,无明显现象,滴入溶液后溶液变蓝)
溶液、淀粉三种溶液混合,无明显现象,滴入溶液后溶液变蓝)
(3)写出混合溶液中滴入H2O2溶液反应的离子方程式为___________ 。
(4)表中的V=___________ mL,t1、t2、t3由小到大的顺序为___________ 。
(5)某同学研究浓度对化学平衡的影响。他向5mL 0.1mol/L K2Cr2O7溶液中加入1mL 5mol/L NaOH溶液溶液颜色变化为___________ [ (橙色) + H2O
(橙色) + H2O  2H+ + 2
2H+ + 2 (黄色)]。
(黄色)]。
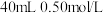 盐酸与
盐酸与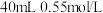 氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热
氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热 。请回答下列问题:
。请回答下列问题:(1)本实验除烧杯、量筒、温度计外还缺少的玻璃仪器名称为
(2)若某同学通过该实验测定出中和热
 偏大,请分析可能的原因是
偏大,请分析可能的原因是A.用量筒量取盐酸时仰视读数
B.分多次将NaOH溶液倒入盛有盐酸的小烧杯中
C.将盐酸错取为等浓度的醋酸
Ⅱ.为探究化学反应速率的影响因素,设计的实验方案如下表:(已知
 溶液、
溶液、 溶液、淀粉三种溶液混合,无明显现象,滴入溶液后溶液变蓝)
溶液、淀粉三种溶液混合,无明显现象,滴入溶液后溶液变蓝)| 向烧杯中加入的试剂及用量/mL | |||||||
| 0.1mol/L KI溶液 | 0.1mol/L H2O2溶液 | 0.1mol/L H2SO4溶液 | 淀粉溶液 | H2O | 时间/s | ||
| ① | 25℃ | 20.0 | 10.0 | 5.0 | 1.0 | 0.0 | t1 |
| ② | 40℃ | 20.0 | 10.0 | 5.0 | 1.0 | 0.0 | t2 |
| ③ | 25℃ | 20.0 | 5.0 | 5.0 | 1.0 | V | t3 |
(4)表中的V=
(5)某同学研究浓度对化学平衡的影响。他向5mL 0.1mol/L K2Cr2O7溶液中加入1mL 5mol/L NaOH溶液溶液颜色变化为
 (橙色) + H2O
(橙色) + H2O  2H+ + 2
2H+ + 2 (黄色)]。
(黄色)]。
您最近一年使用:0次
【推荐3】尿素是一种适用于各种土壤和植物的有机态氮肥,是首个由无机物人工合成的有机物。以 等为原料合成尿素能回收利用二氧化碳,实现碳的固定。按要求回答下列问题。
等为原料合成尿素能回收利用二氧化碳,实现碳的固定。按要求回答下列问题。
(1)1828年,德国化学家维勒使用无机物质氰酸银(AgCNO)与 在一定条件下反应制得
在一定条件下反应制得 。
。
①该反应的化学方程式是___________ 。
② 晶体中含有的化学键有
晶体中含有的化学键有___________ (填序号)。
A.离子键 B.共价键 C.金属键 D.配位键 E.氢键
(2) 和
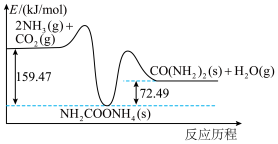
和 合成尿素
合成尿素 的能量变化如图所示,写出该反应的热化学方程式:
的能量变化如图所示,写出该反应的热化学方程式:___________ 。
(3)在恒容密闭容器中发生反应: ,下列能说明该反应达到平衡状态的是___________(填序号)。
,下列能说明该反应达到平衡状态的是___________(填序号)。
(4)在恒容密闭容器中发生反应: ,测得
,测得 的平衡转化率与起始投料比[
的平衡转化率与起始投料比[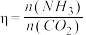 ,
, 分别为1∶1、2∶1、3∶1]和温度关系如图所示。
分别为1∶1、2∶1、3∶1]和温度关系如图所示。
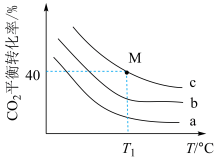
①曲线a代表的投料比为___________ ;
②若 ℃下,从反应开始至达到M点历时5min,测得M点对应的总压强为140kPa,则0~5min内,
℃下,从反应开始至达到M点历时5min,测得M点对应的总压强为140kPa,则0~5min内, 分压的平均变化率为
分压的平均变化率为___________  ,M点对应条件下的分压平衡常数为
,M点对应条件下的分压平衡常数为___________  (列出计算式即可)。
(列出计算式即可)。
 等为原料合成尿素能回收利用二氧化碳,实现碳的固定。按要求回答下列问题。
等为原料合成尿素能回收利用二氧化碳,实现碳的固定。按要求回答下列问题。(1)1828年,德国化学家维勒使用无机物质氰酸银(AgCNO)与
 在一定条件下反应制得
在一定条件下反应制得 。
。①该反应的化学方程式是
②
 晶体中含有的化学键有
晶体中含有的化学键有A.离子键 B.共价键 C.金属键 D.配位键 E.氢键
(2)
 和
和 合成尿素
合成尿素 的能量变化如图所示,写出该反应的热化学方程式:
的能量变化如图所示,写出该反应的热化学方程式:
(3)在恒容密闭容器中发生反应:
 ,下列能说明该反应达到平衡状态的是___________(填序号)。
,下列能说明该反应达到平衡状态的是___________(填序号)。A.单位时间内每消耗44g ,同时生成18g ,同时生成18g |
| B.容器中混合气体平均摩尔质量不变 |
C.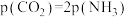 |
D. 的分压保持不变 的分压保持不变 |
(4)在恒容密闭容器中发生反应:
 ,测得
,测得 的平衡转化率与起始投料比[
的平衡转化率与起始投料比[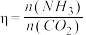 ,
, 分别为1∶1、2∶1、3∶1]和温度关系如图所示。
分别为1∶1、2∶1、3∶1]和温度关系如图所示。
①曲线a代表的投料比为
②若
 ℃下,从反应开始至达到M点历时5min,测得M点对应的总压强为140kPa,则0~5min内,
℃下,从反应开始至达到M点历时5min,测得M点对应的总压强为140kPa,则0~5min内, 分压的平均变化率为
分压的平均变化率为 ,M点对应条件下的分压平衡常数为
,M点对应条件下的分压平衡常数为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次



