高熵合金通常被定义为含有5种以上主要元素的固溶体,每种元素的摩尔比为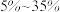 。这个概念已经扩展到创造熵稳定的功能材料中。此类材料有熵稳定高熵功能材料(
。这个概念已经扩展到创造熵稳定的功能材料中。此类材料有熵稳定高熵功能材料(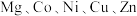 的氧化物),以及尖晶石、碳化物和硅化物等。根据所学知识回答下列问题:
的氧化物),以及尖晶石、碳化物和硅化物等。根据所学知识回答下列问题:
(1)基态 原子的价电子排布式为
原子的价电子排布式为_______ ,有_______ 个未成对电子。
(2)镍及其化合物常用作有机合成的催化剂,如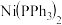 (
( 表示苯基),在该化合物中,配体的空间构型为
表示苯基),在该化合物中,配体的空间构型为_______ ;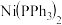 晶体中存在的化学键类型有
晶体中存在的化学键类型有_______ (填标号)。
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(3)尖晶石是镁铝氧化物组成的矿物,含有铁、锌、锰等元素。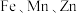 三种元素的第一电离能由大到小的顺序为
三种元素的第一电离能由大到小的顺序为_______ 。
(4)已知: 是强还原剂,与水反应能生成
是强还原剂,与水反应能生成 ,
, 中含有
中含有 键与
键与 键的数目之比为
键的数目之比为_______ ,该离子中C的杂化方式为_______ 。
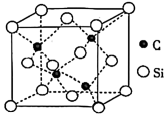
(5)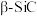 的晶胞结构如图所示,若碳和硅的原子半径分别为
的晶胞结构如图所示,若碳和硅的原子半径分别为 和
和 ,密度为
,密度为 ,其原子的空间利用率(即晶胞中原子体积占空间体积的百分率)为
,其原子的空间利用率(即晶胞中原子体积占空间体积的百分率)为_______ (用含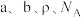 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
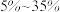 。这个概念已经扩展到创造熵稳定的功能材料中。此类材料有熵稳定高熵功能材料(
。这个概念已经扩展到创造熵稳定的功能材料中。此类材料有熵稳定高熵功能材料(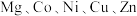 的氧化物),以及尖晶石、碳化物和硅化物等。根据所学知识回答下列问题:
的氧化物),以及尖晶石、碳化物和硅化物等。根据所学知识回答下列问题:(1)基态
 原子的价电子排布式为
原子的价电子排布式为(2)镍及其化合物常用作有机合成的催化剂,如
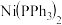 (
( 表示苯基),在该化合物中,配体的空间构型为
表示苯基),在该化合物中,配体的空间构型为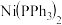 晶体中存在的化学键类型有
晶体中存在的化学键类型有A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键 F.氢键
(3)尖晶石是镁铝氧化物组成的矿物,含有铁、锌、锰等元素。
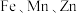 三种元素的第一电离能由大到小的顺序为
三种元素的第一电离能由大到小的顺序为(4)已知:
 是强还原剂,与水反应能生成
是强还原剂,与水反应能生成 ,
, 中含有
中含有 键与
键与 键的数目之比为
键的数目之比为(5)
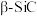 的晶胞结构如图所示,若碳和硅的原子半径分别为
的晶胞结构如图所示,若碳和硅的原子半径分别为 和
和 ,密度为
,密度为 ,其原子的空间利用率(即晶胞中原子体积占空间体积的百分率)为
,其原子的空间利用率(即晶胞中原子体积占空间体积的百分率)为 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
2021·河北沧州·三模 查看更多[4]
河北省沧州市2021届高考第三次模拟考试化学试题湖南省重点中学2020-2021学年高二下学期5月份联合考试化学试题(已下线)专题十一 能力提升检测卷 (测) — 2022年高考化学一轮复习讲练测(新教材新高考)内蒙古自治区赤峰第四中学200-2021学年高三下学期五月月考理综试题
更新时间:2021-05-28 12:36:15
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】已知A、B、C、D、E为第二至第四周期的元素,其原子序数依次增大。A原子最外层电子数是其内层电子总数的2倍,B原子s轨道上的电子数与p轨道上的电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的。请回答下列问题:
(1)基态E原子的价电子排布式为____ 。
(2)A和B中,第一电离能较大的是___ (填元素符号);B的简单氢化物的立体构型是__ ,中心原子的杂化类型是___ 。
(3)A22-和B22+互为等电子体,B22+的电子式可表示为____ ,1 mol B22+中含有的π键数目为____ 。
(4)用氢键表示式写出C的氢化物水溶液中存在的所有氢键_______________ 。
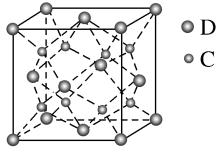
(5)化合物DC2的晶胞结构如图所示,该离子化合物晶体的密度为a g·cm-3,则晶胞的体积是_____ cm3(只要求列算式,阿伏加 德罗常数的值为NA)。
(1)基态E原子的价电子排布式为
(2)A和B中,第一电离能较大的是
(3)A22-和B22+互为等电子体,B22+的电子式可表示为
(4)用氢键表示式写出C的氢化物水溶液中存在的所有氢键
(5)化合物DC2的晶胞结构如图所示,该离子化合物晶体的密度为a g·cm-3,则晶胞的体积是

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1。元素Y基态原子的3p轨道上有5个电子。元素Z的原子最外层电子数是其内层的3倍。元素W基态原子核外电子共有16种运动状态。
⑴①在元素周期表中,元素Y位于第___________ 周期第___________ 族,元素X位于___________ 区;
②Z所在周期中,第一电离能最大的元素是___________ ;(填元素名称)
③X+的核外电子排布式为___________ ;与X同一周期的副族元素的基态原子中最外层电子数与铜原子相同的元素有___________ (填元素符号)
④Y和W两元素所形成的最高价氧化物对应的水化物酸性较强的是___________ (填化学式)
⑵X与Y所形成化合物晶体的晶胞如图所示。
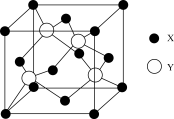
①在1个晶胞中,X离子的数目为___________
②该化合物的化学式为___________
⑶X与W的最高价含氧酸的浓溶液反应的化学方程式为___________
⑷①在乙醇中的溶解度:Z的氢化物(H2Z)大于H2W,其主要原因是___________
②稳定性:H2Z___________ H2W(填“<”、“>”或“=”),其主要原因是___________
⑴①在元素周期表中,元素Y位于第
②Z所在周期中,第一电离能最大的元素是
③X+的核外电子排布式为
④Y和W两元素所形成的最高价氧化物对应的水化物酸性较强的是
⑵X与Y所形成化合物晶体的晶胞如图所示。

①在1个晶胞中,X离子的数目为
②该化合物的化学式为
⑶X与W的最高价含氧酸的浓溶液反应的化学方程式为
⑷①在乙醇中的溶解度:Z的氢化物(H2Z)大于H2W,其主要原因是
②稳定性:H2Z
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】我国提出争取在2030年前实现碳达峰,2060年前实现碳中和(指 的排放总量和减少总量相当),这对于改善环境、实现绿色发展至关重要。某科研小组探究
的排放总量和减少总量相当),这对于改善环境、实现绿色发展至关重要。某科研小组探究 转化为甲醛等其他物质的途径,其中涉及以下两步反应:
转化为甲醛等其他物质的途径,其中涉及以下两步反应:
i、 ;
;
ii、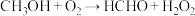 。
。
研究发现,反应i在Co氧化物负载的Mn氧化物纳米粒子催化剂的作用下具有高活性,另外含Mg、Fe、Cu等元素的催化剂在捕捉回收 中也有很高的催化作用。
中也有很高的催化作用。
(1)Mn元素基态原子的价层电子排布式为___________ ,Fe元素在元素周期表中位于第四周期第___________ 族。
(2)Mg元素的第一电离能高于Al元素的,原因是___________ 。
(3)反应ii中,HCHO分子中C原子采用的杂化方式为___________ ;下列关于 的说法错误的是
的说法错误的是___________ (填标号)。
A.含 键B.含
键B.含 键C.含极性共价键D.含非极性共价键E.分子的空间结构为直线形
键C.含极性共价键D.含非极性共价键E.分子的空间结构为直线形
(4)反应i和反应ii所涉及的4种含氢化合物中,沸点从高到低的顺序为___________ (填化学),原因是___________ 。
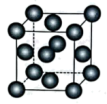
(5)铜单质的晶胞结构如图所示,铜原子位于正方体的顶点和面心。已知铜原子的半径为d,铜单质的摩尔质量为M, 表示阿伏加德罗常数的值。则铜原子的配位数为
表示阿伏加德罗常数的值。则铜原子的配位数为___________ ,铜晶体的密度为___________ (填含M、 、d的表达式)。
、d的表达式)。
 的排放总量和减少总量相当),这对于改善环境、实现绿色发展至关重要。某科研小组探究
的排放总量和减少总量相当),这对于改善环境、实现绿色发展至关重要。某科研小组探究 转化为甲醛等其他物质的途径,其中涉及以下两步反应:
转化为甲醛等其他物质的途径,其中涉及以下两步反应:i、
 ;
;ii、
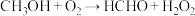 。
。研究发现,反应i在Co氧化物负载的Mn氧化物纳米粒子催化剂的作用下具有高活性,另外含Mg、Fe、Cu等元素的催化剂在捕捉回收
 中也有很高的催化作用。
中也有很高的催化作用。(1)Mn元素基态原子的价层电子排布式为
(2)Mg元素的第一电离能高于Al元素的,原因是
(3)反应ii中,HCHO分子中C原子采用的杂化方式为
 的说法错误的是
的说法错误的是A.含
 键B.含
键B.含 键C.含极性共价键D.含非极性共价键E.分子的空间结构为直线形
键C.含极性共价键D.含非极性共价键E.分子的空间结构为直线形(4)反应i和反应ii所涉及的4种含氢化合物中,沸点从高到低的顺序为
(5)铜单质的晶胞结构如图所示,铜原子位于正方体的顶点和面心。已知铜原子的半径为d,铜单质的摩尔质量为M,
 表示阿伏加德罗常数的值。则铜原子的配位数为
表示阿伏加德罗常数的值。则铜原子的配位数为 、d的表达式)。
、d的表达式)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】UO2与铀氮化物是重要的核燃料,已知:3(NH4)4[UO2(CO3)3] 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
回答下列问题:
(1)基态氮原子价电子排布图为______ 。
(2)反应所得气态化合物中属于非极性分子的是_______ (填化学式)。
(3)某种铀氮化物的晶体结构是NaCl型。NaCl的Bom-Haber循环如图所示。已知:元素的一个气态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是________ (填标号)。
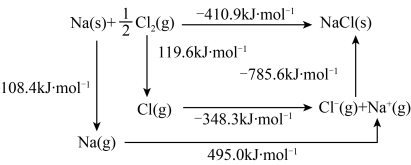
a.Cl-Cl键的键能为119.6kJ/mol b.Na的第一电离能为603.4kJ/mol
c.NaCl的晶格能为785.6kJ/mol d.Cl的第一电子亲和能为348.3kJ/mol
(4)依据VSEPR理论推测CO32-的空间构型为_________ 。分子中的大丌键可用符号 表示,其中m代表参与形成大丌键的原子数,n代表参与形成大丌键的电子数(如苯分子中的大
表示,其中m代表参与形成大丌键的原子数,n代表参与形成大丌键的电子数(如苯分子中的大 键可表示为
键可表示为 ),则CO32-中的大丌键应表示为
),则CO32-中的大丌键应表示为_____
(5)UO2可用于制备UF4:2UO2+5NH4HF2 2UF4·2NH4F+3NH3↑+4H2O,其中HF2的结构表示为[F—H…F]-,反应中断裂的化学键有
2UF4·2NH4F+3NH3↑+4H2O,其中HF2的结构表示为[F—H…F]-,反应中断裂的化学键有_______ (填标号)。
a.氢键 b.极性键 c.离子键 d.金属键 e.非极性键
(6)铀氮化物的某两种晶胞如图所示:
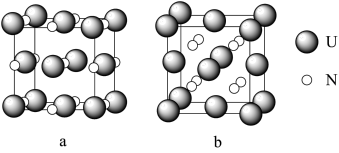
①晶胞a中铀元素的化合价为__________ ,与U距离相等且最近的U有_______ 个。
②已知晶胞b的密度为dg/cm3,U原子的半径为r1cm,N原子的半径为为r2cm,设NA为阿伏加 德罗常数的值,则该晶胞的空间利用率为___________ (列出计算式)。
 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑回答下列问题:
(1)基态氮原子价电子排布图为
(2)反应所得气态化合物中属于非极性分子的是
(3)某种铀氮化物的晶体结构是NaCl型。NaCl的Bom-Haber循环如图所示。已知:元素的一个气态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是

a.Cl-Cl键的键能为119.6kJ/mol b.Na的第一电离能为603.4kJ/mol
c.NaCl的晶格能为785.6kJ/mol d.Cl的第一电子亲和能为348.3kJ/mol
(4)依据VSEPR理论推测CO32-的空间构型为
 表示,其中m代表参与形成大丌键的原子数,n代表参与形成大丌键的电子数(如苯分子中的大
表示,其中m代表参与形成大丌键的原子数,n代表参与形成大丌键的电子数(如苯分子中的大 键可表示为
键可表示为 ),则CO32-中的大丌键应表示为
),则CO32-中的大丌键应表示为(5)UO2可用于制备UF4:2UO2+5NH4HF2
 2UF4·2NH4F+3NH3↑+4H2O,其中HF2的结构表示为[F—H…F]-,反应中断裂的化学键有
2UF4·2NH4F+3NH3↑+4H2O,其中HF2的结构表示为[F—H…F]-,反应中断裂的化学键有a.氢键 b.极性键 c.离子键 d.金属键 e.非极性键
(6)铀氮化物的某两种晶胞如图所示:

①晶胞a中铀元素的化合价为
②已知晶胞b的密度为dg/cm3,U原子的半径为r1cm,N原子的半径为为r2cm,设NA为阿伏加 德罗常数的值,则该晶胞的空间利用率为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】氮化硼(BN)是一种重要的功能陶瓷材料,以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:

请回答下列问题:
(1)写出由B2O3制备BF3的化学方程式_________ ;
(2)基态N原子的轨道表示式为_______ ,BN中B元素的化合价为________ ;
(3)在BF3分子中,F-B-F的键角是_______ ,该分子为_______ (填“极性分子”或“非极性分子”),BF3和过量NaF作用可生成NaBF4,BF4-的空间构型为_______ ;
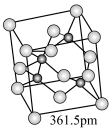
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似(如图所示),硬度与金刚石相当,晶胞边长为361.5pm(1pm=10-10cm),立方氮化硼的密度是________ g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
(5)原子个数相同、最外层电子总数也相同的化合物是“等电子体”,等电子体的结构相似,B3N3H6与苯是等电子体,被称为“无机苯”,请画出B3N3H6的结构式________ ,其二氯代物有________ 种。

请回答下列问题:
(1)写出由B2O3制备BF3的化学方程式
(2)基态N原子的轨道表示式为
(3)在BF3分子中,F-B-F的键角是
(4)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似(如图所示),硬度与金刚石相当,晶胞边长为361.5pm(1pm=10-10cm),立方氮化硼的密度是

(5)原子个数相同、最外层电子总数也相同的化合物是“等电子体”,等电子体的结构相似,B3N3H6与苯是等电子体,被称为“无机苯”,请画出B3N3H6的结构式
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】X、Y、T、Q 四种元素,位于元素周期表前四周期,元素的性质或结构信息如下.
①X 单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼;
②Y 二价阳离子的外围电子层排列为3d9;
③T原子核外s轨道电子总数等于p轨道电子总数;人体内含量最多的元素,且其单质是常见的助燃剂;
④Q 第三周期主族元素中原子半径最小。
请根据上述信息回答下列问题:
(1)写出 X3﹣的一种等电子体的化学式__ ; X的气态氢化物易液化的原因是:__ .
(2)写出T元素基态原子的核外电子排布式__ ;Q元素的原子核外有__ 种运动状态不同的电子.
(3)元素 X、T 的电负性相比,__ 的小(填元素名称);元素X的第一电离能与T相比较,T的__ (填“大”或“小”).
(4)Y元素在周期表中位于__ 区.Y单质晶体的晶胞中实际拥有__ 个原子,该晶体中Y原子在三维空间的堆积方式为__ 堆积.CaO与NaCl的晶胞同为面心立方结构,已知CaO晶体密度为ag•cm﹣3,NA表示阿伏伽德罗常数,则CaO晶胞体积为__ cm3.
(5)在硫酸铜溶液中通入X的气态氢化物至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液.此蓝色沉淀溶解的离子方程式为:__ .
(6)元素X与Q可形成化合物XQ3,根据价层电子对互斥理论判断XQ3的空间构型为:__ ,分子中X原子的杂化方式为__ 杂化.
①X 单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼;
②Y 二价阳离子的外围电子层排列为3d9;
③T原子核外s轨道电子总数等于p轨道电子总数;人体内含量最多的元素,且其单质是常见的助燃剂;
④Q 第三周期主族元素中原子半径最小。
请根据上述信息回答下列问题:
(1)写出 X3﹣的一种等电子体的化学式
(2)写出T元素基态原子的核外电子排布式
(3)元素 X、T 的电负性相比,
(4)Y元素在周期表中位于
(5)在硫酸铜溶液中通入X的气态氢化物至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液.此蓝色沉淀溶解的离子方程式为:
(6)元素X与Q可形成化合物XQ3,根据价层电子对互斥理论判断XQ3的空间构型为:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】利用绿矾 和硫铁矿
和硫铁矿 可联合制备铁精粉
可联合制备铁精粉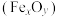 和硫酸。
和硫酸。
(1) 的结构示意图如图所示。
的结构示意图如图所示。___________ 。
② 中O原子和
中O原子和 中S原子均为
中S原子均为 杂化。
杂化。 分子中的
分子中的 键角
键角___________ (填“大于”、“等于”或“小于”)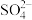 离子中
离子中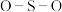 键角,其原因是
键角,其原因是___________ 。
③ 属于配位化合物。由结构示意图可知,
属于配位化合物。由结构示意图可知, 中
中 的配位数为
的配位数为___________ 。
(2) 晶体的晶胞形状为立方体,边长为
晶体的晶胞形状为立方体,边长为 ,结构如图所示。
,结构如图所示。 的电子式为
的电子式为___________ 。
② 晶体中
晶体中 位于
位于 形成的
形成的___________ (填“正四面体”或“正八面体”)空隙中。
③ 的摩尔质量为
的摩尔质量为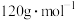 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。该晶体的密度为
。该晶体的密度为___________  。(列出算式即可,无需化简。
。(列出算式即可,无需化简。 )
)
 和硫铁矿
和硫铁矿 可联合制备铁精粉
可联合制备铁精粉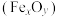 和硫酸。
和硫酸。(1)
 的结构示意图如图所示。
的结构示意图如图所示。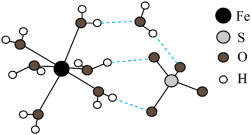
②
 中O原子和
中O原子和 中S原子均为
中S原子均为 杂化。
杂化。 分子中的
分子中的 键角
键角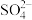 离子中
离子中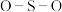 键角,其原因是
键角,其原因是③
 属于配位化合物。由结构示意图可知,
属于配位化合物。由结构示意图可知, 中
中 的配位数为
的配位数为(2)
 晶体的晶胞形状为立方体,边长为
晶体的晶胞形状为立方体,边长为 ,结构如图所示。
,结构如图所示。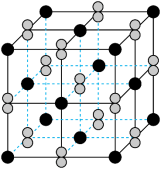
 的电子式为
的电子式为②
 晶体中
晶体中 位于
位于 形成的
形成的③
 的摩尔质量为
的摩尔质量为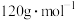 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。该晶体的密度为
。该晶体的密度为 。(列出算式即可,无需化简。
。(列出算式即可,无需化简。 )
)
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】Cu2+能与NH3、H2O、OH-、Cl-等形成配位数为4的配合物。
(1)向CuSO4溶液中加入过量 溶液可生成Na2[Cu(OH)4]。
溶液可生成Na2[Cu(OH)4]。
①画出配离子[Cu(OH)4]2-中的配位键:_______ ;
②Na2[Cu(OH)4]中除了配位键外,还存在的化学键类型有_______ (填序号);
a.离子键 b.金属键 C.极性共价键 d.非极性共价键
(2)金属铜单独与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生反应,反应的离子方程式为_______ ;
(3)Cu2+可以与乙二胺(H2NCH2CH2NH2)形成配离子,如下图:
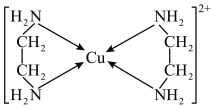
①H、O、N三种元素的电负性从大到小的顺序为_______ ;
②乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮原子的杂化类型是_______ ,
乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其中与乙二胺形成的化合物稳定性相对较高的是_______ (填“Mg2+”或“Cu2+”);
③乙二胺和三甲胺{ [N(CH3)3]}均属于胺,乙二胺的沸点_______ 三甲胺的沸点(填“大于”或“小于”),原因是_______ 。
(1)向CuSO4溶液中加入过量
 溶液可生成Na2[Cu(OH)4]。
溶液可生成Na2[Cu(OH)4]。①画出配离子[Cu(OH)4]2-中的配位键:
②Na2[Cu(OH)4]中除了配位键外,还存在的化学键类型有
a.离子键 b.金属键 C.极性共价键 d.非极性共价键
(2)金属铜单独与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生反应,反应的离子方程式为
(3)Cu2+可以与乙二胺(H2NCH2CH2NH2)形成配离子,如下图:

①H、O、N三种元素的电负性从大到小的顺序为
②乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮原子的杂化类型是
乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其中与乙二胺形成的化合物稳定性相对较高的是
③乙二胺和三甲胺{ [N(CH3)3]}均属于胺,乙二胺的沸点
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】碳、氮、铁三种元素均可以形成一些结构独特、性能特殊的物质。回答下列问题:
(1)基态氮原子能量最高能级的电子云轮廓图为___________ 形;基态碳原子和铁原子所含未成对电子数之比为___________ 。
(2)铁与锰在元素周期表中属于相邻元素,二者电离能(I)如下表。
I3(Mn)>I3(Fe)的主要原因为___________ 。
(3)(CN)2分子中每个原子最外层均为8电子结构,则(CN)2分子中所含σ键与π键数目之比为___________ 。(CN)2的沸点为一21.2 °C,N2的沸点为一195.62 °C,(CN)2的沸点高于N2的原因为______ 。
(4)[Fe(CN)6]3-中化学键的类型为___________ ,配位体中碳原子的杂化方式为___________ 。
(5)铁原子与氮原子形成的一种晶胞如下图所示(白球代表铁原子,黑球代表氮原子)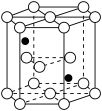 ,该晶体的化学式为
,该晶体的化学式为___________ ,已知该晶体的密度为d g· cm-3,正六棱柱底边边长为x cm,NA为阿伏加德罗常数的值,则该正六棱柱的高为___________ cm(用含x、d、NA的代数式表示,列出计算式即可)。
(1)基态氮原子能量最高能级的电子云轮廓图为
(2)铁与锰在元素周期表中属于相邻元素,二者电离能(I)如下表。
| 元素 | I1/(kJ·mol-1) | I2/(kJ·mol-1) | I3/(kJ·mol-1) |
| 锰 | 717.3 | 1509.9 | 3248 |
| 铁 | 762.5 | 1561.9 | 2 953 |
I3(Mn)>I3(Fe)的主要原因为
(3)(CN)2分子中每个原子最外层均为8电子结构,则(CN)2分子中所含σ键与π键数目之比为
(4)[Fe(CN)6]3-中化学键的类型为
(5)铁原子与氮原子形成的一种晶胞如下图所示(白球代表铁原子,黑球代表氮原子)
 ,该晶体的化学式为
,该晶体的化学式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】钴合金是以铂为基的含钴二元合金,在高温下,铂与钻可无限互熔,其固熔体为面心立方晶格。
(1)Co元素在周期表中属于___________ 区,其基态原子的价电子排布图为___________ 。
(2)二氯二吡啶合铂分子是一种铂配合物,有顺式和反式两种同分异构体(如图)。科学研究表明,顺式分子具有抗癌活性。
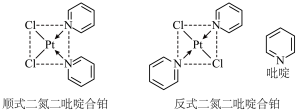
①顺式二氯二吡啶合铂分子中不存在的化学键类型为___________ (填字母)。
A.共价键 B.离子键 C.氢键 D.范德华力 E.配位键
②反式二氯二吡啶合铂分子是___________ 分子(填“极性”或“非极性”)。
③吡啶分子是大体积平面形配体,吡啶中 原子的杂化方式为
原子的杂化方式为___________ ,吡啶分子中与 形成配位键的电子对位于
形成配位键的电子对位于 原子的
原子的___________ 轨道上。
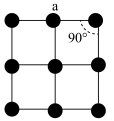
(3)金属铂晶体中,铂原子的配位数为12,其立方晶胞沿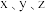 轴的投影图均为如下图所示,若金属铂的密度为
轴的投影图均为如下图所示,若金属铂的密度为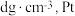 原子的半径为
原子的半径为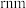 ,则晶胞参数a=
,则晶胞参数a=___________  (用含
(用含 的表达式表示,下同),该堆积方式中的空间利用率为
的表达式表示,下同),该堆积方式中的空间利用率为___________ 。
(1)Co元素在周期表中属于
(2)二氯二吡啶合铂分子是一种铂配合物,有顺式和反式两种同分异构体(如图)。科学研究表明,顺式分子具有抗癌活性。

①顺式二氯二吡啶合铂分子中不存在的化学键类型为
A.共价键 B.离子键 C.氢键 D.范德华力 E.配位键
②反式二氯二吡啶合铂分子是
③吡啶分子是大体积平面形配体,吡啶中
 原子的杂化方式为
原子的杂化方式为 形成配位键的电子对位于
形成配位键的电子对位于 原子的
原子的(3)金属铂晶体中,铂原子的配位数为12,其立方晶胞沿
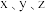 轴的投影图均为如下图所示,若金属铂的密度为
轴的投影图均为如下图所示,若金属铂的密度为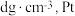 原子的半径为
原子的半径为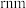 ,则晶胞参数a=
,则晶胞参数a= (用含
(用含 的表达式表示,下同),该堆积方式中的空间利用率为
的表达式表示,下同),该堆积方式中的空间利用率为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】钛及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)基态钛原子的价电子排布式为_____________ ,与钛同周期的元素中,基态原子的未成对电子数与钛相同的有____________ 种。
(2)钛比钢轻、比铝硬,是一种新兴的结构材料,钛的硬度比铝大的原因是_________ 。
(3)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1:5,则该配合离子的化学式为___________ 。
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如图所示。
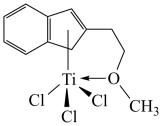
①组成M的元素中,电负性最大的是_________ (填名称)。
②M中碳原子的杂化方式为____________ 。
③M中不含________ (填代号)。
a.π键 b.σ键 c.离子键 d.配位键
(5)金红石(TiO2)是含钛的主要矿物之一。其晶胞结构(晶胞中相同位置的原子相同)如图所示。
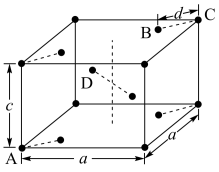
①A、B、C、D4种微粒,其中氧原子是________ (填代号)。
②若A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,____ ,___ );钛氧键的键长d=______ (用代数式表示)。
③若晶胞底边长为a cm,高为c cm,则TiO2晶体的密度为______ g/cm3。
(1)基态钛原子的价电子排布式为
(2)钛比钢轻、比铝硬,是一种新兴的结构材料,钛的硬度比铝大的原因是
(3)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1:5,则该配合离子的化学式为
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如图所示。

①组成M的元素中,电负性最大的是
②M中碳原子的杂化方式为
③M中不含
a.π键 b.σ键 c.离子键 d.配位键
(5)金红石(TiO2)是含钛的主要矿物之一。其晶胞结构(晶胞中相同位置的原子相同)如图所示。

①A、B、C、D4种微粒,其中氧原子是
②若A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,
③若晶胞底边长为a cm,高为c cm,则TiO2晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】某课题组在光子晶体领域取得新进展,成功制备出高质量硫化锌光子晶体。回答下列问题:
(1)基态硫原子的价电子排布图为_________ 。第一电离能介于Al、P之间的第三周期元素有______________ 种。
(2)H2S中S的价层电子对数为__________ ,H2O的键角________ (填“>”“<”或“=”)H2S的键角。
(3)硫酸锌中三种元素的电负性由大到小的顺序为_________ ,硫酸锌溶于氨水可生成[Zn(NH3)4]SO4溶液,1 mol [Zn(NH3)4]SO4中含有σ键的数目为___________ (NA为阿伏加 德罗常数的值)。与SO 互为等电子体的分子有
互为等电子体的分子有____________ (任写一种)。
(4)SO2中S的杂化类型为____________ ,SO3的立体构型为______________ 。
(5)硫化锌的晶胞结构如图所示,该晶胞中与硫原子距离最近且相等的硫原子有______ 个,若该晶胞的密度为ρg/cm3,用NA代表阿伏加 德罗常数的值,则晶胞边长为________ nm。
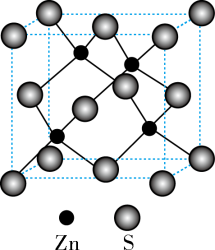
(1)基态硫原子的价电子排布图为
(2)H2S中S的价层电子对数为
(3)硫酸锌中三种元素的电负性由大到小的顺序为
 互为等电子体的分子有
互为等电子体的分子有(4)SO2中S的杂化类型为
(5)硫化锌的晶胞结构如图所示,该晶胞中与硫原子距离最近且相等的硫原子有

您最近一年使用:0次



