国家规定,排放的废水中氟的含量不得超过10.0mg/L,砷的含量不得超过0.5mg/L。硫酸工厂废水中除含有稀硫酸外,还含有H3AsO3、H2SiF6等物质。工业上常通过化学沉淀和氧化、吸附沉降处理废水,实现水体达标排放。
(1)化学沉淀:向废水中加入石灰乳[以Ca(OH)2为主过滤。滤渣中主要含有CaSO4、CaF2、SiO2和少量Ca3(AsO4)2。
①写出该过程中H2SiF6和石灰乳反应生成CaF2、SiO2的化学方程式:___________ 。
②充分沉淀后测得废水中F的含量为9.5mg/L,此时 的浓度为
的浓度为___________ 。[已知:Ksp(CaSO4)=5.0×10-5、Ksp(CaF2)=5.0×10-9]
(2)氧化、吸附沉降:利用NaClO和FeSO4进一步处理废水中残余的As(III)。
已知:i.NaClO能将As(II)氧化为As(V)、Fe(II)氧化为Fe(III)。形成的Fe(OH)3胶体吸附废水中的As(V)物种而沉降。
ii.溶液的pH对Fe(OH)3胶体表面所带电荷有影响。pH>7时,Fe(OH)3胶体表面带负电荷,pH越高,表面所带负电你越多。
iii.As(III)和As(V)水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。
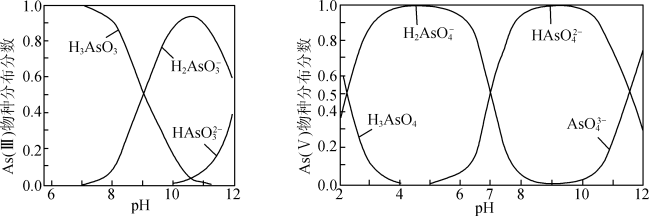
①向化学沉淀后的废水(pH≈8)中加入NaClO溶液,写出As(III)发生主要反应的离子方程式:___________ 。
②其它条件相同的情况下,用以下两种方式向废水样中添加NaClO和FeSO4溶液。
方式I:先加NaClO溶液,再加FeSO4溶液;
方式II:先加FeSO4溶液,再加NaClO溶液。
反应相同时间,测得As(III)的氧化效果方式II不如方式I,原因是___________ 。
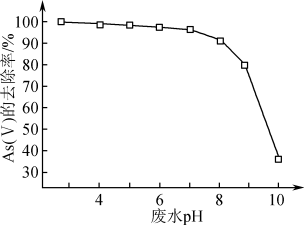
③废水的pH对As(V)的去除率的影响如图所示。pH>8时,随着废水的pH增大,As(V)的去除率发生如图所示变化的原因是___________ 。
(1)化学沉淀:向废水中加入石灰乳[以Ca(OH)2为主过滤。滤渣中主要含有CaSO4、CaF2、SiO2和少量Ca3(AsO4)2。
①写出该过程中H2SiF6和石灰乳反应生成CaF2、SiO2的化学方程式:
②充分沉淀后测得废水中F的含量为9.5mg/L,此时
 的浓度为
的浓度为(2)氧化、吸附沉降:利用NaClO和FeSO4进一步处理废水中残余的As(III)。
已知:i.NaClO能将As(II)氧化为As(V)、Fe(II)氧化为Fe(III)。形成的Fe(OH)3胶体吸附废水中的As(V)物种而沉降。
ii.溶液的pH对Fe(OH)3胶体表面所带电荷有影响。pH>7时,Fe(OH)3胶体表面带负电荷,pH越高,表面所带负电你越多。
iii.As(III)和As(V)水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。

①向化学沉淀后的废水(pH≈8)中加入NaClO溶液,写出As(III)发生主要反应的离子方程式:
②其它条件相同的情况下,用以下两种方式向废水样中添加NaClO和FeSO4溶液。
方式I:先加NaClO溶液,再加FeSO4溶液;
方式II:先加FeSO4溶液,再加NaClO溶液。
反应相同时间,测得As(III)的氧化效果方式II不如方式I,原因是
③废水的pH对As(V)的去除率的影响如图所示。pH>8时,随着废水的pH增大,As(V)的去除率发生如图所示变化的原因是

更新时间:2021-05-29 13:27:19
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
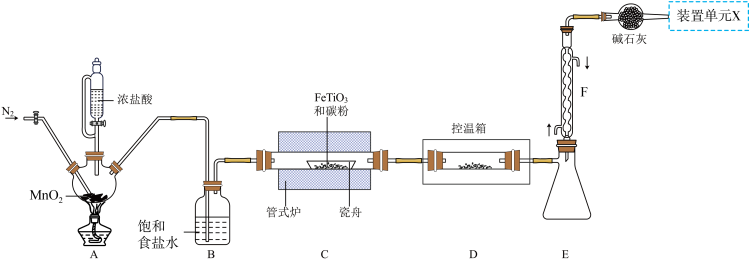
【推荐1】某小组利用如图所示装置制备并收集TiCl4(夹持装置略去),并测定由TiCl4制备的纳米xTiO2•yH2O的组成。
已知:
I. TiCl4高温时能与O2反应,极易水解,能溶于CCl4;
Ⅱ.瓷舟中主反应生成TiCl4、FeCl3(容易二聚成Fe2Cl6)和一种氧化物(有毒气体),还有少量副产物CCL4;
Ⅲ.相关物质的熔沸点如表:
(1)TiCl4摩尔质量大于FeCl3,但沸点却低于FeCl3的原因是_______ 。
(2)写出A中反应的化学方程式_______ ;上述装置存在一处缺陷,会导致TiCl4产率降低,改进的方法是_______ 。
(3)将管式炉加热至900℃时,瓷舟中主要反应的化学方程式为_______ 。
(4)装置E、F的作用为_______ 。
(5)设计实验测定纳米xTiO2•yH2O组成。
已知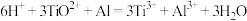 ,
,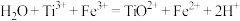
(可选试剂:水、稀硫酸、稀硝酸、氢氧化钠溶液、Al粉、0.1000 的NH4Fe(SO4)2标准溶液、硫氰化钾溶液、铁氰化钾溶液)
的NH4Fe(SO4)2标准溶液、硫氰化钾溶液、铁氰化钾溶液)
①取样称重:称取4.675g样品。②酸溶:用足量稀硫酸溶解。
③还原:加入过量Al粉还原至Al粉不再溶解,过滤取滤液定容。定容为500mL,取20.00mL。
④滴定:用0.1000 的NH4Fe(SO4)2标准溶液滴定,标准溶液装在
的NH4Fe(SO4)2标准溶液滴定,标准溶液装在_______ 滴定管(填“酸式”、“碱式”),用_______ 做指示剂,平均消耗标准溶液20.00mL,则xTiO2•yH2O的化学式为_______ 。

已知:
I. TiCl4高温时能与O2反应,极易水解,能溶于CCl4;
Ⅱ.瓷舟中主反应生成TiCl4、FeCl3(容易二聚成Fe2Cl6)和一种氧化物(有毒气体),还有少量副产物CCL4;
Ⅲ.相关物质的熔沸点如表:
TiCl4 | FeCl3 | CCl4 | |
熔点/℃ |
| 306 |
|
沸点/℃ | 136.4 | 315 | 76.8 |
(1)TiCl4摩尔质量大于FeCl3,但沸点却低于FeCl3的原因是
(2)写出A中反应的化学方程式
(3)将管式炉加热至900℃时,瓷舟中主要反应的化学方程式为
(4)装置E、F的作用为
(5)设计实验测定纳米xTiO2•yH2O组成。
已知
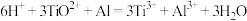 ,
,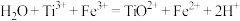
(可选试剂:水、稀硫酸、稀硝酸、氢氧化钠溶液、Al粉、0.1000
 的NH4Fe(SO4)2标准溶液、硫氰化钾溶液、铁氰化钾溶液)
的NH4Fe(SO4)2标准溶液、硫氰化钾溶液、铁氰化钾溶液)①取样称重:称取4.675g样品。②酸溶:用足量稀硫酸溶解。
③还原:加入过量Al粉还原至Al粉不再溶解,过滤取滤液定容。定容为500mL,取20.00mL。
④滴定:用0.1000
 的NH4Fe(SO4)2标准溶液滴定,标准溶液装在
的NH4Fe(SO4)2标准溶液滴定,标准溶液装在
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】废镍催化剂主要含Ni,还有少量Cu、Fe、Al及其氧化物、 。某研究性学习小组设计如图所示工艺流程回收镍,制备硫酸镍晶体(
。某研究性学习小组设计如图所示工艺流程回收镍,制备硫酸镍晶体( )。
)。
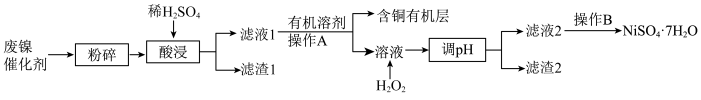
该小组同学查阅资料知:
①镍的化学性质与铁相似,能与酸缓慢反应。
②常温下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
(1)废镍催化剂“粉碎”的目的是___________ 。
(2)滤渣2的成分是___________ (用化学式表示)。
(3)“溶液中加入 的目的是
的目的是___________ (用离子方程式表示);该温度下, 的溶度积常数
的溶度积常数 是
是___________ 。
(4)下列物质调浴液pH,最好选用___________ (填序号)。
a.氨水 b. c.稀
c.稀 d.
d.
若调pH前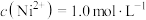 ,
, 和
和 浓度均为0.01mol/L,则“调pH”需控制浴液pH的范围为
浓度均为0.01mol/L,则“调pH”需控制浴液pH的范围为___________ 。
(5) 易水解,海水中提取镁有类似B的操作,如从
易水解,海水中提取镁有类似B的操作,如从 溶液中获得溶质
溶液中获得溶质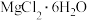 晶体需要在
晶体需要在___________ 气流氛围中,进行___________ 、过滤、洗涤、干燥等操作。
 。某研究性学习小组设计如图所示工艺流程回收镍,制备硫酸镍晶体(
。某研究性学习小组设计如图所示工艺流程回收镍,制备硫酸镍晶体( )。
)。
该小组同学查阅资料知:
①镍的化学性质与铁相似,能与酸缓慢反应。
②常温下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |
开始沉淀时(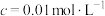 )的pH )的pH | 7.2 | 3.7 | 2.2 | 7.5 |
沉淀完全时( )的pH )的pH | 8.7 | 4.7 | 3.2 | 9.0 |
(2)滤渣2的成分是
(3)“溶液中加入
 的目的是
的目的是 的溶度积常数
的溶度积常数 是
是(4)下列物质调浴液pH,最好选用
a.氨水 b.
 c.稀
c.稀 d.
d.
若调pH前
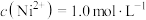 ,
, 和
和 浓度均为0.01mol/L,则“调pH”需控制浴液pH的范围为
浓度均为0.01mol/L,则“调pH”需控制浴液pH的范围为(5)
 易水解,海水中提取镁有类似B的操作,如从
易水解,海水中提取镁有类似B的操作,如从 溶液中获得溶质
溶液中获得溶质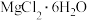 晶体需要在
晶体需要在
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】I.某化学自主实验小组利用如图所示装置探究 能否被
能否被 还原
还原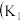 、
、 为止水夹,夹持固定装置略去)。
为止水夹,夹持固定装置略去)。________ 。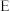 装置发生的化学反应方程式为
装置发生的化学反应方程式为_________ 。
(2)甲、乙分别是___________  填标号
填标号 。
。
a.硫酸、浓硫酸 b.碱石灰、无水氯化钙 c.碱石灰、碱石灰 d.五氧化二磷、五氧化二磷
(3)若 能够被
能够被 还原,写出发生反应的化学方程式:
还原,写出发生反应的化学方程式:___________ 。
(4)此实验装置存在一个明显的缺陷是___________ 。
II.硫酸可用于生产化肥、农药、炸药、染料和盐类等。工业生产硫酸的流程图如下: 为原料来制备SO2,将黄铁矿粉碎的原因是:
为原料来制备SO2,将黄铁矿粉碎的原因是:___________ 。
(6)写出催化反应室中SO2被氧化为SO3的化学方程式___________ 。
(7)硫酸工业的尾气中含有少量SO2,若直接排放会污染空气,并导致硫酸型酸雨,可用___________ 吸收。
 能否被
能否被 还原
还原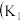 、
、 为止水夹,夹持固定装置略去)。
为止水夹,夹持固定装置略去)。
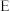 装置发生的化学反应方程式为
装置发生的化学反应方程式为(2)甲、乙分别是
 填标号
填标号 。
。a.硫酸、浓硫酸 b.碱石灰、无水氯化钙 c.碱石灰、碱石灰 d.五氧化二磷、五氧化二磷
(3)若
 能够被
能够被 还原,写出发生反应的化学方程式:
还原,写出发生反应的化学方程式:(4)此实验装置存在一个明显的缺陷是
II.硫酸可用于生产化肥、农药、炸药、染料和盐类等。工业生产硫酸的流程图如下:
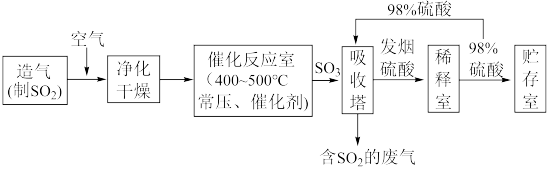
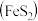 为原料来制备SO2,将黄铁矿粉碎的原因是:
为原料来制备SO2,将黄铁矿粉碎的原因是:(6)写出催化反应室中SO2被氧化为SO3的化学方程式
(7)硫酸工业的尾气中含有少量SO2,若直接排放会污染空气,并导致硫酸型酸雨,可用
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐1】钨(W)广泛用于国防军事、航空航天、信息制造等领域。实验室以硬质合金废料(含WC、Fe和少量C、Co)为原料制备炼钨中间体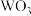 ,并提取有价金属的一种工艺流程如图所示:
,并提取有价金属的一种工艺流程如图所示:
回答下列问题:
(1)“酸浸”的目的为___________ ;“沉铁”时调节pH的范围为___________ ;“还原”反应同时生成一种参与大气循环的气体,该离子方程式为___________ 。
(2)其他条件相同时,“焙烧”过程中 流速与钨氧化率的关系如图所示,其中
流速与钨氧化率的关系如图所示,其中 流速大于0.15 m3/h时钨氧化率降低的原因为
流速大于0.15 m3/h时钨氧化率降低的原因为___________ 。 ,其原因为
,其原因为___________ 。
(4)“酸浸”工序可用电解法代替。则进行电解时,WC进入___________ (填“阳极泥”或“阴极泥”)。
(5)尾气1与尾气3的反应是汽车尾气处理的原理之一,该反应的化学方程式为___________ 。
(6) 、
、 ,
, 、
、 ,NaOH,Co中,熔点主要取决于氢键的是
,NaOH,Co中,熔点主要取决于氢键的是___________ ;H、O、Cl、Co的电负性由大到小的顺序为___________ 。
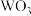 ,并提取有价金属的一种工艺流程如图所示:
,并提取有价金属的一种工艺流程如图所示: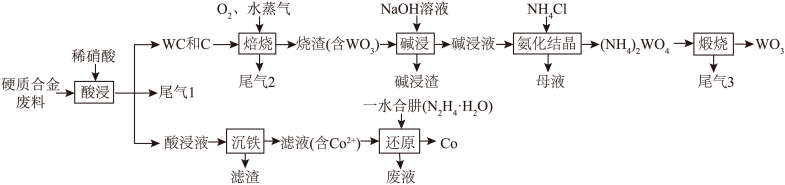
| 金属离子 |  |  |  |  |
| 开始沉定pH | 0.2 | 1.5 | 6.5 | 7.0 |
| 沉淀完全pH | 1.1 | 4.1 | 9.7 | 9.2 |
(1)“酸浸”的目的为
(2)其他条件相同时,“焙烧”过程中
 流速与钨氧化率的关系如图所示,其中
流速与钨氧化率的关系如图所示,其中 流速大于0.15 m3/h时钨氧化率降低的原因为
流速大于0.15 m3/h时钨氧化率降低的原因为
 ,其原因为
,其原因为(4)“酸浸”工序可用电解法代替。则进行电解时,WC进入
(5)尾气1与尾气3的反应是汽车尾气处理的原理之一,该反应的化学方程式为
(6)
 、
、 ,
, 、
、 ,NaOH,Co中,熔点主要取决于氢键的是
,NaOH,Co中,熔点主要取决于氢键的是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】工业上用方铅矿(主要成分为 ,含有少量
,含有少量 等杂质)和软锰矿(主要成分为
等杂质)和软锰矿(主要成分为 ,含有少量
,含有少量 、
、 等杂质)制备
等杂质)制备 和
和 ,工艺流程如图所示。
,工艺流程如图所示。
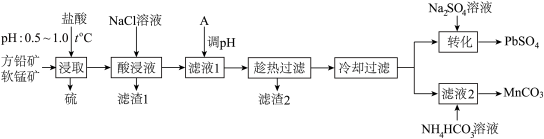
已知:①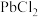 难溶于冷水,易溶于热水;
难溶于冷水,易溶于热水; ;
;
②部分金属离子开始沉淀和沉淀完全的 如下表:
如下表:
③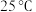 时,
时,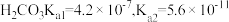 ;
;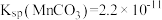 。
。
回答下列问题:
(1)为提高方铅矿的浸出率,结合下图信息,选择“浸取”的合适条件_______ 。“浸取”过程中发生的主要反应的化学方程式为_______ ,“酸浸液”中含有的金属阳离子有 、
、_______ 。

(2)加入 溶液的目的是
溶液的目的是_______ ;物质A调节 的范围是
的范围是_______ 。
(3)“滤液2”中加入 溶液发生反应的离子方程式为
溶液发生反应的离子方程式为_______ 。
 ,含有少量
,含有少量 等杂质)和软锰矿(主要成分为
等杂质)和软锰矿(主要成分为 ,含有少量
,含有少量 、
、 等杂质)制备
等杂质)制备 和
和 ,工艺流程如图所示。
,工艺流程如图所示。
已知:①
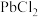 难溶于冷水,易溶于热水;
难溶于冷水,易溶于热水; ;
;②部分金属离子开始沉淀和沉淀完全的
 如下表:
如下表:| 金属离子 |  |  |  |  |  |
开始沉淀的 | 7.0 | 1.7 | 3.7 | 7.6 | 7.0 |
沉淀完全的 | 9.6 | 3.2 | 4.7 | 9.8 | 9.0 |
③
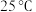 时,
时,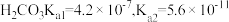 ;
;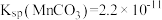 。
。回答下列问题:
(1)为提高方铅矿的浸出率,结合下图信息,选择“浸取”的合适条件
 、
、
(2)加入
 溶液的目的是
溶液的目的是 的范围是
的范围是(3)“滤液2”中加入
 溶液发生反应的离子方程式为
溶液发生反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
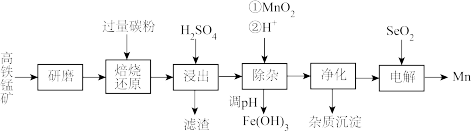
【推荐3】在钢铁工业中,主要用锰脱硫和脱氧:锰也是作为合金的添加料。一种以高铁锰矿(含 、
、 及少量
及少量 、
、 、
、 、
、 )为原料生产金属锰的工艺流程如图。
)为原料生产金属锰的工艺流程如图。
已知:常温下, 的
的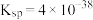 ;
; ;溶液中某离子浓度小于
;溶液中某离子浓度小于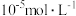 认为该离子沉淀完全。
认为该离子沉淀完全。
回答下列问题:
(1)研磨的目的是_______ 。
(2)“焙烧还原”时,原料中高铁锰矿中 被还原为
被还原为 ,还有能被还原的成分为
,还有能被还原的成分为_______ 、_______ 。(填化学式)
(3)下表数据是焙烧后 元素在主要含锰物质中的分布情况,则焙烧时应选择的温度为
元素在主要含锰物质中的分布情况,则焙烧时应选择的温度为_______  。
。
(4)“浸出”产生两种“滤渣”的成分为_______ 、_______ (填化学式):该步骤中,工业上往往需再加入少量固体 以促进其中一种主要“滤渣”析出,结合化学反应原理解释其原因
以促进其中一种主要“滤渣”析出,结合化学反应原理解释其原因_______ 。
(5)常温下,“除杂”时 参加的反应的离子方程式为
参加的反应的离子方程式为_______ ;再逐步调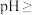
_______ 至 完全沉淀。
完全沉淀。
(6)研究表明,加入适量的 有利于
有利于 在电极上析出,电解过程中
在电极上析出,电解过程中 与水反应生成的
与水反应生成的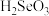 (二元弱酸)在阴极放电生成
(二元弱酸)在阴极放电生成 单质,该电极反应式为
单质,该电极反应式为_______ 。
 、
、 及少量
及少量 、
、 、
、 、
、 )为原料生产金属锰的工艺流程如图。
)为原料生产金属锰的工艺流程如图。
已知:常温下,
 的
的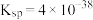 ;
; ;溶液中某离子浓度小于
;溶液中某离子浓度小于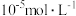 认为该离子沉淀完全。
认为该离子沉淀完全。回答下列问题:
(1)研磨的目的是
(2)“焙烧还原”时,原料中高铁锰矿中
 被还原为
被还原为 ,还有能被还原的成分为
,还有能被还原的成分为(3)下表数据是焙烧后
 元素在主要含锰物质中的分布情况,则焙烧时应选择的温度为
元素在主要含锰物质中的分布情况,则焙烧时应选择的温度为 。
。还原温度/ | 焙烧后 元素在主要含锰物质中的分布/% 元素在主要含锰物质中的分布/% | ||
 | 高价锰( ) ) | 低价锰( ) ) | |
| 600 800 1000 1100 1200 | 40.92 10.56 6.01 痕量 痕量 | 34.76 6.63 2.70 0.46 0.30 | 24.32 82.81 91.29 98.76 97.94 |
 以促进其中一种主要“滤渣”析出,结合化学反应原理解释其原因
以促进其中一种主要“滤渣”析出,结合化学反应原理解释其原因(5)常温下,“除杂”时
 参加的反应的离子方程式为
参加的反应的离子方程式为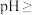
 完全沉淀。
完全沉淀。(6)研究表明,加入适量的
 有利于
有利于 在电极上析出,电解过程中
在电极上析出,电解过程中 与水反应生成的
与水反应生成的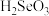 (二元弱酸)在阴极放电生成
(二元弱酸)在阴极放电生成 单质,该电极反应式为
单质,该电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】锌电解阳极泥(主要成分为MnO2、PbSO4和ZnO,还有少量锰铅氧化物Pb2Mn8O16和Ag)是冶锌过程中产生的废渣,一种回收锌电解阳极泥中金属元素锌、锰、铅和银的工艺如图。回答下列问题:

已知:①MnSO4∙H2O易溶于水,不溶于乙醇。
②在较高温度及酸性催化条件下,葡萄糖能发生如下反应:




 +HCOOH
+HCOOH
(1)已知Pb2Mn8O16中Pb为+2价,Mn为+2价和+4价,则氧化物中+2价和+4价Mn的个数比为_______ 。
(2)“还原酸浸”过程中主要反应的离子方程式为_______ 。
(3)实际锰浸出最适宜的葡萄糖加入量远大于理论加入量,其原因是_______ 。
(4)整个流程中可循环利用的物质是_______ 。获得MnSO4∙H2O晶体的一系列操作是指蒸发结晶、趁热过滤、洗涤、干燥,其中洗涤的具体操作是_______ 。
(5)加入Na2CO3溶液的目的是将PbSO4转化为PbCO3,Na2CO3溶液的最小浓度为_______ mol·L–1(保留两位小数)。判断沉淀转化能否彻底进行并说明理由_______ 。
[已知:20℃时Ksp(PbSO4)=1.6×10-8mol2·L-2,Ksp(PbCO3)=7.4×10-14mol2·L-2,1.262≈1.6]

已知:①MnSO4∙H2O易溶于水,不溶于乙醇。
②在较高温度及酸性催化条件下,葡萄糖能发生如下反应:




 +HCOOH
+HCOOH(1)已知Pb2Mn8O16中Pb为+2价,Mn为+2价和+4价,则氧化物中+2价和+4价Mn的个数比为
(2)“还原酸浸”过程中主要反应的离子方程式为
(3)实际锰浸出最适宜的葡萄糖加入量远大于理论加入量,其原因是
(4)整个流程中可循环利用的物质是
(5)加入Na2CO3溶液的目的是将PbSO4转化为PbCO3,Na2CO3溶液的最小浓度为
[已知:20℃时Ksp(PbSO4)=1.6×10-8mol2·L-2,Ksp(PbCO3)=7.4×10-14mol2·L-2,1.262≈1.6]
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】开发新型材料是现在科学研究的一项重要工作,科学家开发一种形状记忆陶瓷,它的主要原材料是纳米级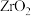 。用锆石
。用锆石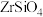 (含少量FeO、
(含少量FeO、 、
、 和CuO)制备纳米级
和CuO)制备纳米级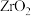 的流程设计如图:
的流程设计如图:
回答下列问题:
(1)锆石杂质中含铁元素,铁元素位于元素周期表的___________ 区。
(2)为提高碱熔率,可采取的措施是___________ (写出一种即可)。
(3)“酸浸”过程中FeO发生氧化还原反应的离子方程式为___________ ,滤渣2的主要成分是___________ 。
(4)“酸浸”时,得到的溶质主要是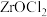 ,而不是
,而不是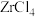 ,是因为
,是因为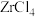 ,很容易水解,则
,很容易水解,则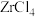 水解的化学方程式是
水解的化学方程式是___________ 。
(5)“调pH”时,需要调节的pH范围为___________ 。
(6)若溶液中 的浓度为0.2
的浓度为0.2 ,加入等体积的c
,加入等体积的c 的KCN溶液将
的KCN溶液将 完全沉淀,忽略混合时溶液的体积变化,
完全沉淀,忽略混合时溶液的体积变化, 完全沉淀时,离子的浓度为
完全沉淀时,离子的浓度为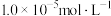 ,已知该条件下
,已知该条件下 ,则
,则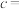
___________
(7)若锆石中含有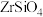 的质量分数是91.5%,在制备
的质量分数是91.5%,在制备 的过程中损失10%的锆元素,则1kg锆石理论上能够制得
的过程中损失10%的锆元素,则1kg锆石理论上能够制得 的质量是
的质量是___________ g。
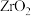 。用锆石
。用锆石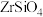 (含少量FeO、
(含少量FeO、 、
、 和CuO)制备纳米级
和CuO)制备纳米级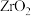 的流程设计如图:
的流程设计如图:
| 物质 |  |  |  |  |
| 开始沉淀pH | 1.9 | 4.8 | 3.5 | 5 |
| 完全沉淀pH | 3.2 | 6.7 | 4.6 | 8 |
(1)锆石杂质中含铁元素,铁元素位于元素周期表的
(2)为提高碱熔率,可采取的措施是
(3)“酸浸”过程中FeO发生氧化还原反应的离子方程式为
(4)“酸浸”时,得到的溶质主要是
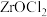 ,而不是
,而不是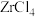 ,是因为
,是因为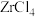 ,很容易水解,则
,很容易水解,则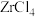 水解的化学方程式是
水解的化学方程式是(5)“调pH”时,需要调节的pH范围为
(6)若溶液中
 的浓度为0.2
的浓度为0.2 ,加入等体积的c
,加入等体积的c 的KCN溶液将
的KCN溶液将 完全沉淀,忽略混合时溶液的体积变化,
完全沉淀,忽略混合时溶液的体积变化, 完全沉淀时,离子的浓度为
完全沉淀时,离子的浓度为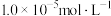 ,已知该条件下
,已知该条件下 ,则
,则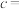
(7)若锆石中含有
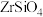 的质量分数是91.5%,在制备
的质量分数是91.5%,在制备 的过程中损失10%的锆元素,则1kg锆石理论上能够制得
的过程中损失10%的锆元素,则1kg锆石理论上能够制得 的质量是
的质量是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐3】电镀污泥是电镀废水处理过程中产生的固体废弃物,其中含有大量的金属,如铜、镍、铬等,是一种廉价的二次可再生资源.以某厂的电镀污泥(除水干化后的成分如表所示)为原料回收铜和镍的工艺路线如图所示:
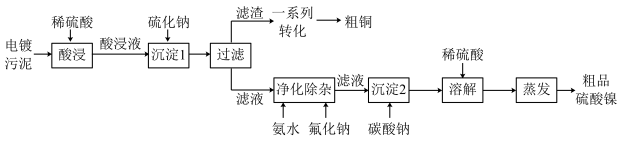
回答下列问题:
(1)若污泥中Cr元素以 ,的形式存在,则“酸浸”时
,的形式存在,则“酸浸”时 发生反应的化学方程式为
发生反应的化学方程式为______ 。
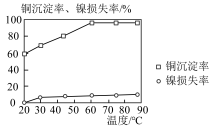
(2)“沉淀1”时,当硫化钠的加入量为理论需求量的1.2倍、沉淀时间为30min时,温度对铜沉淀率和镍损失率的影响如图所示,则“沉淀1”温度应控制为______ 。
(3)溶液中金属离子开始沉淀、沉淀完全时的pH如表所示:
“净化除杂”时,向滤液中加氨水前通常需要加入适量的双氧水,目的是______ 。为保证除杂效果,加入氨水调节溶液的pH,需要控制pH的范围为______ 。
(4)已知常温下 和
和 的溶度积常数分别为
的溶度积常数分别为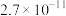 、
、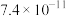 ,若添加氟化钠后溶液中
,若添加氟化钠后溶液中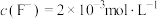 ,此时
,此时 和
和 是否除尽?
是否除尽?______ 。
(5)向“净化除杂”后的滤液中加入碳酸钠溶液,生成碱式碳酸镍[化学式为 ]沉淀,该过程中无气体生成,反应的离子方程式为
]沉淀,该过程中无气体生成,反应的离子方程式为______ 。
(6)取20.00g干化电镀污泥,进行回收处理得到粗品铜,最终转化为1.638g纯铜,则铜的回收率为______ 。
| 组成 | Cu | Ni | Cr | Al | Fe | Ca | Mg | 其他 |
| 质量分数/% | 9.10 | 8.60 | 3.04 | 2.31 | 0.76 | 5.62 | 1.34 | 69.23 |

回答下列问题:
(1)若污泥中Cr元素以
 ,的形式存在,则“酸浸”时
,的形式存在,则“酸浸”时 发生反应的化学方程式为
发生反应的化学方程式为(2)“沉淀1”时,当硫化钠的加入量为理论需求量的1.2倍、沉淀时间为30min时,温度对铜沉淀率和镍损失率的影响如图所示,则“沉淀1”温度应控制为

(3)溶液中金属离子开始沉淀、沉淀完全时的pH如表所示:
| 金属离子 |  |  |  |  |  |
| 开始沉淀时的pH | 7.2 | 4.9 | 3.7 | 2.2 | 7.5 |
沉淀完全时( )的pH )的pH | 8.7 | 6.8 | 4.7 | 3.2 | 9.0 |
(4)已知常温下
 和
和 的溶度积常数分别为
的溶度积常数分别为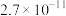 、
、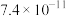 ,若添加氟化钠后溶液中
,若添加氟化钠后溶液中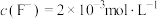 ,此时
,此时 和
和 是否除尽?
是否除尽?(5)向“净化除杂”后的滤液中加入碳酸钠溶液,生成碱式碳酸镍[化学式为
 ]沉淀,该过程中无气体生成,反应的离子方程式为
]沉淀,该过程中无气体生成,反应的离子方程式为(6)取20.00g干化电镀污泥,进行回收处理得到粗品铜,最终转化为1.638g纯铜,则铜的回收率为
您最近一年使用:0次

 23.2
23.2

