大气中SO2、H2S的资源化利用具有重要意义。回答下列问题:
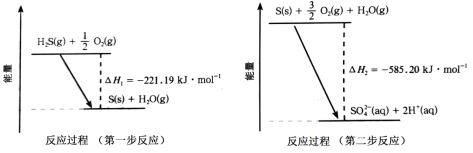
(1)土壤中的微生物可将大气中的H2S经两步反应氧化成SO ,两步反应的能量变化如图所示。则1molH2S(g)全部氧化成SO
,两步反应的能量变化如图所示。则1molH2S(g)全部氧化成SO (aq)的热化学方程式为
(aq)的热化学方程式为___ 。
(2)如图甲所示为质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。
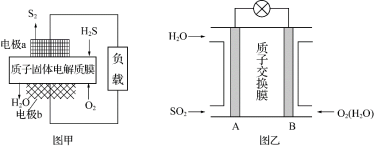
b电极为___ 极(填“正”或“负”),其电极反应式为___ 。
(3)图乙为SO2—空气质子交换膜燃料电池,可以利用大气所含的SO2快速启动。
①该电池中质子的流动方向为___ (填“从A到B”或“从B到A”)。
②负极的电极反应式为___ 。
③用该电池处理32gSO2,理论上需要消耗O2的体积为___ L(标准状况)。
(1)土壤中的微生物可将大气中的H2S经两步反应氧化成SO
 ,两步反应的能量变化如图所示。则1molH2S(g)全部氧化成SO
,两步反应的能量变化如图所示。则1molH2S(g)全部氧化成SO (aq)的热化学方程式为
(aq)的热化学方程式为
(2)如图甲所示为质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。

b电极为
(3)图乙为SO2—空气质子交换膜燃料电池,可以利用大气所含的SO2快速启动。
①该电池中质子的流动方向为
②负极的电极反应式为
③用该电池处理32gSO2,理论上需要消耗O2的体积为
更新时间:2021-06-08 12:32:08
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】在催化剂作用下H2(g)可将烟气中的SO2(g)还原成S(s)。回答下列问题:
(1)已知:O2(g)+2H2(g)=2H2O(l) △H1=-571.6kJ·mol-1
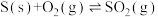 △H2=-296.9kJ·mol-1
△H2=-296.9kJ·mol-1
则H2(g)还原烟气中的SO2(g)的热化学方程式为____ 。
(2)在容积为10L的容器中充入1molSO2(g)与2molH2(g)的混合气体,发生反应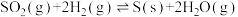 △H<0。
△H<0。
①恒容时,反应经过4s后达到平衡,此时测得H2O(g)的物质的量为1.2mol。则0~4s内,v(H2)=____ mol·L-1·s-1,平衡时,c(SO2)=____ mol·L-1;若平衡后升高温度,SO2的转化率将____ (填“增大”“减小”或“不变”)。
②恒温时,压强p与SO2的平衡转化率α如图所示,该温度下,该反应的平衡常数K=____ L·mol-1(保留小数点后两位);平衡状态由A变到B,平衡常数K(A)____ K(B)(填“<”“>”或“=”)。

(1)已知:O2(g)+2H2(g)=2H2O(l) △H1=-571.6kJ·mol-1
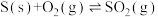 △H2=-296.9kJ·mol-1
△H2=-296.9kJ·mol-1则H2(g)还原烟气中的SO2(g)的热化学方程式为
(2)在容积为10L的容器中充入1molSO2(g)与2molH2(g)的混合气体,发生反应
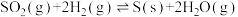 △H<0。
△H<0。①恒容时,反应经过4s后达到平衡,此时测得H2O(g)的物质的量为1.2mol。则0~4s内,v(H2)=
②恒温时,压强p与SO2的平衡转化率α如图所示,该温度下,该反应的平衡常数K=

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】碳及其化合物与人类的生产生活、高科技邻域等密切相关
(1)已知: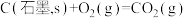
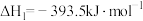
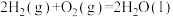
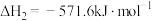
 ΔH=-2599.2kJ
ΔH=-2599.2kJ mol-1
mol-1
则由 和
和 反应生成
反应生成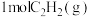 的焓变为
的焓变为_______ 。
甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(2)在一容积为2L的密闭容器内,充入0.2 mol CO与0.4 mol 发生反应,
发生反应, ,CO的平衡转化率与温度,压强的关系如图所示。
,CO的平衡转化率与温度,压强的关系如图所示。

①该反应的ΔH_______ 0(填>、=、<), A、B两点对应的压强大小关系是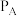
_______  (填“>、<、=”)。
(填“>、<、=”)。
②A、B、C三点的平衡常数 ,
, ,
,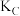 的大小关系是
的大小关系是_______ 。
③下列叙述能说明上述反应能达到化学平衡状态的是_______ (填代号)
a. 的消耗速率是
的消耗速率是 生成速率的2倍 b.
生成速率的2倍 b. 的体积分数不再改变
的体积分数不再改变
c.混合气体的密度不再改变 d.CO和 的物质的量之和保持不变
的物质的量之和保持不变
(3)在 压强、
压强、 ℃时,该反应的平衡常数K=
℃时,该反应的平衡常数K= _______ ,再加入1.0mol CO后重新到达平衡,则CO的转化率_______ (填“增大,不变或减小”)。
(4) ℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下,CO:0.1mol、
℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下,CO:0.1mol、 :0.2mol、
:0.2mol、 :0.2mol,此时
:0.2mol,此时
_______ 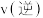 (填“>、<或=”)。
(填“>、<或=”)。
(1)已知:
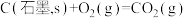
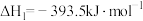
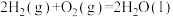
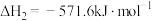
 ΔH=-2599.2kJ
ΔH=-2599.2kJ mol-1
mol-1则由
 和
和 反应生成
反应生成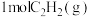 的焓变为
的焓变为甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(2)在一容积为2L的密闭容器内,充入0.2 mol CO与0.4 mol
 发生反应,
发生反应, ,CO的平衡转化率与温度,压强的关系如图所示。
,CO的平衡转化率与温度,压强的关系如图所示。
①该反应的ΔH
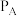
 (填“>、<、=”)。
(填“>、<、=”)。②A、B、C三点的平衡常数
 ,
, ,
,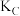 的大小关系是
的大小关系是③下列叙述能说明上述反应能达到化学平衡状态的是
a.
 的消耗速率是
的消耗速率是 生成速率的2倍 b.
生成速率的2倍 b. 的体积分数不再改变
的体积分数不再改变c.混合气体的密度不再改变 d.CO和
 的物质的量之和保持不变
的物质的量之和保持不变(3)在
 压强、
压强、 ℃时,该反应的平衡常数K=
℃时,该反应的平衡常数K= (4)
 ℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下,CO:0.1mol、
℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下,CO:0.1mol、 :0.2mol、
:0.2mol、 :0.2mol,此时
:0.2mol,此时
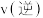 (填“>、<或=”)。
(填“>、<或=”)。
您最近一年使用:0次
【推荐3】资源和环境问题仍是社会关注的焦点。碳捕集、利用与封存(简称 ),是降碳的重要手段,即从工业、能源生产等排放源或空气中捕集分离
),是降碳的重要手段,即从工业、能源生产等排放源或空气中捕集分离 ,然后将其输送到适宜的场地加以利用或者长期封存,不让它逃回大气层。回答下列问题:
,然后将其输送到适宜的场地加以利用或者长期封存,不让它逃回大气层。回答下列问题:
(1)一定条件下, 催化加氢制
催化加氢制 时,发生的主要反应有:
时,发生的主要反应有:
反应①:
反应②: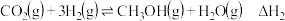
反应③:
(1)反应②的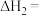
_______  ,该反应的自发条件是
,该反应的自发条件是_______ (填“低温”“高温”或“任意温度”)。
(2) 催化加氢法可制备乙烯,反应原理为
催化加氢法可制备乙烯,反应原理为 。向
。向 恒容密闭容器中加入
恒容密闭容器中加入 和
和 ,在催化剂作用下发生反应,测得平衡时体系中各气体的物质的量随温度的变化关系如图甲所示:
,在催化剂作用下发生反应,测得平衡时体系中各气体的物质的量随温度的变化关系如图甲所示: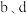 分别代表的是
分别代表的是_______ 、_______ 的物质的量随温度的变化关系。
②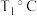 时,
时, 的平衡转化率为
的平衡转化率为_______ (结果保留三位有效数字)。
(3)一定温度下,分别按 起始物质的量之比为
起始物质的量之比为 发生反应
发生反应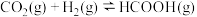 ,保持总压强为
,保持总压强为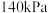 ,测得
,测得 的平衡转化率与温度之间的关系如图乙所示。曲线I代表的投料比为
的平衡转化率与温度之间的关系如图乙所示。曲线I代表的投料比为_______ 。X点条件下,用平衡分压代替平衡浓度计算的平衡常数
_______  (已知:分压=总压×物质的量分数)。
(已知:分压=总压×物质的量分数)。 材料作光电阴极,以
材料作光电阴极,以 饱和的
饱和的 的
的 溶液作电解液
溶液作电解液 ,将
,将 转化为
转化为 ,原理如图丙所示。根据图示,写出光电阴极的电极反应式:
,原理如图丙所示。根据图示,写出光电阴极的电极反应式:_______ 。
 ),是降碳的重要手段,即从工业、能源生产等排放源或空气中捕集分离
),是降碳的重要手段,即从工业、能源生产等排放源或空气中捕集分离 ,然后将其输送到适宜的场地加以利用或者长期封存,不让它逃回大气层。回答下列问题:
,然后将其输送到适宜的场地加以利用或者长期封存,不让它逃回大气层。回答下列问题:(1)一定条件下,
 催化加氢制
催化加氢制 时,发生的主要反应有:
时,发生的主要反应有:反应①:

反应②:
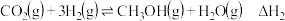
反应③:

(1)反应②的
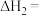
 ,该反应的自发条件是
,该反应的自发条件是(2)
 催化加氢法可制备乙烯,反应原理为
催化加氢法可制备乙烯,反应原理为 。向
。向 恒容密闭容器中加入
恒容密闭容器中加入 和
和 ,在催化剂作用下发生反应,测得平衡时体系中各气体的物质的量随温度的变化关系如图甲所示:
,在催化剂作用下发生反应,测得平衡时体系中各气体的物质的量随温度的变化关系如图甲所示:
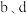 分别代表的是
分别代表的是②
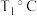 时,
时, 的平衡转化率为
的平衡转化率为(3)一定温度下,分别按
 起始物质的量之比为
起始物质的量之比为 发生反应
发生反应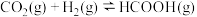 ,保持总压强为
,保持总压强为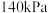 ,测得
,测得 的平衡转化率与温度之间的关系如图乙所示。曲线I代表的投料比为
的平衡转化率与温度之间的关系如图乙所示。曲线I代表的投料比为
 (已知:分压=总压×物质的量分数)。
(已知:分压=总压×物质的量分数)。
 材料作光电阴极,以
材料作光电阴极,以 饱和的
饱和的 的
的 溶液作电解液
溶液作电解液 ,将
,将 转化为
转化为 ,原理如图丙所示。根据图示,写出光电阴极的电极反应式:
,原理如图丙所示。根据图示,写出光电阴极的电极反应式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】(1)按图装置进行实验,以下叙述错误的是_______ (填字母);

A.铜片是正极,表面有气泡产生B.装置中存在“化学能→电能→光能”的转化
C.外电路中电流方向Zn→Cu D.溶液中 向铜片方向移动
向铜片方向移动
(2)碱性锌锰干电池的总反应为2MnO2+Zn+2H2O=2MnO(OH)+Zn(OH)2,写出其正极发生的电极反应式_______
(3)甲醇是一种重要的燃料,将其制成燃料电池后的工作原理如下图所示:
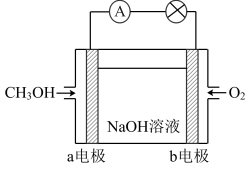
a电极发生的电极反应式为_______ ,当b极消耗标准状况下气体3.36L时,则溶液的质量增重_______ g。

A.铜片是正极,表面有气泡产生B.装置中存在“化学能→电能→光能”的转化
C.外电路中电流方向Zn→Cu D.溶液中
 向铜片方向移动
向铜片方向移动(2)碱性锌锰干电池的总反应为2MnO2+Zn+2H2O=2MnO(OH)+Zn(OH)2,写出其正极发生的电极反应式
(3)甲醇是一种重要的燃料,将其制成燃料电池后的工作原理如下图所示:

a电极发生的电极反应式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】利用如图装置进行Zn与稀H2SO4反应实验,探究硫酸铜的量、反应温度对氢气生成速率的影响。

在蒸馏烧瓶中加入30 mL 0.3 mol·L-1稀硫酸,再通过注射器注入一定体积的1.0 mol·L-1硫酸铜溶液和蒸馏水,插入锌片,用秒表记录产生20.0 mL气体所需的时间。实验数据如表所示。
回答下列问题:
(1)V1=_______ ,V3_______ 。
(2)tA>tB,原因是_______ ,tB>tC的原因是_______ 。
(3)tF>tE,原因是_______ 。
(4)测定实验B反应后剩余溶液中硫酸的物质的量浓度。
①准确量取10.00 mL该剩余液注入锥形瓶中,滴加_______ 作指示剂。(填标号)
A.甲基橙 B.石蕊 C.酚酞
②用0.2000 mol·L-I标准NaOH溶液滴定。重复实验,得到下列实验数据,计算剩余溶液中硫酸的物质的量浓度为_______ mol·L-1。

在蒸馏烧瓶中加入30 mL 0.3 mol·L-1稀硫酸,再通过注射器注入一定体积的1.0 mol·L-1硫酸铜溶液和蒸馏水,插入锌片,用秒表记录产生20.0 mL气体所需的时间。实验数据如表所示。
| 实验序号 | A | B | C | D | E | F |
| 温度/℃ | 25 | 25 | 35 | 25 | 25 | 25 |
| CuSO4溶液体积/mL | 0 | 1 | 1 | 2 | V4 | 20 |
| 蒸馏水体积/mL | 20 | V1 | V2 | V3 | 16 | 0 |
| 所需时间 | tA | tB | tC | tD | tE | tF |
(1)V1=
(2)tA>tB,原因是
(3)tF>tE,原因是
(4)测定实验B反应后剩余溶液中硫酸的物质的量浓度。
①准确量取10.00 mL该剩余液注入锥形瓶中,滴加
A.甲基橙 B.石蕊 C.酚酞
②用0.2000 mol·L-I标准NaOH溶液滴定。重复实验,得到下列实验数据,计算剩余溶液中硫酸的物质的量浓度为
| 滴定次数 | 待测液体积/mL | 标准NaOH溶液体积/mL | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 10.00 | 0.50 | 16.88 |
| 第二次 | 10.00 | 1.00 | 17.34 |
| 第三次 | 10.00 | 0.50 | 18.10 |
您最近一年使用:0次
【推荐3】今年,雾霾阴影笼罩全国。二氧化硫、氮氧化物和可吸入颗粒物是雾霾的主要组成成分,综合治理其污染是环境化学当前的重要研究内容。
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化。
①已知部分化学键的键能如下(键能指气态原子形成1 mol化学键释放的最小能量)
汽车尾气净化中NO(g)和CO(g)发生反应的热化学方程式为______________ 。
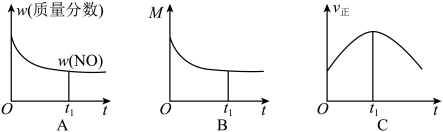
②若上述反应在绝热、恒容的密闭体系中进行,并在t1时刻达到平衡状态,则下列示意图不符合题意的是__________ (填选项序号)。(图中ω、M、v正分别表示质量分数、混合气体平均相对分子质量、正反应速率)
(2)尾气中的SO2可先催化氧化生成SO3,再合成硫酸。
已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.0 kJ/mol。
2SO3(g) ΔH=-196.0 kJ/mol。
①在一定温度的密闭容器中,SO2的转化率随时间的变化关系如图所示,

则A点的v逆(SO2)_________ (填“大于”、“小于”或“等于”)B点的v正(SO2)。
②在某温度时,向10 L的密闭容器中加入4.0 mol SO2和10.0 mol O2,反应达到平衡,改变下列条件,再次达到平衡时,能使O2的新平衡浓度和原来平衡浓度相同的是_________ (填选项序号)。
A.在其他条件不变时,减小容器的容积
B.保持温度和容器内压强不变,再充入2.0 mol SO2和5.0 mol O2
C.保持温度和容器体积不变,再充入SO2和SO3,使之浓度扩大为原来的两倍
(3)用NH3催化还原NOx也可以消除氮氧化物的污染,反应原理为NO(g)+NO2(g)+2NH3(g) 2N2(g)+3H2O(g)。对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则上述反应的Kp的表达式为
2N2(g)+3H2O(g)。对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则上述反应的Kp的表达式为___________ 。
(4)右图是将SO2与O2转化为重要的化工原料H2SO4的原理示意图。

①催化剂a表面的反应是:_____________________ ;
②若得到的硫酸浓度仍为49%,则理论上参加反应的
SO2与加入的H2O的质量比为______________________ 。
(5)尾气中氮氧化物(NO和NO2)可用尿素[CO(NH2)2]溶液除去,反应生成对大气无污染的气体。1 mol尿素能吸收工业尾气中氮氧化物(假设NO、NO2体积比为1∶1)的质量为___________ g。
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化。
①已知部分化学键的键能如下(键能指气态原子形成1 mol化学键释放的最小能量)
| 化学键 | N≡O | C≡O | C=O | N≡N |
| 键能(kJ/mol) | 632 | 1072 | 750 | 946 |
②若上述反应在绝热、恒容的密闭体系中进行,并在t1时刻达到平衡状态,则下列示意图不符合题意的是

(2)尾气中的SO2可先催化氧化生成SO3,再合成硫酸。
已知:2SO2(g)+O2(g)
 2SO3(g) ΔH=-196.0 kJ/mol。
2SO3(g) ΔH=-196.0 kJ/mol。①在一定温度的密闭容器中,SO2的转化率随时间的变化关系如图所示,

则A点的v逆(SO2)
②在某温度时,向10 L的密闭容器中加入4.0 mol SO2和10.0 mol O2,反应达到平衡,改变下列条件,再次达到平衡时,能使O2的新平衡浓度和原来平衡浓度相同的是
A.在其他条件不变时,减小容器的容积
B.保持温度和容器内压强不变,再充入2.0 mol SO2和5.0 mol O2
C.保持温度和容器体积不变,再充入SO2和SO3,使之浓度扩大为原来的两倍
(3)用NH3催化还原NOx也可以消除氮氧化物的污染,反应原理为NO(g)+NO2(g)+2NH3(g)
 2N2(g)+3H2O(g)。对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则上述反应的Kp的表达式为
2N2(g)+3H2O(g)。对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则上述反应的Kp的表达式为(4)右图是将SO2与O2转化为重要的化工原料H2SO4的原理示意图。

①催化剂a表面的反应是:
②若得到的硫酸浓度仍为49%,则理论上参加反应的
SO2与加入的H2O的质量比为
(5)尾气中氮氧化物(NO和NO2)可用尿素[CO(NH2)2]溶液除去,反应生成对大气无污染的气体。1 mol尿素能吸收工业尾气中氮氧化物(假设NO、NO2体积比为1∶1)的质量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】某实验小组用石墨作电极电解饱和氯化铜溶液,并记录了电解过程中两电极的现象。请分析:
(1)已知在氯化铜溶液中存在平衡: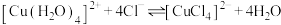 (
( 为蓝色,
为蓝色, 为黄色),则饱和氯化铜溶液呈绿色的原因是
为黄色),则饱和氯化铜溶液呈绿色的原因是_______ 。
(2)针对a极溶液出现“黑色”,该实验小组提出了以下猜想:
猜想一:黑色物质可能是纳米铜粉。推测理由:纳米铜粉为紫黑色粉末,电解过程中由于析出铜速率太快,形成了纳米级小颗粒。
猜想二:黑色物质可能是氧化铜。推测理由:a极可能有部分 放电,且电解过程中溶液温度升高,简述该猜想中生成CuO的原因为
放电,且电解过程中溶液温度升高,简述该猜想中生成CuO的原因为_______ 。
(3)取“黑色悬浊液”加入稀硝酸产生红棕色气体,证明了黑色物质中一定含有纳米铜粉,理由是_______ (用化学方程式说明)。
(4)该小组经过查阅资料和实验验证,a极上产生的“白色薄膜”为氯化亚铜,则a极产生该物质的电极反应式为_______ 。
(5)若将电解液更换为硫酸铜溶液进行实验,a电极不会产生白色物质;若将氯化铜溶液的浓度控制在5%~10%时(肉眼观察溶液为淡蓝色),可在a电极看到比较纯净的红色固体。由此可知,a电极产生的白色物质和黑色物质与_______ 、_______ 等因素有关。
| 实验装置 | 实验现象 | |
 | 通电前 | 溶液呈绿色。 |
| 通电2min | a极碳棒周围的溶液颜色变成黑色;b极产生有刺激性气味的气体。 | |
| 通电20min,关闭电源 | a极碳棒上端表面覆盖一层白色的薄膜;电极周围溶液为黑色。取出碳棒放置一晚后碳棒表面的白色固体变成绿色。 | |
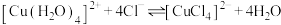 (
( 为蓝色,
为蓝色, 为黄色),则饱和氯化铜溶液呈绿色的原因是
为黄色),则饱和氯化铜溶液呈绿色的原因是(2)针对a极溶液出现“黑色”,该实验小组提出了以下猜想:
猜想一:黑色物质可能是纳米铜粉。推测理由:纳米铜粉为紫黑色粉末,电解过程中由于析出铜速率太快,形成了纳米级小颗粒。
猜想二:黑色物质可能是氧化铜。推测理由:a极可能有部分
 放电,且电解过程中溶液温度升高,简述该猜想中生成CuO的原因为
放电,且电解过程中溶液温度升高,简述该猜想中生成CuO的原因为(3)取“黑色悬浊液”加入稀硝酸产生红棕色气体,证明了黑色物质中一定含有纳米铜粉,理由是
(4)该小组经过查阅资料和实验验证,a极上产生的“白色薄膜”为氯化亚铜,则a极产生该物质的电极反应式为
(5)若将电解液更换为硫酸铜溶液进行实验,a电极不会产生白色物质;若将氯化铜溶液的浓度控制在5%~10%时(肉眼观察溶液为淡蓝色),可在a电极看到比较纯净的红色固体。由此可知,a电极产生的白色物质和黑色物质与
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】重铬酸钾可用于皮革、火柴、印染、电镀等工业。某兴趣小组采用Fe(CrO2)2为原料模拟工业流程制备K2Cr2O7晶体,流程如图:
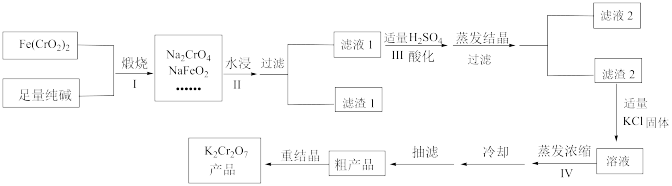
(1)Fe(CrO2)2中Cr的化合价是____ 。
(2)步骤I“煅烧”的化学方程式为____ 。
(3)步骤II“水浸”中,NaFeO2会发生强烈水解,则滤渣1的化学式为____ 。
(4)步骤III“适量H2SO4”酸化时____ (填“能”或“不能”)用盐酸代替硫酸。
(5)步骤IV为得到杂质较少的粗产品K2Cr2O7,将溶液蒸发浓缩至____ 时停止加热,冷却结晶。根据流程可知上述条件下K2Cr2O7的溶解度____ Na2Cr2O7的溶解度。
(6)利用膜电解技术(装置如图所示),也可实现K2CrO4制备K2Cr2O7的过程,其总反应方程式为:4K2CrO4+4H2O 2K2Cr2O7+4KOH+2H2↑+O2↑。阴阳两室内均加入K2CrO4溶液,则K2Cr2O7在
2K2Cr2O7+4KOH+2H2↑+O2↑。阴阳两室内均加入K2CrO4溶液,则K2Cr2O7在____ (填“阴”或“阳”)极室制得,电解时通过交换膜的离子主要为____ 。


(1)Fe(CrO2)2中Cr的化合价是
(2)步骤I“煅烧”的化学方程式为
(3)步骤II“水浸”中,NaFeO2会发生强烈水解,则滤渣1的化学式为
(4)步骤III“适量H2SO4”酸化时
(5)步骤IV为得到杂质较少的粗产品K2Cr2O7,将溶液蒸发浓缩至
(6)利用膜电解技术(装置如图所示),也可实现K2CrO4制备K2Cr2O7的过程,其总反应方程式为:4K2CrO4+4H2O
 2K2Cr2O7+4KOH+2H2↑+O2↑。阴阳两室内均加入K2CrO4溶液,则K2Cr2O7在
2K2Cr2O7+4KOH+2H2↑+O2↑。阴阳两室内均加入K2CrO4溶液,则K2Cr2O7在
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】已知下列热化学方程式:
①NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3 kJ/mol
②C(s)+ O2(g)=CO(g) △H=-110.5 kJ/mol
O2(g)=CO(g) △H=-110.5 kJ/mol
③2C(s)+2O2(g)=2CO2(g) △H=-787 kJ/mol
回答下列问题:
(1)C(s)的标准燃烧热为______ 。
(2)写出CO燃烧的热化学方程式______ 。
(3)反应①经常用于实验室的中和热测定,测定装置如图1所示:
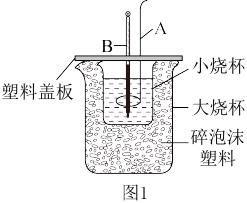

仪器A的名称是______ ,碎泡沫塑料的作用是______ ,用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得中和热的数值会______ 57.3 kJ/mol (填“大于”、“小于”或“等于”)。
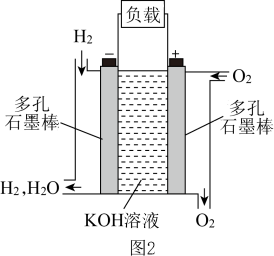
(4)被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点,图2为氢氧燃料电池的结构示意图,试回答下列问题:
①写出该氢氧燃料电池工作时负极的反应式______ 。
②用该电池电解饱和食盐水,当有1 molH2反应时,所产生的氯气用于制备漂白粉,可以制的漂白粉______ 克。
(5)钢铁生锈现象随处可见,钢铁的电化学腐蚀原理如图3所示:
①写出该电池反应的总反应方程式:______ ;
②将该装置作简单修改即可成为钢铁电化学防护的装置,请在如图3虚线框内所示位置作出修改,并用箭头标出导线中电子流动的方向________________ 。
①NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3 kJ/mol
②C(s)+
 O2(g)=CO(g) △H=-110.5 kJ/mol
O2(g)=CO(g) △H=-110.5 kJ/mol ③2C(s)+2O2(g)=2CO2(g) △H=-787 kJ/mol
回答下列问题:
(1)C(s)的标准燃烧热为
(2)写出CO燃烧的热化学方程式
(3)反应①经常用于实验室的中和热测定,测定装置如图1所示:



仪器A的名称是
(4)被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点,图2为氢氧燃料电池的结构示意图,试回答下列问题:
①写出该氢氧燃料电池工作时负极的反应式
②用该电池电解饱和食盐水,当有1 molH2反应时,所产生的氯气用于制备漂白粉,可以制的漂白粉
(5)钢铁生锈现象随处可见,钢铁的电化学腐蚀原理如图3所示:
①写出该电池反应的总反应方程式:
②将该装置作简单修改即可成为钢铁电化学防护的装置,请在如图3虚线框内所示位置作出修改,并用箭头标出导线中电子流动的方向
您最近一年使用:0次



