污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某化学研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已略去)。
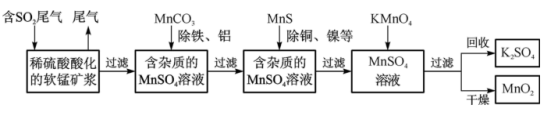
请回答下列问题:
(1)已知:25℃、101 kPa时,
Mn(s)+O2(g)=MnO2(s) ΔH=-520 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH=-297 kJ·mol-1
Mn(s)+S(s)+2O2(g)=MnSO4(s) ΔH=-1065 kJ·mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式是___________ 。请画出该反应的能量变化示意图___________ 。

(2)用惰性电极电解硫酸酸化的硫酸锰溶液制备MnO2的装置如下图所示。
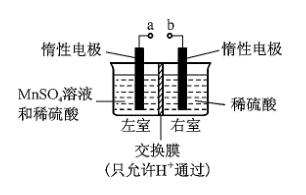
①a应与直流电源的___________ (填“正”或“负”)极相连。
②电解过程中氢离子的作用是___________ ;若转移的电子数为6.02×1023,左室溶液中最终n(H+)的变化量为___________ 。
(3)①MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时正极生成MnOOH,正极的电极反应式是___________ 。
②据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星,其工作原理如下图所示。
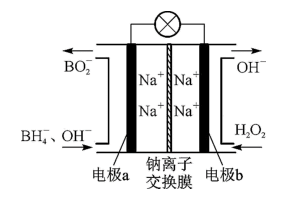
则该电池放电时通入H2O2的一极为___________ 极,电极反应式为___________ ;通入NaBH4的一极电极反应式为___________ 。

请回答下列问题:
(1)已知:25℃、101 kPa时,
Mn(s)+O2(g)=MnO2(s) ΔH=-520 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH=-297 kJ·mol-1
Mn(s)+S(s)+2O2(g)=MnSO4(s) ΔH=-1065 kJ·mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式是

(2)用惰性电极电解硫酸酸化的硫酸锰溶液制备MnO2的装置如下图所示。

①a应与直流电源的
②电解过程中氢离子的作用是
(3)①MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时正极生成MnOOH,正极的电极反应式是
②据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星,其工作原理如下图所示。

则该电池放电时通入H2O2的一极为
20-21高二上·江苏镇江·阶段练习 查看更多[1]
(已下线)【镇江新东方】高二上第二次月考
更新时间:2021-06-23 06:38:32
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】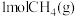 完全燃烧生成气态水的能量变化和
完全燃烧生成气态水的能量变化和 燃烧的能量变化如图所示。在催化剂作用下,
燃烧的能量变化如图所示。在催化剂作用下,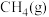 可以还原
可以还原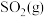 生成单质
生成单质 和
和 ,写出该反应的热化学方程式:
,写出该反应的热化学方程式:_______ 。
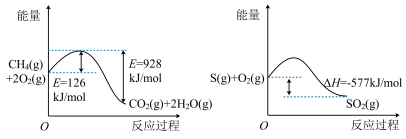
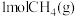 完全燃烧生成气态水的能量变化和
完全燃烧生成气态水的能量变化和 燃烧的能量变化如图所示。在催化剂作用下,
燃烧的能量变化如图所示。在催化剂作用下,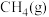 可以还原
可以还原 生成单质
生成单质 和
和 ,写出该反应的热化学方程式:
,写出该反应的热化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】请回答下列问题:
(1)已知2mol氢气燃烧生成液态水时放出572kJ的热量,反应方程式是2H2(g)+O2(g)=2H2O(l)。
①该反应的生成物能量总和__ (填“大于”、“小于”或“等于”)反应物能量总和。
②若2mol氢气完全燃烧生成水蒸气,则放出的热量___ (填“大于”、“小于”或“等于”)572 kJ。
(2)2.3g有机物C2H6O和一定量的氧气混合点燃,恰好完全燃烧,生成CO2和液态水,并放出68.35kJ热量,则该反应的热化学方程式是___ 。
(3)FeS2焙烧产生的SO2可用于制硫酸。已知25℃、101kPa时:
2SO2(g)+O2(g) 2SO3(g) ΔH1=-197 kJ·mol-1
2SO3(g) ΔH1=-197 kJ·mol-1
H2O(g)=H2O(l) ΔH2=-44kJ·mol-1
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) ΔH3=-545kJ·mol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是___ 。
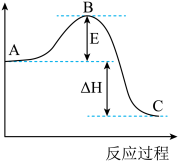
(4)2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。该反应通常用V2O5作催化剂,加V2O5会使图中B点
2SO3(g)反应过程的能量变化如图所示。该反应通常用V2O5作催化剂,加V2O5会使图中B点___ (填“升高”还是“降低”),△H___ (填“变大”、“变小”或“不变”)。
(5)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、___ 、量筒。量取反应物时,取50 mL 0.50 mol·L-1的盐酸,还需加入的试剂是___ (填序号)。
A.50 mL0.50mol·L-1NaOH溶液
B.50 mL0.55mol·L-1NaOH溶液
C.1.0gNaOH固体
(1)已知2mol氢气燃烧生成液态水时放出572kJ的热量,反应方程式是2H2(g)+O2(g)=2H2O(l)。
①该反应的生成物能量总和
②若2mol氢气完全燃烧生成水蒸气,则放出的热量
(2)2.3g有机物C2H6O和一定量的氧气混合点燃,恰好完全燃烧,生成CO2和液态水,并放出68.35kJ热量,则该反应的热化学方程式是
(3)FeS2焙烧产生的SO2可用于制硫酸。已知25℃、101kPa时:
2SO2(g)+O2(g)
 2SO3(g) ΔH1=-197 kJ·mol-1
2SO3(g) ΔH1=-197 kJ·mol-1H2O(g)=H2O(l) ΔH2=-44kJ·mol-1
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) ΔH3=-545kJ·mol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是
(4)2SO2(g)+O2(g)
 2SO3(g)反应过程的能量变化如图所示。该反应通常用V2O5作催化剂,加V2O5会使图中B点
2SO3(g)反应过程的能量变化如图所示。该反应通常用V2O5作催化剂,加V2O5会使图中B点
(5)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、
A.50 mL0.50mol·L-1NaOH溶液
B.50 mL0.55mol·L-1NaOH溶液
C.1.0gNaOH固体
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】 是一种重要的化工原料,在生产和生活中应用十分广泛。地康法制取氯气的反应为:
是一种重要的化工原料,在生产和生活中应用十分广泛。地康法制取氯气的反应为: 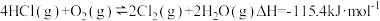 。该反应分两步进行,其基本原理如下图所示:
。该反应分两步进行,其基本原理如下图所示:
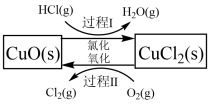
过程I的反应为,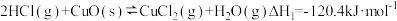
(])该原理中, 的作用是
的作用是_____________
(2)过程II反应的热化学方程式为____________
(3)压强为 时,地康法中
时,地康法中 的平衡转化率
的平衡转化率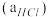 随温度变化曲线如图。
随温度变化曲线如图。
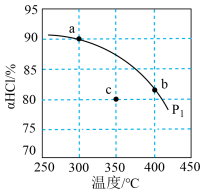
①平衡常数比较:K(a)____________ K(b)(填">“<"或“-").
②c点表示投料不变,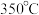 、压强为
、压强为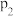 时,地康法中HCl的平衡转化率,则p2
时,地康法中HCl的平衡转化率,则p2_____________ p1(填“>”“<”或“=”),理由是___________ 。
 是一种重要的化工原料,在生产和生活中应用十分广泛。地康法制取氯气的反应为:
是一种重要的化工原料,在生产和生活中应用十分广泛。地康法制取氯气的反应为: 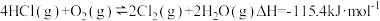 。该反应分两步进行,其基本原理如下图所示:
。该反应分两步进行,其基本原理如下图所示:
过程I的反应为,
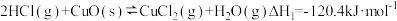
(])该原理中,
 的作用是
的作用是(2)过程II反应的热化学方程式为
(3)压强为
 时,地康法中
时,地康法中 的平衡转化率
的平衡转化率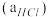 随温度变化曲线如图。
随温度变化曲线如图。
①平衡常数比较:K(a)
②c点表示投料不变,
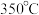 、压强为
、压强为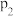 时,地康法中HCl的平衡转化率,则p2
时,地康法中HCl的平衡转化率,则p2
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】本题包括两小题,根据你所学的内容选择(1)或(2)其中一小题回答相关问题。
(1)在A图中,请加以必要连接__ (在图上画上),使铜片上冒H2气泡,则连接后的装置叫_____ ,该装置实现的能量转换是________________ 。
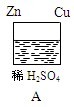
写出该装置的电极反应式:锌片:______________ ;铜片:_______________ ;
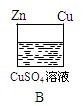
(2)在B图中,加以必要的连接__ (在图上画上),使锌片上析出铜,则连接后的装置叫______ ,该装置实现的能量转换是________________ 。写出该装置的电极反应式:锌片:_______________ ;铜片:________________ ;
(1)在A图中,请加以必要连接


写出该装置的电极反应式:锌片:
(2)在B图中,加以必要的连接
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】在如图所示的铜锌原电池中,以硫酸为电解质溶液,

(1)锌为___ 极,电极上发生的是__ 反应(填“氧化”或“还原”),电极反应式为___ 。
(2)铜为___ 极,电极上发生的是__ 反应(填“氧化”或“还原”),电极反应式是__ ;原电池总反应的离子方程式为__ 。

(1)锌为
(2)铜为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】如图是一个化学过程的示意图。已知甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O请回答:
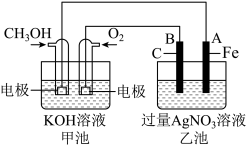
(1)甲池是_______ (填“原电池”或“电解池”),通入O2的电极作为_______ 极,该电极反应式为_______ 。
(2)乙池是_______ (填“原电池”或“电解池”),B电极名称为_______ 极,电极反应式为_______ 。
(3)甲池中溶液的pH_______ (填“增大”、“减小”或“不变”);乙池中溶液的pH_______ (填“增大”、“减小”或“不变”)。
(4)当乙池中A(Fe)极的质量增加5.40g时,电路中转移电子的物质的量是_______ mol,甲池中理论上消耗O2_______ mL(标准状况下)。

(1)甲池是
(2)乙池是
(3)甲池中溶液的pH
(4)当乙池中A(Fe)极的质量增加5.40g时,电路中转移电子的物质的量是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】(1)利用8NH3+6NO2=7N2+12H2O可以消除氮氧化物的污染,若设计成原电池,使用2mol·L-1的KOH溶液为电解质溶液。该电池正极的电极反应式为_______ ,放电一段时间后,负极附近溶液pH将_______ (填“增大”、“减小”或“不变”)。
(2)一种熔融碳酸盐燃料电池原理示意如图所示
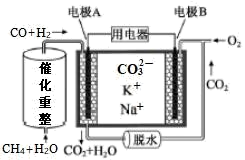
①写出催化重整的化学方程式_______ 。
②电池工作时, 向
向_______ (填A或B)极移动,电极A上H2参与的电极反应为:_______ 。
③用电器中每转移2mol电子,理论上电极B处消耗的气体体积(标准状况下)为_______ L。
(2)一种熔融碳酸盐燃料电池原理示意如图所示

①写出催化重整的化学方程式
②电池工作时,
 向
向③用电器中每转移2mol电子,理论上电极B处消耗的气体体积(标准状况下)为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】随着工业的发展,如何高效处理污水成为人类亟待解决的问题。
(1)利用原电池原理,酸性废水中的 在水处理剂(主要成分为铁粉、炭粉)表面的变化如图所示。
在水处理剂(主要成分为铁粉、炭粉)表面的变化如图所示。
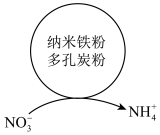
①图中,纳米铁粉作__________ (填“正极”或“负极”),多孔炭粉的作用为__________ 。
②正极上的电极反应式为__________ 。
(2)科研人员利用垃圾渗透液实现发电、环保二位一体,装置如图(a、b为离子交换膜)。
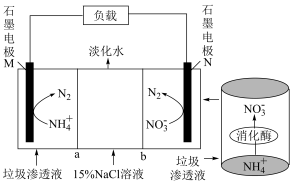
①石墨电极M上的电极反应式为__________ 。
②a为__________ (填“阴离子”或“阳离子”)交换膜。
③在放电过程中, 由中间室向
由中间室向__________ (填“M”或“N”)极室移动。
④理论上M极每处理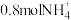 ,电路中通过的电子数为
,电路中通过的电子数为__________  。
。
(1)利用原电池原理,酸性废水中的
 在水处理剂(主要成分为铁粉、炭粉)表面的变化如图所示。
在水处理剂(主要成分为铁粉、炭粉)表面的变化如图所示。
①图中,纳米铁粉作
②正极上的电极反应式为
(2)科研人员利用垃圾渗透液实现发电、环保二位一体,装置如图(a、b为离子交换膜)。

①石墨电极M上的电极反应式为
②a为
③在放电过程中,
 由中间室向
由中间室向④理论上M极每处理
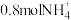 ,电路中通过的电子数为
,电路中通过的电子数为 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2SX)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:

(1)根据表数据,请你判断该电池工作的适宜应控制在___ (填字母)范围内。
(2)放电时,电极A为___ 极,电极B发生_____ 反应(填“氧化或还原”)。
(3)充电时,总反应为Na2Sx=2Na+xS,则阳极的电极反应式为:_______ 。
(4)若把钠硫电池作为电源,电解槽内装有KI及淀粉溶液如(如图)所示,槽内的中间用阴离子交换膜隔开。通电一段时间后,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。则右侧发生的电极方程式:___ ;试分析左侧溶液蓝色逐渐变浅的可能原因是:___ 。

(1)根据表数据,请你判断该电池工作的适宜应控制在
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
| A.100℃以下 | B.100~300℃ |
| C.300~350℃ | D.350~2050℃ |
(3)充电时,总反应为Na2Sx=2Na+xS,则阳极的电极反应式为:
(4)若把钠硫电池作为电源,电解槽内装有KI及淀粉溶液如(如图)所示,槽内的中间用阴离子交换膜隔开。通电一段时间后,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。则右侧发生的电极方程式:

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
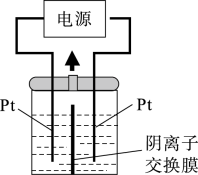
【推荐2】Ⅰ.如图所示,E为浸过含酚酞的Na2SO4溶液的滤纸。A、B分别为铂片,压在滤纸两端,R、S为电池的电极。M、N是用多微孔的Ni制成的电极,在碱溶液中可视为惰性电极。G为电流计,K为开关。C、D和电解池中都充满浓KOH溶液。若在滤纸中央滴一滴紫色的KMnO4溶液,将开关K打开,接通电源一段时间后,C、D中有气体产生。
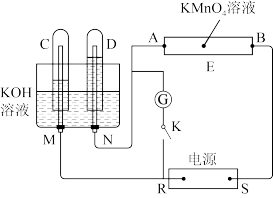
请回答下列问题:
(1)R为___________ (填“正”或“负”)极。
(2)通电一段时间后,M、N电极对应的电解质溶液的pH___________ (填“变大”、“变小”或“不变”);B附近发生的电极反应式为___________ 。
(3)滤纸上的紫色点向___________ (填“A”或“B”)方向移动。
(4)当C、D中的气体产生到一定量时,切断外电源并接通开关K,经过一段时间后,C、D中的气体逐渐减少,C中的电极为___________ (填“正”或“负”)极,电极反应式为___________ 。
Ⅱ.通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
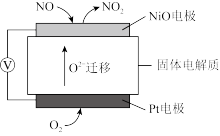
(5)Pt电极上发生的是___________ 反应(填“氧化”或“还原”)。
(6)写出NiO电极的电极反应式:___________ 。

请回答下列问题:
(1)R为
(2)通电一段时间后,M、N电极对应的电解质溶液的pH
(3)滤纸上的紫色点向
(4)当C、D中的气体产生到一定量时,切断外电源并接通开关K,经过一段时间后,C、D中的气体逐渐减少,C中的电极为
Ⅱ.通过NOx传感器可监测NOx的含量,其工作原理示意图如下:

(5)Pt电极上发生的是
(6)写出NiO电极的电极反应式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】纳米级Cu2O由于具有优良的催化性能而受到科学家的不断关注,下列为制取Cu2O的三种方法:
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是_________________________ 。
(2)方法Ⅱ利用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为______________________________ ;电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解,通过离子交换膜的阴离子的物质的量为________ mol。(离子交换膜只允许OH-通过)
(3)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制的Cu(OH)2来制备纳米级Cu2O,同时放出N2。生成1molN2时,生成Cu2O的物质的量为________________ 。
(4)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。写出肼-空气燃料电池放电时负极的电极反应式:___________________________ 。
| 方法Ⅰ | 用碳粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,原理为2Cu+H2O Cu2O+H2↑ Cu2O+H2↑ |
| 方法Ⅲ | 用肼(N2H4)还原新制的Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是
(2)方法Ⅱ利用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为

(3)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制的Cu(OH)2来制备纳米级Cu2O,同时放出N2。生成1molN2时,生成Cu2O的物质的量为
(4)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。写出肼-空气燃料电池放电时负极的电极反应式:
您最近一年使用:0次



