某兴趣小组的同学向一定体积的 溶液中逐滴加入稀硫酸,并测得混合溶液的导电能力随时间变化的曲线如图所示。该小组的同学关于如图的说法中正确的是
溶液中逐滴加入稀硫酸,并测得混合溶液的导电能力随时间变化的曲线如图所示。该小组的同学关于如图的说法中正确的是

 溶液中逐滴加入稀硫酸,并测得混合溶液的导电能力随时间变化的曲线如图所示。该小组的同学关于如图的说法中正确的是
溶液中逐滴加入稀硫酸,并测得混合溶液的导电能力随时间变化的曲线如图所示。该小组的同学关于如图的说法中正确的是
A.AB段溶液的导电能力不断减弱,说明生成的 不是电解质 不是电解质 |
B.B处溶液的导电能力为0,说明 不是电解质 不是电解质 |
C.a时刻 溶液与稀硫酸恰好完全中和, 溶液与稀硫酸恰好完全中和, 与 与 已完全沉淀 已完全沉淀 |
D.BC段溶液的导电能力不断增大,主要是由于过量的 电离出的离子导电 电离出的离子导电 |
20-21高一下·广东广州·期末 查看更多[3]
【定心卷】3.1.2 弱电解质的电离平衡随堂练习-人教版2023-2024学年选择性必修1(已下线)必考点04 弱电解质的电离-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版) 广东省广州市五校2020-2021学年高一下学期期末联考化学试题
更新时间:2021-07-12 12:49:31
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】已知HX、HY为一元弱酸且 ,MOH为一元弱碱。常温下,在含HX、HY、MNO3的混合溶液中滴加NaOH溶液,溶液中
,MOH为一元弱碱。常温下,在含HX、HY、MNO3的混合溶液中滴加NaOH溶液,溶液中 与pH的关系如图所示。下列叙述正确的是
与pH的关系如图所示。下列叙述正确的是
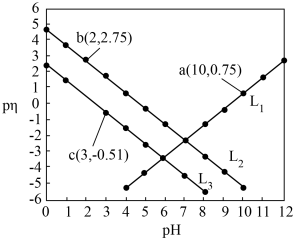
 ,MOH为一元弱碱。常温下,在含HX、HY、MNO3的混合溶液中滴加NaOH溶液,溶液中
,MOH为一元弱碱。常温下,在含HX、HY、MNO3的混合溶液中滴加NaOH溶液,溶液中 与pH的关系如图所示。下列叙述正确的是
与pH的关系如图所示。下列叙述正确的是
| A.L1代表HX |
B.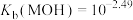 |
C. 的平衡常数K=10﹣2.26 的平衡常数K=10﹣2.26 |
D.MY溶液中, |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】常温下向100mL 0.1mol·L-1的CH3COOH溶液中逐滴加入0.1mol·L-1的NaOH溶液,所得溶液的pH随加入NaOH溶液的体积V的关系中不正确 的是

| A.往A点所示的溶液中加入少量HCl或NaOH,溶液的pH几乎不变 |
| B.A点溶液中:c(CH3COO-)-c(CH3COOH) =2×(10-4-10-10)mol·L-1 |
| C.对C点溶液加热 , c(CH3COOH) .c(OH-) /[c(CH3COO-).c(H+)]的值减小 |
| D.常温时,CH3COOH的电离常数为10-5 mol·L-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
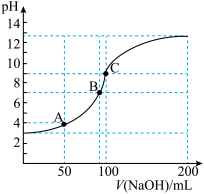
【推荐3】常温下,向某二元弱酸H2Y溶液中逐滴加入NaOH溶液,混合溶液中lg X[X为 或
或 ]与pH的变化关系如图所示。下列说法正确的是
]与pH的变化关系如图所示。下列说法正确的是
 或
或 ]与pH的变化关系如图所示。下列说法正确的是
]与pH的变化关系如图所示。下列说法正确的是
A.曲线I表示 随pH变化的关系曲线 随pH变化的关系曲线 |
| B.由图可知,H2Y的二级电离常数Ka2(H2Y)数量级为10-10 |
| C.从a点到b点过程中,水的电离程度先增大后减小 |
| D.NaHY溶液中的离子浓度大小为:c(Na+)>c(HY-)>c(OH-)>c(H+)>c(Y2-) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】强酸制弱酸非常重要的一种离子反应,已知:
下列离子反应不正确的有( )个
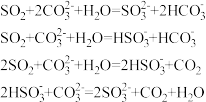
| Ka1 | Ka2 | |
| H2SO3 | 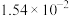 | 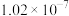 |
| H2CO3 | 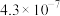 | 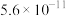 |
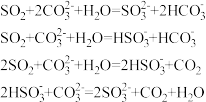
| A.0个 | B.1个 | C.2个 | D.3个 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】常温下,两种酸的电离平衡常数如表:
常温下,浓度均为0.1mol/L的下列溶液:①Na2SO3;②Na2CO3;③NaHSO3,下列有关说法正确的是
| 酸 | 电离常数K1 | 电离常数K2 |
| H2SO3 | 1.54×10-2 | 1.02×10-7 |
| H2CO3 | 4.3×10-7 | 5.6×10-11 |
| A.pH:Na2CO3溶液小于Na2SO3溶液 |
B.①与②溶液等体积混合后的溶液中:c(SO )>c(CO )>c(CO )>c(HCO )>c(HCO )>c(HSO )>c(HSO ) ) |
C.结合H+能力:CO 弱于SO 弱于SO |
D.NaHSO3溶液显酸性的原因是:NaHSO3=Na++H++SO |
您最近一年使用:0次



