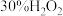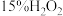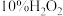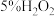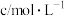是一种绿色试剂,在化学工业中用于生产过氧乙酸、亚氯酸钠等的原料,医药工业用作杀菌剂、消毒剂。某研究小组欲探究
是一种绿色试剂,在化学工业中用于生产过氧乙酸、亚氯酸钠等的原料,医药工业用作杀菌剂、消毒剂。某研究小组欲探究 的性质做了如下实验:
的性质做了如下实验:(1)下表是该小组研究影响
 分解速率的因素时采集的一组数据:用
分解速率的因素时采集的一组数据:用 制取
制取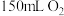 所需的时间(秒)。
所需的时间(秒)。浓度 时间 反应条件 |
|
|
|
|
无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
无催化剂、加热 | 360 | 480 | 540 | 720 |
| 10 | 25 | 60 | 120 |
(2)资料显示,某些金属离子对
 的分解起催化作用。研究小组猜想
的分解起催化作用。研究小组猜想 可以催化
可以催化 分解,于是做了以下探究。请你帮助小组完成实验报告:
分解,于是做了以下探究。请你帮助小组完成实验报告:| 实验过程 | 实验现象 | 实验结论 |
在一支试管中加入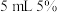 的 的 溶液,然后滴入适量的 溶液,然后滴入适量的 溶液,把带火星的木条伸入试管 溶液,把带火星的木条伸入试管 |  溶液可以催化 溶液可以催化 分解 分解 |
 在水中可电离出
在水中可电离出 和
和 ,同学们提出以下猜想。
,同学们提出以下猜想。甲同学的猜想:真正催化
 分解的是
分解的是 溶液中的
溶液中的 ;
;乙同学的猜想:真正催化
 分解的是
分解的是 溶液中的
溶液中的 ;
;丙同学的猜想:真正催化
 分解的是
分解的是 溶液中的
溶液中的 。
。你认为最不可能的是
(3)研究小组对余下的两个猜想通过实验进行了探究:向盛有
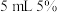 的
的 溶液的试管中加入少量的盐酸,并把带火星的木条伸入祓管,实验结果无明显现象,由此得出结论:
溶液的试管中加入少量的盐酸,并把带火星的木条伸入祓管,实验结果无明显现象,由此得出结论:(4)研究小组预测同为第四周期VIII族的
 、
、 也可能有相似的催化作用。查阅资料:
也可能有相似的催化作用。查阅资料: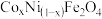 (其中
(其中 、
、 均为+2价)也可用作
均为+2价)也可用作 分解的催化剂,具有较高的活性。如图表示两种不同方法制得的催化剂
分解的催化剂,具有较高的活性。如图表示两种不同方法制得的催化剂 在10℃时催化分解5%的
在10℃时催化分解5%的 溶液的相对初始速率随x变化曲线。由图中信息可知
溶液的相对初始速率随x变化曲线。由图中信息可知 、
、 两种离子中催化效果更好的是
两种离子中催化效果更好的是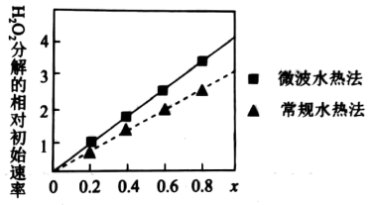
更新时间:2021-07-12 12:31:39
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的离子方程式有_______________________________ ;
(2)硫酸铜溶液可以加快氢气生成速率的原因是__________________________ ;
(3)要加快上述实验中气体产生的速率,还可采取的措施有______________ (答两种);
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
①请完成此实验设计,其中:V1=_______ ,V6=________ ,V7=________ ,V9=________ ;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:___________________________________________ 。
(1)上述实验中发生反应的离子方程式有
(2)硫酸铜溶液可以加快氢气生成速率的原因是
(3)要加快上述实验中气体产生的速率,还可采取的措施有
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol·L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1=
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:
您最近一年使用:0次
【推荐2】CH4—CO2重整技术是利用CH4处理CO2并获得CO和H2,重整反应为:CH4(g)+CO2(g)⇌ 2CO(g)+2H2(g) ΔH 。回答下列问题:
(1)已知:
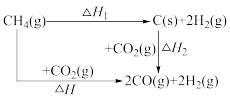
ΔH1=a ΔH2=b,则ΔH=_______ (用a、b表示),若ΔH1和ΔH2均大于0,则重整反应在_______ (填“高温”或“低温”或“任意温度”)下能自发进行。
(2)已知,重整反应Kc与温度(T)的关系如图,则ΔH_______ 0(填“>”、“<”或“=”),判断的理由是_______ 。

(3)采用“HSD—2型”催化剂时,该重整反应的速率方程为v正 = k·p(CH4) [p(CH4)表示CH4气体分压、k为速率常数],下列说法正确的是_______(填标号)。
(4)在t℃、初始压强为p=100 kPa,将CH4和CO2按投料比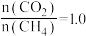 加入恒容容器中,发生重整反应,当反应达平衡时CH4的转化率为80%,CO2的转化率为90%。经分析,该容器中同时发生了副反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),则平衡时H2和H2O的物质的量之比为
加入恒容容器中,发生重整反应,当反应达平衡时CH4的转化率为80%,CO2的转化率为90%。经分析,该容器中同时发生了副反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),则平衡时H2和H2O的物质的量之比为_______ ,该温度下,重整反应的压强平衡常数为Kp=_______ (kPa) 2(列出计算式。用各气体平衡分压替代平衡浓度计算,分压=总压×物质的量分数)。若温度、压强和投料比一定,为了提高重整反应的速率和H2的选择性,可采取的措施是_______ 。
(5)工业上已实现利用H2处理废水中的氮氧化合物,如图所示。该电池正极的电极反应式为_______ 。

(1)已知:

ΔH1=a ΔH2=b,则ΔH=
(2)已知,重整反应Kc与温度(T)的关系如图,则ΔH

(3)采用“HSD—2型”催化剂时,该重整反应的速率方程为v正 = k·p(CH4) [p(CH4)表示CH4气体分压、k为速率常数],下列说法正确的是_______(填标号)。
| A.改变催化剂,ΔH不变 | B.升高温度,v正 增大 |
| C.增大CO2的分压时,v正 变大 | D.在反应达到平衡时,v正 =0 |
(4)在t℃、初始压强为p=100 kPa,将CH4和CO2按投料比
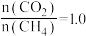 加入恒容容器中,发生重整反应,当反应达平衡时CH4的转化率为80%,CO2的转化率为90%。经分析,该容器中同时发生了副反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),则平衡时H2和H2O的物质的量之比为
加入恒容容器中,发生重整反应,当反应达平衡时CH4的转化率为80%,CO2的转化率为90%。经分析,该容器中同时发生了副反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),则平衡时H2和H2O的物质的量之比为(5)工业上已实现利用H2处理废水中的氮氧化合物,如图所示。该电池正极的电极反应式为

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(1)表中V1=___________ mL,V2=___________ mL。
(2)探究温度对化学反应速率影响的实验编号是___________ (填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是___________ 。
(3)除通过测定酸性KMnO4溶液褪色所需时间来比较反应速率外,本实验还可通过测定______ 来比较化学反应速率。
(4)小组同学发现反应速率总是如图所示,其中t5~t6时间内速率变快的主要原因可能是①产物Mn2+是该反应的催化剂、②___________ 。
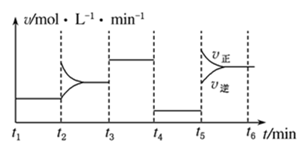
(5)实验①测得KMnO4溶液的褪色时间为2 min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=___________ mol·L-1·min-1。
| 实验编号 | 实验温度/°C | 0. 1mol·L-1酸性KMnO4溶液的体积/mL | 0.6mol·L-1H2C2O4溶液的体积/mL | H2O的体积/mL | 溶液褪色所需时间/min |
| ① | 25 | 10 | 10 | 30 | |
| ② | 50 | 10 | 10 | V1 | |
| ③ | 25 | 10 | V2 | 35 |
(2)探究温度对化学反应速率影响的实验编号是
(3)除通过测定酸性KMnO4溶液褪色所需时间来比较反应速率外,本实验还可通过测定
(4)小组同学发现反应速率总是如图所示,其中t5~t6时间内速率变快的主要原因可能是①产物Mn2+是该反应的催化剂、②

(5)实验①测得KMnO4溶液的褪色时间为2 min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】电池级碳酸锂是制造LiCoO2等锂离子电池必不可少的原材料。以锂云母浸出液(含Li+、Al3+、Fe3+、Ca2+、 等)制取电池级Li2CO3的工艺流程如下:
等)制取电池级Li2CO3的工艺流程如下:
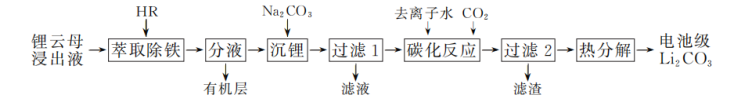
已知:①HR为酸性磷类有机萃取剂,难溶于水,可萃取Fe3+,萃取时发生反应:Fe3++3HR⇌FeR3+3H+,生成的FeR3可溶解在HR中。
②Li2CO3、LiHCO3的溶解度如图1所示:

(1)HR萃取剂使用前先用一定量的NaOH进行处理的目的是___________ 。
(2)沉锂过程中会有Li2CO3、CaCO3和Al(OH)3生成。写出沉锂时生成Al(OH)3反应的离子方程式:___________ 。
(3)过滤1后所得沉淀用热水洗涤的目的是___________ 。
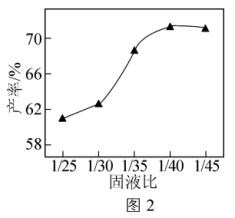
(4)其他条件相同,向过滤1所得滤渣加入不同体积的去离子水,以一定流速通入CO2气体,测得热分解后电池级Li2CO3的产率随碳化反应固液比[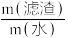 ]变化曲线如图2所示。Li2CO3产率随固液比减小而增加的原因是
]变化曲线如图2所示。Li2CO3产率随固液比减小而增加的原因是___________ 。
 等)制取电池级Li2CO3的工艺流程如下:
等)制取电池级Li2CO3的工艺流程如下:
已知:①HR为酸性磷类有机萃取剂,难溶于水,可萃取Fe3+,萃取时发生反应:Fe3++3HR⇌FeR3+3H+,生成的FeR3可溶解在HR中。
②Li2CO3、LiHCO3的溶解度如图1所示:

(1)HR萃取剂使用前先用一定量的NaOH进行处理的目的是
(2)沉锂过程中会有Li2CO3、CaCO3和Al(OH)3生成。写出沉锂时生成Al(OH)3反应的离子方程式:
(3)过滤1后所得沉淀用热水洗涤的目的是
(4)其他条件相同,向过滤1所得滤渣加入不同体积的去离子水,以一定流速通入CO2气体,测得热分解后电池级Li2CO3的产率随碳化反应固液比[
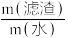 ]变化曲线如图2所示。Li2CO3产率随固液比减小而增加的原因是
]变化曲线如图2所示。Li2CO3产率随固液比减小而增加的原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】高锰酸钾( )是化学实验中一种常用试剂.
)是化学实验中一种常用试剂.
I.某研究性学习小组利用 溶液和酸性
溶液和酸性 溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验方案如下:
溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验方案如下:
(1)实验①与②可探究__________ 对化学反应速率的影响,且
_______ mL.
(2)某同学在探究“反应物浓度对反应速率影响”的平行实验中,保持 溶液浓度不变,将
溶液浓度不变,将 溶液的浓度设计为变量.该实验设计是否合理并说明原因:
溶液的浓度设计为变量.该实验设计是否合理并说明原因:____ 。
(3)实验①测得 溶液的褪色时间为40s,忽略混合前后溶液体积的变化,则此段时间内
溶液的褪色时间为40s,忽略混合前后溶液体积的变化,则此段时间内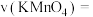
________  .
.
II. 溶液常用作氧化还原滴定的标准液.某实验小组欲测定某样品中
溶液常用作氧化还原滴定的标准液.某实验小组欲测定某样品中 的含量,某同学设计如下实验:
的含量,某同学设计如下实验:
①称取样品ag,加水溶解,配制成 溶液.
溶液.
②取 溶液于锥形瓶中,用
溶液于锥形瓶中,用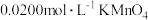 标准溶液(酸性)进行滴定,滴定结束后消耗
标准溶液(酸性)进行滴定,滴定结束后消耗 溶液
溶液 .
.
(4)滴定过程中发生反应的离子方程式为_________________ ;
(5)滴定终点的现象是:___________________________ ;
(6)测得该样品中 的质量分数为
的质量分数为______________ ;
(7)下列操作中可能使测定结果偏低的是_________ (填字母)
A.酸式滴定管未用标准 溶液进行润洗
溶液进行润洗
B.酸式滴定管尖嘴在滴定前没有气泡,滴定后有气泡
C.锥形瓶中残留少量蒸馏水
D.读数时,开始俯视读数,滴定结束时仰视读数
 )是化学实验中一种常用试剂.
)是化学实验中一种常用试剂.I.某研究性学习小组利用
 溶液和酸性
溶液和酸性 溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验方案如下:
溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验方案如下:实验序号 | 实验温度/K | 参加反应的物质 | ||||
|
|
| ||||
|
|
|
|
| ||
① | 293 | 2 | 0.02 | 4 | 0.1 | 0 |
② |
| 2 | 0.02 | 3 | 0.1 |
|
③ | 313 | 2 | 0.02 |
| 0.1 |
|

(2)某同学在探究“反应物浓度对反应速率影响”的平行实验中,保持
 溶液浓度不变,将
溶液浓度不变,将 溶液的浓度设计为变量.该实验设计是否合理并说明原因:
溶液的浓度设计为变量.该实验设计是否合理并说明原因:(3)实验①测得
 溶液的褪色时间为40s,忽略混合前后溶液体积的变化,则此段时间内
溶液的褪色时间为40s,忽略混合前后溶液体积的变化,则此段时间内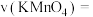
 .
.II.
 溶液常用作氧化还原滴定的标准液.某实验小组欲测定某样品中
溶液常用作氧化还原滴定的标准液.某实验小组欲测定某样品中 的含量,某同学设计如下实验:
的含量,某同学设计如下实验:①称取样品ag,加水溶解,配制成
 溶液.
溶液.②取
 溶液于锥形瓶中,用
溶液于锥形瓶中,用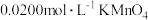 标准溶液(酸性)进行滴定,滴定结束后消耗
标准溶液(酸性)进行滴定,滴定结束后消耗 溶液
溶液 .
.(4)滴定过程中发生反应的离子方程式为
(5)滴定终点的现象是:
(6)测得该样品中
 的质量分数为
的质量分数为(7)下列操作中可能使测定结果偏低的是
A.酸式滴定管未用标准
 溶液进行润洗
溶液进行润洗B.酸式滴定管尖嘴在滴定前没有气泡,滴定后有气泡
C.锥形瓶中残留少量蒸馏水
D.读数时,开始俯视读数,滴定结束时仰视读数
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】汽车尾气中含有CO、NO、NO2等多种污染物。
(1)在汽车的排气管上装一个催化转换装置,能使CO和NO反应生成无污染的气体,写出该反应的化学方程式_____
(2)研究表明:增大催化剂(相同质量下比较)比表面积可提高化学反应速率,为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某科研小组设计了三组实验,部分实验条件已经填在下面实验设计表中。
请在上表格中填入剩余的实验条件数据,三组实验中的反应速率由快到慢的顺序为______ (填实验编号)
(3)大众"检测门"事件让"尿素可用于汽车尾气脱氮”又科普了一把,其反应原理为:NO+NO2+H2O=2HNO2
2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O
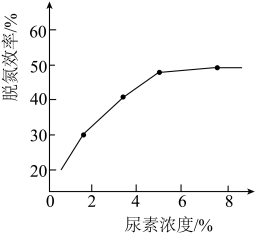
① 图为尿素含量对脱氮效率的影响,一般选择尿素浓度约5%左右,其原因是_______
②当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO):V(NO2)=3:1时,可通入一定量的空气,同温同压下,V(空气):V(NO2)=_____ (空气中氧气的体积含量大约为 20%)
(1)在汽车的排气管上装一个催化转换装置,能使CO和NO反应生成无污染的气体,写出该反应的化学方程式
(2)研究表明:增大催化剂(相同质量下比较)比表面积可提高化学反应速率,为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某科研小组设计了三组实验,部分实验条件已经填在下面实验设计表中。
| 实验编号 | T/℃ | CO 初始浓度/mol·L-1 | NO 初始浓度/mol·L-1 | 催化剂的比表面积/m²·g-1 |
| Ⅰ | 300 | 4.5×10-3 | 1.5×10-3 | 100 |
| Ⅱ | 4.5×10-3 | 1.5×10-3 | 200 | |
| Ⅲ | 500 | 4.5×10-3 | 200 |
请在上表格中填入剩余的实验条件数据,三组实验中的反应速率由快到慢的顺序为
(3)大众"检测门"事件让"尿素可用于汽车尾气脱氮”又科普了一把,其反应原理为:NO+NO2+H2O=2HNO2
2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O

① 图为尿素含量对脱氮效率的影响,一般选择尿素浓度约5%左右,其原因是
②当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO):V(NO2)=3:1时,可通入一定量的空气,同温同压下,V(空气):V(NO2)=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】随着技术进步,纳米材料得到厂泛制备和应用。在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙。下图为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题。(已知NH3极易落于水,水溶液呈碱性)
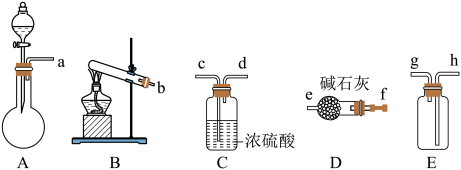
(1)实验室若用NH4CI固体和熟石灰作试剂来制取、收集干燥NH3,请从上图中选择合适装置按气流方向连接各仪器接口_______ 。
(2)利用下图甲装置进行实验时,向浓CaCl2溶液中通入NH3和CO2,需要先从_______ (选填“a”、“b”或“c”)导管通入_______ 气体(填化学式)。有同学建议在甲装置的b管末端连接乙装置,理由是_______ 。
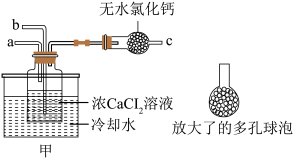
(3)写出制纳米级碳酸钙的化学方程式:_______ 。

(1)实验室若用NH4CI固体和熟石灰作试剂来制取、收集干燥NH3,请从上图中选择合适装置按气流方向连接各仪器接口
(2)利用下图甲装置进行实验时,向浓CaCl2溶液中通入NH3和CO2,需要先从

(3)写出制纳米级碳酸钙的化学方程式:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】工业上利用某地碳酸锰矿(成分及含量如表)制备硫酸锰,其工艺流程如图:

已知:该碳酸锰矿的成分及含量如表。
请回答下列问题:
(1)“酸浸”前适当粉碎碳酸锰矿的目的是_______ ;若颗粒太细,则硫酸容易浸透,随后剧烈反应产生 、水汽等悬浮在表层,导致冒槽,除影响操作外还会
、水汽等悬浮在表层,导致冒槽,除影响操作外还会_______ ; 的第三电离能大于
的第三电离能大于 的第三电离能,分析其原因:
的第三电离能,分析其原因:_______ 。
(2)“溶渣”的主要成分为_______ (填化学式)。
(3)“酸浸”中 被溶解的离子方程式为
被溶解的离子方程式为_______ 。
(4)“酸浸”过程中的浸出率 与矿酸比、浸出温度的关系如图所示:
与矿酸比、浸出温度的关系如图所示:

最适宜的矿酸比、浸出温度分别为_______ 、_______ 。
(5)“除铝铁”中加入 的目的是
的目的是_______ 。加入氨水调节 时,
时, 与铝铁去除率、锰损失率的关系如图所示,则应调节的
与铝铁去除率、锰损失率的关系如图所示,则应调节的 范围为
范围为_______ (填标号)。
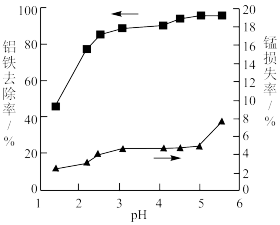
A.1.5~2 B.2.5~3 C.3~4 D.4.5~5

已知:该碳酸锰矿的成分及含量如表。
| 成分 |  |  |  |  |  |  |  |  元素化合物及其他杂质 元素化合物及其他杂质 |
| 含量/% | 18.06 | 10.32 | 12.54 | 2.60 | 11.48 | 12.42 | 10.24 | 22.34 |
请回答下列问题:
(1)“酸浸”前适当粉碎碳酸锰矿的目的是
 、水汽等悬浮在表层,导致冒槽,除影响操作外还会
、水汽等悬浮在表层,导致冒槽,除影响操作外还会 的第三电离能大于
的第三电离能大于 的第三电离能,分析其原因:
的第三电离能,分析其原因:(2)“溶渣”的主要成分为
(3)“酸浸”中
 被溶解的离子方程式为
被溶解的离子方程式为(4)“酸浸”过程中的浸出率
 与矿酸比、浸出温度的关系如图所示:
与矿酸比、浸出温度的关系如图所示:
最适宜的矿酸比、浸出温度分别为
(5)“除铝铁”中加入
 的目的是
的目的是 时,
时, 与铝铁去除率、锰损失率的关系如图所示,则应调节的
与铝铁去除率、锰损失率的关系如图所示,则应调节的 范围为
范围为
A.1.5~2 B.2.5~3 C.3~4 D.4.5~5
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】硫酸是当今世界上最重要的化工产品之一,硫酸在生产中具有广泛的应用。
(1)某同学用如图所示的装置,完成铜与浓硫酸反应的实验:
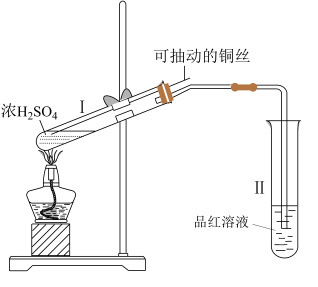
①试管II中的现象是___ 。
②试管Ⅰ中发生反应的化学方程式是___ 。
③请你指出该实验装置的不足之处___ 。
(2)在实际应用中,人们常根据需要,把浓硫酸稀释成不同浓度的稀硫酸。现用18.4mol·L-1的浓H2SO4配制100mL1.00mol·L-1的稀H2SO4。
①用量筒量取浓硫酸的体积是___ mL。
②下列操作会使所配溶液浓度偏低的是___ 。
A.将溶液转移到未干燥的容量瓶中
B.转移时,忘记洗涤烧杯和玻璃棒
C.将未冷却的溶液转移到容量瓶中
D.定容时,仰视刻度线
(1)某同学用如图所示的装置,完成铜与浓硫酸反应的实验:

①试管II中的现象是
②试管Ⅰ中发生反应的化学方程式是
③请你指出该实验装置的不足之处
(2)在实际应用中,人们常根据需要,把浓硫酸稀释成不同浓度的稀硫酸。现用18.4mol·L-1的浓H2SO4配制100mL1.00mol·L-1的稀H2SO4。
①用量筒量取浓硫酸的体积是
②下列操作会使所配溶液浓度偏低的是
A.将溶液转移到未干燥的容量瓶中
B.转移时,忘记洗涤烧杯和玻璃棒
C.将未冷却的溶液转移到容量瓶中
D.定容时,仰视刻度线
您最近一年使用:0次