(I)某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00mL,大理石用量为10.00g。
(1)请完成实验设计表,并在实验目的一栏中填空:a___________ ,e___________ 。
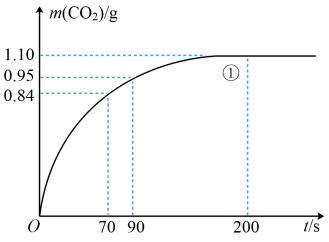
(2)实验①中CO2质量随时间变化的关系如图。计算实验①中70s~90s范围内用HNO3表示的平均反应速率___________ mol·L-1·s-1(忽略溶液体积变化,不需要写出计算过程)。在0~70、70~90、90~200各相同的时间段里,反应速率最大的时间段是___________ 。
(II)某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(3)表中V1=___________ mL。
(4)探究温度对化学反应速率影响的实验编号是___________ (填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是___________ 。
(5)实验①测得KMnO4溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=___________ mol·L-1·min-1。
| 实验编号 | 温度(℃) | 大理石规格 | HNO3浓度(mol/L) | 实验目的 |
| ① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响; (Ⅱ)实验①和③探究温度对反应速率的影响; (Ⅲ)实验①和④探究e___________对反应速率的影响 |
| ② | 25 | 粗颗粒 | a___________ | |
| ③ | b___________ | 粗颗粒 | 2.00 | |
| ④ | c___________ | 细颗粒 | d___________ |
(2)实验①中CO2质量随时间变化的关系如图。计算实验①中70s~90s范围内用HNO3表示的平均反应速率

(II)某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
| 实验编号 | 0.1mol·L-1酸性KMnO4溶液的体积/mL | 0.6mol·L-1H2C2O4溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液褪色所需时间/min |
| ① | 10 | V1 | 35 | 25 | |
| ② | 10 | 10 | 30 | 25 | |
| ③ | 10 | 10 | V2 | 50 |
(4)探究温度对化学反应速率影响的实验编号是
(5)实验①测得KMnO4溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=
20-21高一下·黑龙江哈尔滨·期末 查看更多[3]
黑龙江省哈尔滨市第六中学2020-2021学年高一下学期期末考试化学试题(已下线)2.1.2 影响化学反应速率的因素-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)天津北京师范大学静海附属学校2021-2022学年高二上学期第一次调研测试化学试题
更新时间:2021-07-14 20:10:24
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】I.硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。
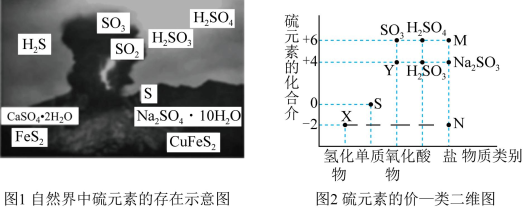
(1)图1中与图2中M、N对应的物质分别是____ 、____ 。
(2)X与Y反应中氧化剂与还原剂的物质的量之比为____ 。
(3)SO2和氯水都有漂白性,为了增强漂白效果,有人将氯水和SO2混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因为____ 。
II.为探究影响H2O2分解速率的因素,设计如表实验:
(4)实验①③研究的是____ 对H2O2分解速率的影响。
(5)记录实验①在第5min时收集到气体22.4mL(已折算成标准状况),则5min内,v(H2O2)=____ 。
(6)实验①②研究的是____ 对H2O2分解速率的影响。
(7)若向0.4mol/LH2O2中加入少量KI,H2O2的分解机理为:
第一步:H2O2+I-→H2O+IO-
第二步:H2O2+IO-→H2O+O2+I-
据此说明KI在H2O2的分解中起____ 作用。

(1)图1中与图2中M、N对应的物质分别是
(2)X与Y反应中氧化剂与还原剂的物质的量之比为
(3)SO2和氯水都有漂白性,为了增强漂白效果,有人将氯水和SO2混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因为
II.为探究影响H2O2分解速率的因素,设计如表实验:
| 编号 | 温度 | c(H2O2)/mol·L−1 | V(H2O2)/mL | 催化剂 |
| ① | 20℃ | 0.4 | 10 | 无 |
| ② | 20℃ | 0.8 | 10 | 无 |
| ③ | 30℃ | 0.4 | 10 | 无 |
| ④ | 30℃ | 0.4 | 10 | MnO2 |
(5)记录实验①在第5min时收集到气体22.4mL(已折算成标准状况),则5min内,v(H2O2)=
(6)实验①②研究的是
(7)若向0.4mol/LH2O2中加入少量KI,H2O2的分解机理为:
第一步:H2O2+I-→H2O+IO-
第二步:H2O2+IO-→H2O+O2+I-
据此说明KI在H2O2的分解中起
您最近一年使用:0次
【推荐2】I.有下列各组物质
A.O2和O3 B.12C和13C C.CH3—CH2—CH2—CH3和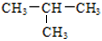 D.
D.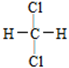 和
和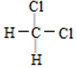 E.甲烷和庚烷
E.甲烷和庚烷
(1)___________ 组两物质互为同位素;
(2)___________ 组两物质互为同素异形体;
(3)___________ 组两物质属于同系物;
(4)___________ 组两物质互为同分异构体;
(5)___________ 组中两物质是同一物质。
Ⅱ.汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。为了模拟反应2NO(g)+2CO(g) ⇌N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如下表:
(1)前2s内的平均反应速率v(N2)=___________ 。
(2)反应达到平衡时CO的转化率为___________ 。
(3)下列条件的改变能使上述反应的速率加快的是___________ (填字母)。
A.降低温度 B.充入He C.移走部分CO D.使用催化剂
(4) 能说明上述反应达到平衡状态的是___________ (填字母)。
A.n(CO2)=2n(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变 D.容器内气体压强不变
(5)平衡时容器内压强为P平,开始时压强为P始,则P平∶P始=______
A.O2和O3 B.12C和13C C.CH3—CH2—CH2—CH3和
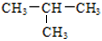 D.
D. 和
和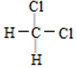 E.甲烷和庚烷
E.甲烷和庚烷(1)
(2)
(3)
(4)
(5)
Ⅱ.汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。为了模拟反应2NO(g)+2CO(g) ⇌N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/ (mol·L-1) | 10.0 | 8.0 | 7.0 | 6.2 | 4.0 | 4.0 |
| c(CO)/ (mol·L-1) | 8.0 | 6.0 | 5.0 | 4.2 | 2.0 | 2.0 |
(1)前2s内的平均反应速率v(N2)=
(2)反应达到平衡时CO的转化率为
(3)下列条件的改变能使上述反应的速率加快的是
A.降低温度 B.充入He C.移走部分CO D.使用催化剂
(4) 能说明上述反应达到平衡状态的是
A.n(CO2)=2n(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变 D.容器内气体压强不变
(5)平衡时容器内压强为P平,开始时压强为P始,则P平∶P始=
您最近一年使用:0次
填空题
|
适中
(0.65)
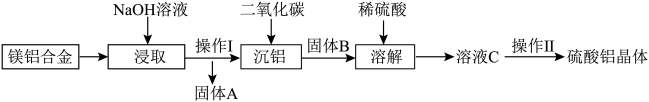
【推荐3】镁铝合金废料转化为硫酸铝晶体流程如下:
(1) 属于
属于________ (填“酸雨”或“温室效应”)气体。
(2)操作Ⅰ的名称为________ (填“过滤”或“分液”)。
(3)固体A的主要成分为________ (填“Mg”或“Al”)。
(4) 和
和 在一定条件下可转化为甲烷,其反应方程式为
在一定条件下可转化为甲烷,其反应方程式为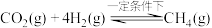
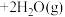 。一定条件下,将
。一定条件下,将
 和
和
 充入2L密闭容器中,10s后测得
充入2L密闭容器中,10s后测得 为0.6mol。则:
为0.6mol。则:
①0~10s内,用 表示该反应的平均反应速率为
表示该反应的平均反应速率为________  ;
;
②其他条件不变时,升高温度,该反应的反应速率将________ (填“增大”或“减小”)。
(1)
 属于
属于(2)操作Ⅰ的名称为
(3)固体A的主要成分为
(4)
 和
和 在一定条件下可转化为甲烷,其反应方程式为
在一定条件下可转化为甲烷,其反应方程式为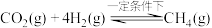
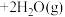 。一定条件下,将
。一定条件下,将
 和
和
 充入2L密闭容器中,10s后测得
充入2L密闭容器中,10s后测得 为0.6mol。则:
为0.6mol。则:①0~10s内,用
 表示该反应的平均反应速率为
表示该反应的平均反应速率为 ;
;②其他条件不变时,升高温度,该反应的反应速率将
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】一定温度下,在容积为VL的密闭容器中进行反应,M、N两种气体的物质的量随时间的变化曲线如图所示:
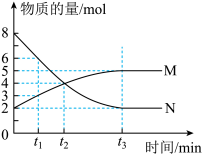
(1)该反应的化学反应方程式是_______ 。
(2)若达到平衡状态的时间是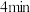 ,N物质在该
,N物质在该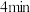 内的平均反应速率为
内的平均反应速率为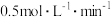 ,则此容器的容积为
,则此容器的容积为
_______ L。
(3)反应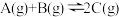 ,当改变下列条件时,会加快反应速率的是_______。
,当改变下列条件时,会加快反应速率的是_______。

(1)该反应的化学反应方程式是
(2)若达到平衡状态的时间是
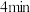 ,N物质在该
,N物质在该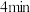 内的平均反应速率为
内的平均反应速率为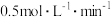 ,则此容器的容积为
,则此容器的容积为
(3)反应
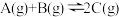 ,当改变下列条件时,会加快反应速率的是_______。
,当改变下列条件时,会加快反应速率的是_______。| A.降低温度 |
| B.保持容器的体积不变,充入氦气 |
| C.加入催化剂 |
D.保持容器的体积不变,增加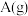 的物质的量 的物质的量 |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】某温度下,在2L密闭容器中,X、Y、Z三种气态物质发生化学反应时,物质的量随时间变化的关系曲线如图所示:
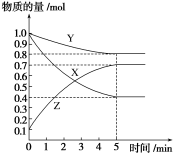
(1)由图中的数据分析,该反应的化学方程式为___________ 。
(2)5min内用Z和Y表示的平均反应速率分别为___________ 、___________ 。
(3)化学反应速率受到很多因素的影响,如___________ 、___________ 。在本实验室制取氢气时一般用粗锌替代纯锌和稀硫酸反应,这是利用___________ 原理加快了氢气生成的速率。

(1)由图中的数据分析,该反应的化学方程式为
(2)5min内用Z和Y表示的平均反应速率分别为
(3)化学反应速率受到很多因素的影响,如
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】Ⅰ.某温度时,在一个10 L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。
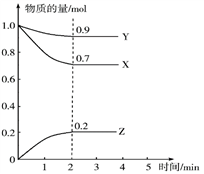
根据图中数据填空:
(1)该反应的化学方程式为_________________________________ 。
(2)反应开始至2 min,以气体Z表示的平均反应速率为____________________ 。
Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色。
(1)一定能证明2SO2(g)+O2(g) 2SO3(g)达到平衡状态的是
2SO3(g)达到平衡状态的是__________ (填序号,下同)。
(2)一定能证明I2(g) +H2(g) 2HI(g)达到平衡状态的是
2HI(g)达到平衡状态的是___________ 。

根据图中数据填空:
(1)该反应的化学方程式为
(2)反应开始至2 min,以气体Z表示的平均反应速率为
Ⅱ.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色。
(1)一定能证明2SO2(g)+O2(g)
 2SO3(g)达到平衡状态的是
2SO3(g)达到平衡状态的是(2)一定能证明I2(g) +H2(g)
 2HI(g)达到平衡状态的是
2HI(g)达到平衡状态的是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
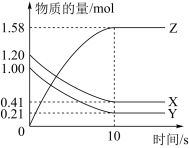
(1)写出该反应的化学方程式:___ 。
(2)列叙述中不能说明上述反应达到平衡状态的是___ 。
A.当X与Y的反应速率之比为1:1
B.在混合气体中X的质量百分数保持不变
C.混合气体的平均摩尔质量不随时间的变化而变化
D.混合气体的密度不随时间的变化而变化
E.X、Y、Z的浓度之比为1:1:2
(3)为使该反应的反应速率减小,可采取的措施是___ 。
A.恒压时充入Ne
B.适当升高温度
C.缩小容器的体积
D.选择高效催化剂

(1)写出该反应的化学方程式:
(2)列叙述中不能说明上述反应达到平衡状态的是
A.当X与Y的反应速率之比为1:1
B.在混合气体中X的质量百分数保持不变
C.混合气体的平均摩尔质量不随时间的变化而变化
D.混合气体的密度不随时间的变化而变化
E.X、Y、Z的浓度之比为1:1:2
(3)为使该反应的反应速率减小,可采取的措施是
A.恒压时充入Ne
B.适当升高温度
C.缩小容器的体积
D.选择高效催化剂
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】某温度时,在2 L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析可得:
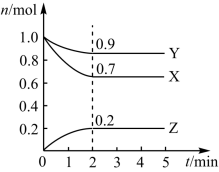
(1)该反应的化学方程式为_________ 。
(2)反应开始至2 min, X的转化率为____ 。
(3)在密闭容器里,通入a mol A(g)和b mol B(g),发生反应A(g)+ B(g)= 2C(g),当改变下列条件时,会加快反应速率的是________ (填序号)。
①降低温度 ②保持容器的体积不变,充入氦气
③加入催化剂 ④保持容器的体积不变,增加A(g)的物质的量

(1)该反应的化学方程式为
(2)反应开始至2 min, X的转化率为
(3)在密闭容器里,通入a mol A(g)和b mol B(g),发生反应A(g)+ B(g)= 2C(g),当改变下列条件时,会加快反应速率的是
①降低温度 ②保持容器的体积不变,充入氦气
③加入催化剂 ④保持容器的体积不变,增加A(g)的物质的量
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】利用催化技术可将汽车尾气中的 和
和 转化为
转化为 和
和 ,化学方程式:
,化学方程式:
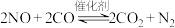 。
。
(1)某温度下,在容积不变的密闭容器中通入 和
和 ,测得不同时间
,测得不同时间 的浓度如下表:
的浓度如下表:
用 的浓度变化表示
的浓度变化表示 的平均反应速率为
的平均反应速率为___________ 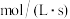 。
。
(2)下列可说明反应达到平衡状态的是___________ 。
a. 的浓度不再改变
的浓度不再改变
b.容器中的气体质量保持不变
c.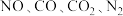 的浓度之比为2∶2∶2∶1
的浓度之比为2∶2∶2∶1
d.相同时间内,反应消耗 同时消耗
同时消耗
(3)反应物初始浓度相同时,实验温度为280℃和360℃,进行以下实验:
【实验分析与结论】
①补全表格a.___________ 。
b.___________ ,c.___________ 。
②测得 ,对比实验Ⅰ、Ⅲ,可得结论:催化剂的比表面积相同时,
,对比实验Ⅰ、Ⅲ,可得结论:催化剂的比表面积相同时,___________ 。
③通过实验可得到“温度相同时,增大催化剂的比表面积,可增大尾气的转化速率”的结论,证据是对比实验Ⅰ、Ⅱ,
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
 和
和 转化为
转化为 和
和 ,化学方程式:
,化学方程式: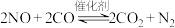 。
。(1)某温度下,在容积不变的密闭容器中通入
 和
和 ,测得不同时间
,测得不同时间 的浓度如下表:
的浓度如下表:| 时间/s | 0 | 1 | 2 | 3 | …… |
 | 3.60 | 3.05 | 2.85 | 2.75 | …… |
 的浓度变化表示
的浓度变化表示 的平均反应速率为
的平均反应速率为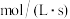 。
。(2)下列可说明反应达到平衡状态的是
a.
 的浓度不再改变
的浓度不再改变b.容器中的气体质量保持不变
c.
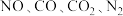 的浓度之比为2∶2∶2∶1
的浓度之比为2∶2∶2∶1d.相同时间内,反应消耗
 同时消耗
同时消耗
(3)反应物初始浓度相同时,实验温度为280℃和360℃,进行以下实验:
| 实验编号 | 实验目的 | T/℃ | 同种催化剂的比表面积 | 达平衡时所用的时间/s |
| Ⅰ | 对照实验 | 280 | 80 |  |
| Ⅱ | a | 280 | 120 |  |
| Ⅲ | 研究温度对尾气转化速率的影响 | b | c |  |
①补全表格a.
b.
②测得
 ,对比实验Ⅰ、Ⅲ,可得结论:催化剂的比表面积相同时,
,对比实验Ⅰ、Ⅲ,可得结论:催化剂的比表面积相同时,③通过实验可得到“温度相同时,增大催化剂的比表面积,可增大尾气的转化速率”的结论,证据是对比实验Ⅰ、Ⅱ,

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
(1)实验过程如下图所示,分析判断______ 段化学反应速率最快,这段反应速率最快的原因是______ 。
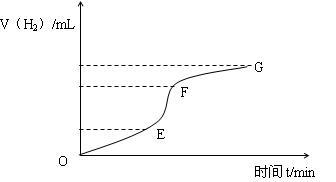
(2)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是( )
A.蒸馏水 B.氯化钠固体 C.氯化钠溶液 D.浓盐酸
(3)除了上述方法外,你认为还可以采取哪些措施来减缓化学反应速率?(回答一种即可)______ 。
(1)实验过程如下图所示,分析判断

(2)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是
A.蒸馏水 B.氯化钠固体 C.氯化钠溶液 D.浓盐酸
(3)除了上述方法外,你认为还可以采取哪些措施来减缓化学反应速率?(回答一种即可)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】某课外实验小组利用压强传感器、数据采集器和计算机等数字化实验设备,探究用0.1 g铁片分别与2 mL不同浓度稀盐酸的反应速率。实验结果如图所示。
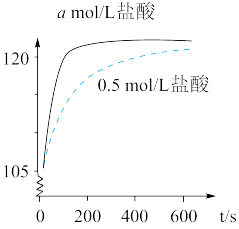
(1)铁与盐酸反应的离子方程式是________ 。
(2)a________ 0. 5 (填"〉”、“”或“=”)。
(3)如果用0. 5 mol/L硫酸代替上述实验中的0.5 mol/L盐酸,二者的反应速率是否相同,请说明原因:_____________ 。

(1)铁与盐酸反应的离子方程式是
(2)a
(3)如果用0. 5 mol/L硫酸代替上述实验中的0.5 mol/L盐酸,二者的反应速率是否相同,请说明原因:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】已知可逆反应aA2 +bB2 xX(反应物、生成物都是气体)。回答下列问题:
xX(反应物、生成物都是气体)。回答下列问题:
I.将一定量的两种反应物置于恒容绝热反应器中(与外部环境无热量交换的反应器),反应器内的温度与时间的关系如图:

(1)该反应是___ (填“吸”或“ 放”)热反应。
(2)下列关于该反应的叙述正确的是____ (填字母)。
a A点反应停止 b A点速率不为零
c 反应物的总能量大于生成物的 d B点正反应速率大于逆反应速率
II.将一定量的上述反应的反应物与生成物置于容积为2L的恒温恒容反应器中,反应器中各物质的物质的量与时间的关系如图:

(3)①反应前4 min物质x的物质的量的变化为_____ mol. .
②反应前4 min物质A2反应速率为_______
③该可逆反应的化学方程式为______ (物质X用A、B表示)。
④如果在4 min时升高反应体系的温度.则反应速率___ ( 填“增大“减小”或“不变")。
⑤如果在4min时加入2.4 mol Ne(Ne不参与该反应),则反应速率___ (填“增大”“减小”或“不变”)。
 xX(反应物、生成物都是气体)。回答下列问题:
xX(反应物、生成物都是气体)。回答下列问题:I.将一定量的两种反应物置于恒容绝热反应器中(与外部环境无热量交换的反应器),反应器内的温度与时间的关系如图:

(1)该反应是
(2)下列关于该反应的叙述正确的是
a A点反应停止 b A点速率不为零
c 反应物的总能量大于生成物的 d B点正反应速率大于逆反应速率
II.将一定量的上述反应的反应物与生成物置于容积为2L的恒温恒容反应器中,反应器中各物质的物质的量与时间的关系如图:

(3)①反应前4 min物质x的物质的量的变化为
②反应前4 min物质A2反应速率为
③该可逆反应的化学方程式为
④如果在4 min时升高反应体系的温度.则反应速率
⑤如果在4min时加入2.4 mol Ne(Ne不参与该反应),则反应速率
您最近一年使用:0次



