I.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图:
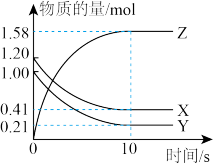
(1)从反应开始到10s时,用Z表示的反应速率为___________ ,X的物质的量浓度减少了___________ ,Y的转化率为___________ 。
(2)该反应的化学方程式为___________ 。
II.KI溶液在酸性条件下能与氧气反应。现有以下实验记录:回答下列问题:
(1)该反应的离子方程式为___________ 。
(2)该实验的目的是探究___________ 。
(3)实验试剂除了1mol·L-1KI溶液、0.1mol·L-1H2SO4溶液外,还需要的试剂是__ ;
(4)上述实验操作中除了需要(3)的条件外,还必须控制不变的是___________ (填字母)。
A.温度 B.试剂的浓度
C.试剂的用量(体积) D.试剂添加的顺序

(1)从反应开始到10s时,用Z表示的反应速率为
(2)该反应的化学方程式为
II.KI溶液在酸性条件下能与氧气反应。现有以下实验记录:回答下列问题:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度/℃ | 30 | 40 | 50 | 60 | 70 |
| 显色时间/s | 160 | 80 | 40 | 20 | 10 |
(1)该反应的离子方程式为
(2)该实验的目的是探究
(3)实验试剂除了1mol·L-1KI溶液、0.1mol·L-1H2SO4溶液外,还需要的试剂是
(4)上述实验操作中除了需要(3)的条件外,还必须控制不变的是
A.温度 B.试剂的浓度
C.试剂的用量(体积) D.试剂添加的顺序
20-21高二上·广东揭阳·阶段练习 查看更多[4]
(已下线)第06讲 影响化学反应速率的因素(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)(已下线)2.1.2 影响化学反应速率的因素(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)江苏省海安市南莫中学2021-2022学年高二上学期第一次月考备考金卷B卷化学试题广东省揭阳市揭西县河婆中学2020-2021学年高二上学期第一次月考化学试题
更新时间:2021-07-27 23:02:04
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】过硫酸(H2S2O8)是一种强酸,为无色晶体,易溶于水,在热水中易水解。过硫酸和过硫酸盐在工业上均可用作氧化剂。
(1)根据硫酸和过硫酸的结构式,可判断下列说法正确的是___________ (填标号)。
A.硫酸和过硫酸均为共价化合物
B.过硫酸分子中含有的化学键与过氧化钠的相同
C.过硫酸分子可看作2个硫酸分子脱去1个水分子
D.过硫酸可用于工业漂白、外科消毒等领域
(2)工业上利用过硫酸铵制备过氧化氢的一种方法如图。
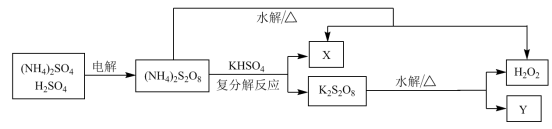
①Y为___________ (填化学式)。
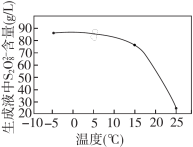
②其他条件一定,电解相同时间后,测得生成液中 的含量随温度变化的关系如图。电解时通常控制温度在15℃,不用更低温度的原因是
的含量随温度变化的关系如图。电解时通常控制温度在15℃,不用更低温度的原因是___________ 。
(3)氮氧化物是大气主要污染物,可采用强氧化剂氧化脱除、热分解等方法处理。

①“反应1”的离子方程式为___________ 。
②“反应2”为 +
+ +2OH-
+2OH-
 +2
+2 +H2O。不同温度下,达到平衡时
+H2O。不同温度下,达到平衡时 的脱除率与过硫酸钠(Na2S2O8)初始浓度的关系如图所示。(NO2的初始浓度相同)
的脱除率与过硫酸钠(Na2S2O8)初始浓度的关系如图所示。(NO2的初始浓度相同)
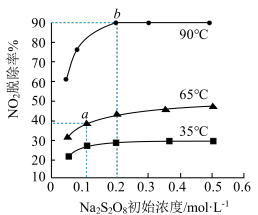
比较a、b点的反应速率: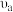
___________ (填“>”“<”或“一”) 。
。
(4)过硫酸钾氧化法可用于分析锰钢中Mn元素的含量:取锰钢样品ag,加入过量浓硝酸,在加热条件下将Mn溶出,再用bL过硫酸钾溶液将溶出的Mn2+全部转化为 ,检测
,检测 浓度,计算得出样品中Mn元素的质量分数为
浓度,计算得出样品中Mn元素的质量分数为 。
。
①该实验条件下氧化性:
___________ (填“>”或“<”) 。
。
②该过程中过硫酸钾溶液的浓度至少是___________ (用含a、b、 的代数式表示)mol·L-1。
的代数式表示)mol·L-1。
| 物质 | 硫酸 | 过硫酸 |
| 结构式 | 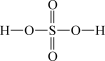 | 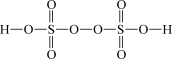 |
A.硫酸和过硫酸均为共价化合物
B.过硫酸分子中含有的化学键与过氧化钠的相同
C.过硫酸分子可看作2个硫酸分子脱去1个水分子
D.过硫酸可用于工业漂白、外科消毒等领域
(2)工业上利用过硫酸铵制备过氧化氢的一种方法如图。

①Y为
②其他条件一定,电解相同时间后,测得生成液中
 的含量随温度变化的关系如图。电解时通常控制温度在15℃,不用更低温度的原因是
的含量随温度变化的关系如图。电解时通常控制温度在15℃,不用更低温度的原因是
(3)氮氧化物是大气主要污染物,可采用强氧化剂氧化脱除、热分解等方法处理。

①“反应1”的离子方程式为
②“反应2”为
 +
+ +2OH-
+2OH-
 +2
+2 +H2O。不同温度下,达到平衡时
+H2O。不同温度下,达到平衡时 的脱除率与过硫酸钠(Na2S2O8)初始浓度的关系如图所示。(NO2的初始浓度相同)
的脱除率与过硫酸钠(Na2S2O8)初始浓度的关系如图所示。(NO2的初始浓度相同)
比较a、b点的反应速率:
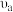
 。
。(4)过硫酸钾氧化法可用于分析锰钢中Mn元素的含量:取锰钢样品ag,加入过量浓硝酸,在加热条件下将Mn溶出,再用bL过硫酸钾溶液将溶出的Mn2+全部转化为
 ,检测
,检测 浓度,计算得出样品中Mn元素的质量分数为
浓度,计算得出样品中Mn元素的质量分数为 。
。①该实验条件下氧化性:

 。
。②该过程中过硫酸钾溶液的浓度至少是
 的代数式表示)mol·L-1。
的代数式表示)mol·L-1。
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】一碳化学是以分子中只含一个碳原子的化合物为原料生产化工产品的方法。合成气(CO和H2的混合气体)是一碳化学的重要原料,焦炭与水蒸气在恒容密闭容器中会发生如下三个反应:
I.
Ⅱ.
Ⅲ.
(1)当反应I达到平衡后,下列措施可提高正反应速率的是___________。(填标号)。
(2)若在恒温恒容容器中仅发生反应Ⅱ,则下列能说明反应达到平衡状态的是___________。
(3)在体积为1L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应Ⅲ。
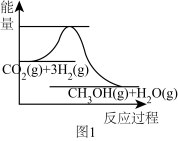
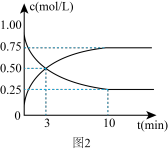
①图1表示该反应进行过程中能量的变化,则该反应是___________ (填“吸热”或“放热”)反应。
②反应过程中测得CO2和CH3OH(g)的浓度随时间变化如图2所示:3 min时的正反应速率___________ (填“>”,“=”或“<”)逆反应速率,从反应开始到第10 min,氢气的平均反应速率v(H2)=___________ 。
I.

Ⅱ.

Ⅲ.

(1)当反应I达到平衡后,下列措施可提高正反应速率的是___________。(填标号)。
| A.加入焦炭 | B.通入CO | C.升高温度 | D.分离出氢气 |
(2)若在恒温恒容容器中仅发生反应Ⅱ,则下列能说明反应达到平衡状态的是___________。
| A.容器内气体的压强不变 |
| B.容器内气体的总质量不变 |
| C.容器内气体的平均相对分子质量不变 |
| D.单位时间内,每有2 mol O-H键断裂,同时有1 mol H-H键断裂 |
(3)在体积为1L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应Ⅲ。

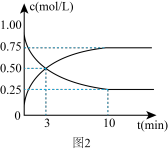
①图1表示该反应进行过程中能量的变化,则该反应是
②反应过程中测得CO2和CH3OH(g)的浓度随时间变化如图2所示:3 min时的正反应速率
您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐3】研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)现有反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0。在850℃时,K=1。
CH3OH(g)+H2O(g) ΔH<0。在850℃时,K=1。
①如果上述反应的平衡常数K值变大,该反应___ (填字母)。
a.一定向正反应方向移动 b.在平衡移动过程中正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动过程中逆反应速率先减小后增大
②若反应容器的容积为2.0L,反应时间4.0min,容器内气体的物质的量减小了0.8mol,在这段时间内CO2的平均反应速率为___ 。
③在850℃时,若向1L的密闭容器中同时充入3.0mol CO2、1.0molH2、1.0molCH3OH、5.0molH2O(g),上述反应向___ (填“正反应”或“逆反应”)方向进行。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是___ 。
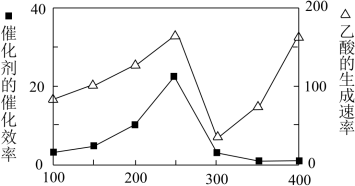
②为了提高该反应中CO2的转化率,可以采取的措施是___ 。(写一条即可)
(1)现有反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH<0。在850℃时,K=1。
CH3OH(g)+H2O(g) ΔH<0。在850℃时,K=1。①如果上述反应的平衡常数K值变大,该反应
a.一定向正反应方向移动 b.在平衡移动过程中正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动过程中逆反应速率先减小后增大
②若反应容器的容积为2.0L,反应时间4.0min,容器内气体的物质的量减小了0.8mol,在这段时间内CO2的平均反应速率为
③在850℃时,若向1L的密闭容器中同时充入3.0mol CO2、1.0molH2、1.0molCH3OH、5.0molH2O(g),上述反应向
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是

②为了提高该反应中CO2的转化率,可以采取的措施是
您最近半年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】乙烷在一定条件下可脱氢制得乙烯:C2H6(g) C2H4(g)+H2(g) △H1>0。常压下,在某催化剂作用下按照n(C2H6):n(O2)=1:1投料制备乙烯,体系中C2H4和CO在含碳产物中的物质的量百分数及C2H6转化率随温度的变化如图所示。
C2H4(g)+H2(g) △H1>0。常压下,在某催化剂作用下按照n(C2H6):n(O2)=1:1投料制备乙烯,体系中C2H4和CO在含碳产物中的物质的量百分数及C2H6转化率随温度的变化如图所示。
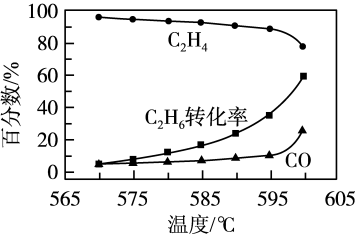
(1)乙烯的物质的量百分数随温度升高而降低的,原因是_____ 。
(2)在570~600℃温度范围内,下列说法正确的有_____ (填字母)。
A.H2O的含量随温度升高而增大。
B.C2H6在体系中的物质的量百分数随温度升高而增大
C.此催化剂的优点是在较低温度下能降低CO的平衡产率
 C2H4(g)+H2(g) △H1>0。常压下,在某催化剂作用下按照n(C2H6):n(O2)=1:1投料制备乙烯,体系中C2H4和CO在含碳产物中的物质的量百分数及C2H6转化率随温度的变化如图所示。
C2H4(g)+H2(g) △H1>0。常压下,在某催化剂作用下按照n(C2H6):n(O2)=1:1投料制备乙烯,体系中C2H4和CO在含碳产物中的物质的量百分数及C2H6转化率随温度的变化如图所示。
(1)乙烯的物质的量百分数随温度升高而降低的,原因是
(2)在570~600℃温度范围内,下列说法正确的有
A.H2O的含量随温度升高而增大。
B.C2H6在体系中的物质的量百分数随温度升高而增大
C.此催化剂的优点是在较低温度下能降低CO的平衡产率
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:
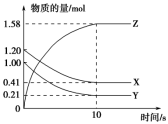
(1)从反应开始到10 s,用Z表示的反应速率为____________ Y的转化率为_____________ 。
(2)该反应的化学方程式为____________________________ 。
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图象如图所示:则下列说法符合该图象的是___________ 。

A.t1时刻,增大了X的浓度
B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积
D.t1时刻,使用了催化剂

(1)从反应开始到10 s,用Z表示的反应速率为
(2)该反应的化学方程式为
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图象如图所示:则下列说法符合该图象的是

A.t1时刻,增大了X的浓度
B.t1时刻,升高了体系温度
C.t1时刻,缩小了容器体积
D.t1时刻,使用了催化剂
您最近半年使用:0次




