在水溶液中[Fe(H2O)6]2+与2,2ˊ一联吡啶(bpy)发生下面逐级配位反应:
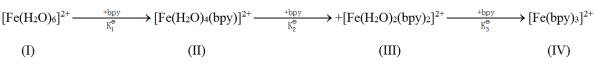
实验发现逐级稳定常数K 比K
比K 、K
、K 大得多。
大得多。
(1)试指出(I)~(IV)物种中Fe2+离子的杂化类型分别为___ 、___ 、___ 、___ ;
(2)K 非常大的原因是
非常大的原因是______ 。

实验发现逐级稳定常数K
 比K
比K 、K
、K 大得多。
大得多。(1)试指出(I)~(IV)物种中Fe2+离子的杂化类型分别为
(2)K
 非常大的原因是
非常大的原因是
更新时间:2021-08-17 19:38:18
|
相似题推荐
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐1】Ⅰ.光刻技术需利用深紫外激光,我国是唯一掌握通过非线性光学晶体变频来获得深紫外激光技术的国家。目前唯一实用化的晶体是KBBF(含K、B、Be、O、F元素)。回答下列有关问题:
(1)氟硼酸钾是制备KBBF的原料之一,高温下分解为KF和BF3,KF的沸点比BF3的高,原因是_____________________ 。
(2)BF3易水解得到H3BO3 (硼酸)和氢氟酸。H3BO3和 中,B原子的杂化类型分别为
中,B原子的杂化类型分别为___________ 、___________ 。
Ⅱ.(3)如下图所示为二维平面晶体示意图,所表示的化学式为AX3的是___________ 。

Ⅲ.如图为一个金属铜的晶胞,请完成以下各题。
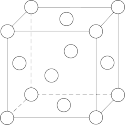
(4)铜元素在周期表中的位置是___________ 。
(5)该晶胞“实际”拥有的铜原子数是___________ 个。
(6)该晶胞称为___________ (填字母)。,
A.六方晶胞 B.体心立方晶胞 C.面心立方晶胞 D.简单立方晶胞
(7)此晶胞立方体的边长为a cm,金属铜的密度为ρg∙cm−3,则阿伏加德罗常数可表示为___________ mol-1(用a、ρ表示)。
(1)氟硼酸钾是制备KBBF的原料之一,高温下分解为KF和BF3,KF的沸点比BF3的高,原因是
(2)BF3易水解得到H3BO3 (硼酸)和氢氟酸。H3BO3和
 中,B原子的杂化类型分别为
中,B原子的杂化类型分别为Ⅱ.(3)如下图所示为二维平面晶体示意图,所表示的化学式为AX3的是

Ⅲ.如图为一个金属铜的晶胞,请完成以下各题。

(4)铜元素在周期表中的位置是
(5)该晶胞“实际”拥有的铜原子数是
(6)该晶胞称为
A.六方晶胞 B.体心立方晶胞 C.面心立方晶胞 D.简单立方晶胞
(7)此晶胞立方体的边长为a cm,金属铜的密度为ρg∙cm−3,则阿伏加德罗常数可表示为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐2】有A、B、C、D、E五种元素。其相关信息如下:请回答下列问题:
(1)写出E元素原子基态时的电子排布式________ 。
(2)C元素的第一电离能比氧元素的第一电离能________ (填 “大”或“小”)。
(3)CA3分子中C原子的杂化轨道类型是____ 。
(4)A、C、E三种元素可形成[E(CA3)4]2+配离子,其中存在的化学键类型有______ (填序号)。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl- 取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为____ (填字母)
a.平面正方形 b. 正四面体 c.三角锥形 d. V形
(5)B与D可形成离子化合物,其晶胞结构如图所示。其中D离子的配位数为____ ,若该晶体的密度为ag·cm-3,则该晶胞的体积是_____ cm3(写出表达式即可)。
| 元素 | 相关信息 |
| A | A原子的1s轨道上只有1个电子 |
| B | B是电负性最大的元素 |
| C | C的基态原子2p轨道中有三个未成对电子 |
| D | D是主族元素且与E同周期,其最外能层上有两个运动状态不同的电子 |
| E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
(2)C元素的第一电离能比氧元素的第一电离能
(3)CA3分子中C原子的杂化轨道类型是
(4)A、C、E三种元素可形成[E(CA3)4]2+配离子,其中存在的化学键类型有
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl- 取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为
a.平面正方形 b. 正四面体 c.三角锥形 d. V形
(5)B与D可形成离子化合物,其晶胞结构如图所示。其中D离子的配位数为
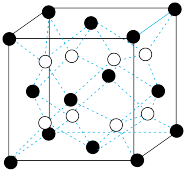
您最近一年使用:0次
【推荐3】根据题意填空
(1)CH3COOH中C原子的杂化轨道类型为___________ 。
(2)化合物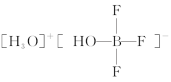 中阳离子的空间构型为
中阳离子的空间构型为___________ ,阴离子的中心原子轨道采用___________ 杂化。
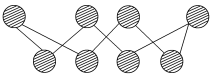
(3) S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是___________ 。
(4)乙醇(CH3CH2OH)与二甲醚(CH3OCH3)的分子式均为C2H6O,但CH3CH2OH的沸点高于CH3OCH3的沸点,其原因是___________ 。
(5)AlCl3分子构型为平面三角形,则AlCl3分子为___________ (填“极性”或“非极性”,下同)分子,其分子中的共价键类型为___________ 键。
(6)BF3的熔点比BCl3___________ (填“高”“低”或“无法确定”)。
(7)下列含氧酸中酸性最强的是___________
A.HClO2 B.H2SeO3 C.H3BO3 D.HMnO4
(8)S、Cl组成的一种化合物的分子结构与H2O2相似,则此化合物的结构式为___________ ;
(9)已知CO与N2互为等电子体,则CO的电子式为___________ 。
(1)CH3COOH中C原子的杂化轨道类型为
(2)化合物
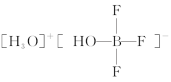 中阳离子的空间构型为
中阳离子的空间构型为(3) S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是

(4)乙醇(CH3CH2OH)与二甲醚(CH3OCH3)的分子式均为C2H6O,但CH3CH2OH的沸点高于CH3OCH3的沸点,其原因是
(5)AlCl3分子构型为平面三角形,则AlCl3分子为
(6)BF3的熔点比BCl3
(7)下列含氧酸中酸性最强的是
A.HClO2 B.H2SeO3 C.H3BO3 D.HMnO4
(8)S、Cl组成的一种化合物的分子结构与H2O2相似,则此化合物的结构式为
(9)已知CO与N2互为等电子体,则CO的电子式为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐1】按要求回答下列问题:
(1)2-甲基-1-丁烯的结构简式_______ ;
(2)相对分子质量为72且一氯代物只有一种的烷烃的结构简式_______ ;
(3)肼( )可用作火箭燃料等,它的沸点远高于乙烯的原因是:
)可用作火箭燃料等,它的沸点远高于乙烯的原因是:_______ 。
(4)分子式为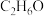 的有机物,有两种同分异构体,乙醇(
的有机物,有两种同分异构体,乙醇( )、甲醚(
)、甲醚( ),则通过下列方法,不可能将二者区别开来的是_______;
),则通过下列方法,不可能将二者区别开来的是_______;
(5)在物质鉴别时,常用溴水来鉴别烷烃和烯烃,请写出乙烯使溴水褪色的反应方程式:_______
(6)尿素(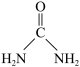 )中碳原子杂化类型
)中碳原子杂化类型_______
(1)2-甲基-1-丁烯的结构简式
(2)相对分子质量为72且一氯代物只有一种的烷烃的结构简式
(3)肼(
 )可用作火箭燃料等,它的沸点远高于乙烯的原因是:
)可用作火箭燃料等,它的沸点远高于乙烯的原因是:(4)分子式为
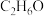 的有机物,有两种同分异构体,乙醇(
的有机物,有两种同分异构体,乙醇( )、甲醚(
)、甲醚( ),则通过下列方法,不可能将二者区别开来的是_______;
),则通过下列方法,不可能将二者区别开来的是_______;| A.红外光谱 | B.核磁共振氢谱 | C.元素分析仪 | D.与钠反应 |
(6)尿素(
 )中碳原子杂化类型
)中碳原子杂化类型
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐2】请按要求填空:
(1)下列轨道表示式能表示基态氮原子的是___________(填标号)。
(2)HCHO的中心原子的价层电子对数为___________ ;其中基态氧原子的核外电子的空间运动状态有___________ 种。
(3)已知邻羟基苯甲酸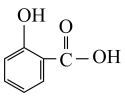 与对羟基苯甲酸
与对羟基苯甲酸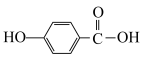 的沸点相差较大,根据结构分析,前者的沸点
的沸点相差较大,根据结构分析,前者的沸点___________ (填高于”或“低于”)后者,并解释原因:___________ 。
(4)普鲁士蓝{KFe[Fe(CN)6]}中不同价态铁元素的简单微粒较稳定的离子的简化核外电子排布式为___________ ,该离子更稳定的原因是___________ 。
(1)下列轨道表示式能表示基态氮原子的是___________(填标号)。
A.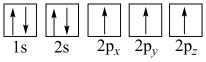 | B. |
C. | D. |
(2)HCHO的中心原子的价层电子对数为
(3)已知邻羟基苯甲酸
 与对羟基苯甲酸
与对羟基苯甲酸 的沸点相差较大,根据结构分析,前者的沸点
的沸点相差较大,根据结构分析,前者的沸点(4)普鲁士蓝{KFe[Fe(CN)6]}中不同价态铁元素的简单微粒较稳定的离子的简化核外电子排布式为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐3】氨化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为原料,经过一系列反应可以得到BF3和BN,流程如图所示。
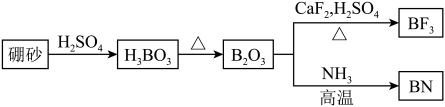
回答下列问题:
(1)BF3分子为____ (填“极性”或“非极性”)分子,该分子中F-B-F键角是____ 。
(2)BF3和过量NaF作用可生成NaBF4,BF 的空间结构为
的空间结构为____ ,NaBF4中____ (填“含有”或“不含”)配位键。
(3)六方氮化硼具有的平面层状结构如图所示,层内B原子与N原子之间的化学键为____ 共价键(填“极性”或“非极性”),B、N原子的杂化形式分别是____ 、____ 。

(4)BF3的沸点低于BCl3,原因是____ 。

回答下列问题:
(1)BF3分子为
(2)BF3和过量NaF作用可生成NaBF4,BF
 的空间结构为
的空间结构为(3)六方氮化硼具有的平面层状结构如图所示,层内B原子与N原子之间的化学键为

(4)BF3的沸点低于BCl3,原因是
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐1】将 通入微酸性的
通入微酸性的 溶液中,生成
溶液中,生成 和白色沉淀(A)。将白色沉淀(A)与硫酸混合加热最终可制得纳米Cu。
和白色沉淀(A)。将白色沉淀(A)与硫酸混合加热最终可制得纳米Cu。
已知:白色沉淀(A)中含有Cu+及正四面体型离子和三角锥型离子,三种离子物质的量之比为1∶1∶1。
(1)正四面体型结构的离子为___________ (填化学式,下同):三角锥型结构的离子为:___________ 。
(2)写出生成白色沉淀(A)的离子方程式:___________ 。
(3)①理论上纳米Cu的产率为:___________ 。
②若将白色沉淀(A)与硫酸置于密闭容器中反应,则理论上纳米Cu的产率将___________ (填“增大”、“不变”、“减小”),理由为:___________ 。
 通入微酸性的
通入微酸性的 溶液中,生成
溶液中,生成 和白色沉淀(A)。将白色沉淀(A)与硫酸混合加热最终可制得纳米Cu。
和白色沉淀(A)。将白色沉淀(A)与硫酸混合加热最终可制得纳米Cu。已知:白色沉淀(A)中含有Cu+及正四面体型离子和三角锥型离子,三种离子物质的量之比为1∶1∶1。
(1)正四面体型结构的离子为
(2)写出生成白色沉淀(A)的离子方程式:
(3)①理论上纳米Cu的产率为:
②若将白色沉淀(A)与硫酸置于密闭容器中反应,则理论上纳米Cu的产率将
您最近一年使用:0次



